
探讨混合现实(MR)术中导航联合三维可视化对复杂肝癌切除的临床运用价值。
回顾性分析南通市肿瘤医院肝胆外科在2015年9月—2017年10月因复杂性肝癌而施行肝切除术的50例患者的临床资料,随机分为对照组和试验组,试验组22例,术前采用三维可视化技术进行术前评估,术中采用MR导航技术;对照组28例,未采用三维可视化和MR导航。试验组和对照组的手术者相同。对两组患者术前、术中和术后指标进行对比和分析。
两组患者的术前指标差异均无统计学意义。术中指标中,试验组较对照组的手术时间[(82.3±10.4)min与(96.6±22.7)min]及肝门阻断时间[(12.2±3.8)min与(15.8±4.2)min]均明显缩短、术中出血量[(486.4±118.5)ml与(567.2±142.8)ml]及术中输血量[(1.8±0.2)U与(2.5±0.6)U]均明显减少,差异有统计学意义;术后指标中,试验组术后并发症总的发生率(4/22与13/28)比对照组低,差异有统计学意义。
对需行复杂肝癌切除的患者,采用MR术中导航技术联合术前三维可视化技术可以明显减少手术时间、肝门阻断时间、术中出血量及输血量,明显降低术后并发症总的发生率,具有临床推广价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝癌是病死率最高的恶性肿瘤之一[1]。肝切除术仍是原发性肝癌的主要治疗方法。而由于肝内血管、胆管分支复杂且多变异,肝肿瘤与大血管关系密切等原因使得肝癌手术难度大、风险高[2,3],尤其是复杂性肝癌。复杂性肝癌目前尚无统一定义,我中心采用"复杂性肝脏肿瘤三维可视化精准诊治专家共识"中较为认同的定义[4,5]。目前,三维可视化技术在肝癌诊断、手术可行性评价及手术计划制定方面的应用价值已得到广泛认可[4,6],通过将薄层CT的数据转化为肝脏及其内管道的三维重建图像而完成全面的术前规划。混合现实(MR)技术则可以在术中进行实时导航。本研究通过分析术中MR导航联合术前三维可视化技术对复杂性肝癌切除的手术效果,来评估MR导航联合三维可视化对复杂性肝癌切除的应用价值。
本研究采用回顾性研究方法。收集南通市肿瘤医院肝胆外科在2015年9月至2017年10月期间因复杂性肝癌而行肝切除的50例患者的临床资料,数字随机分为对照组和试验组(试验组22例,对照组28例)。50例患者一般资料见表1。实验组均采用三维可视化技术行术前评估及MR术中导航;对照组未进行三维重建及MR导航。两组患者的术前资料比较,差异均无统计学意义(均P>0.05,表1)。本研究得到医院伦理委员会的批准和患者的知情同意。
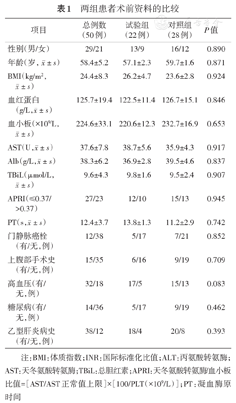
两组患者术前资料的比较
两组患者术前资料的比较
| 项目 | 总例数(50例) | 试验组(22例) | 对照组(28例) | P值 |
|---|---|---|---|---|
| 性别(男/女) | 29/21 | 13/9 | 16/12 | 0.890 |
年龄(岁, ± s) ± s) | 58.4±5.2 | 57.1±2.3 | 59.7±1.6 | 0.871 |
BMI(kg/m2, ± s) ± s) | 24.4±8.3 | 26.2±4.7 | 23.6±2.8 | 0.924 |
血红蛋白(g/L, ± s) ± s) | 125.7±19.4 | 122.5±11.4 | 126.7±15.1 | 0.846 |
血小板(×109/L, ± s) ± s) | 224.6±33.1 | 220.6±12.3 | 232.7±16.9 | 0.653 |
AST(U, ± s) ± s) | 37.6±7.8 | 38.7±5.6 | 35.9±4.3 | 0.917 |
Alb(g/L, ± s) ± s) | 38.3±6.2 | 36.9±2.8 | 39.5±4.6 | 0.837 |
TBiL(μmol/L, ± s) ± s) | 9.6±4.3 | 9.8±1.6 | 9.5±2.4 | 0.907 |
| APRI(≤0.37/>0.37) | 27/23 | 12/10 | 15/13 | 0.945 |
PT(s, ± s) ± s) | 12.4±3.7 | 13.8±1.3 | 11.2±2.9 | 0.742 |
| 门静脉癌栓(有/无,例) | 12/38 | 5/17 | 7/21 | 0.852 |
| 上腹部手术史(有/无,例) | 15/35 | 6/16 | 9/19 | 0.709 |
| 高血压(有/无,例) | 32/18 | 17/5 | 15/13 | 0.083 |
| 糖尿病(有/无,例) | 14/36 | 5/17 | 9/19 | 0.462 |
| 乙型肝炎病史(有/无,例) | 38/12 | 18/4 | 20/8 | 0.393 |
注:BMI:体质指数;INR:国际标准化比值;ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶;TBiL:总胆红素;APRI:天冬氨酸转氨酶/血小板比值=[AST/AST正常值上限]×[100/PLT(×109/L)];PT:凝血酶原时间
两组患者均行全腹部薄层CT(128排)平扫及增强检查:仰卧位头足方向,扫描平面从膈肌至髋关节。扫描数据传至三维影像工作站,以visual3D软件(北京维卓致远医疗科技有限责任公司)建立三维可视化模型,并通过3D打印机,打印包含肝肿瘤、肝内血管和胆管的3D模型(图1,图2)。



(1)术后病理均为原发性肝癌。(2)符合"复杂性肝脏肿瘤三维可视化精准诊治专家共识"中定义的复杂性肝癌,即符合下列情况之一:波及肝门的中央型肝癌(即位于第Ⅰ、Ⅳ、Ⅴ、Ⅷ段,分为5型)[4,7];肝内的肝动脉、门静脉或肝静脉至少有一种变异(肝动脉十种变异、门静脉五种变异、肝静脉多种变异)[8,9,10];肝内胆管或血管受压迫而明显变形;致右心房和(或)下腔静脉瘤栓形成;需行极量肝切除术;肝第Ⅷ段切除术[4]。(3)年龄在30~70岁。(4)术前评估和术中探查无转移病灶。(5)肝功能Child评级A级,或B级经治疗后调整为A级。肝脏排泄功能ICG评分<14%。(6)术前评估残余肝体积有肝硬化者≥40%、无肝硬化者≥30%。(7)临床资料完整。
试验组的CT数据传至三维影像工作站建立三维模型,从而清晰地展现肿瘤方位及其与邻近结构的关系(图2)。对无明确手术禁忌证的患者,在工作站上对已建立的模型进行仿真手术。利用基于体素的方法测算预切除体积和剩余体积[4, 11]。我们在临床工作中要求对正常肝脏应保留30%以上,而肝硬化者应保留40%以上。对预计残余肝体积有肝硬化者≥40%、无肝硬化者≥30%的患者行肝切除术,否则行以介入为主的综合治疗。经过仿真手术,提前发现肝内变异,进而调整手术计划,优化手术方案。对术中可能出现的情况进行预测并预备处理方案。对照组未行三维重建,除外手术禁忌证并评估肝功能储备良好者行手术治疗。
(1)对照组:全麻后,患者60°左侧卧位,常规消毒铺巾,选右上腹部肋缘下切口。结扎离断肝圆韧带,分离粘连。探查除外转移及附近器官侵犯后行肝切除术。首先适当解剖肝十二指肠韧带,预置肝门阻断带,备行Pringle法阻断入肝血流。分离肝周韧带,使肝脏下降,较表浅的肿瘤依据手感定位并确定预切线,位于肝内较深的肿瘤依据术中超声定位而确定预切线。在肝表面用电刀标记预切线。于预切线外侧约1.0 cm处以7号丝线间断缝线打结,留置缝线作牵引。以超声刀沿预切线切开肝包膜,并小心分离肝实质,直到遇到较大的血管支时行肝门阻断,血管及胆管支钳夹后离断、缝扎。继续分离肝实质,最终切除肿瘤,肝断面止血后解除肝门阻断。不合并肝硬化的患者术中肝门血流阻断不超过20 min,合并肝硬化患者肝门阻断不超过15 min,必要时间隔5 min后重复阻断。肿瘤切除后,肝断面彻底止血,清理腹腔后放置引流管结束手术。(2)试验组:麻醉、体位、切口、探查及预置肝门阻断带均同对照组。台上手术人员及台下助手均佩戴MR眼镜(美国微软hololens),台下助手操作平板电脑(华为M3平板)的3DSpaceSite软件(北京维卓致医疗科技有限责任公司),实时调整MR影像,使其与患者肝脏重叠,手术于MR导航下进行。手术人员的视野是三维的空间立体视野,在立体视野中,透过肝实质直视肿瘤,距肿瘤边缘1.0~1.5 cm为预切线,在肝表面用电刀标记预切线,沿预切线外约1.0 cm处间断外缝线牵引,沿预切线打开肝包膜,分离肝实质,并迅速找到目标血管(与肿瘤关系密切的大血管),同对照组以Pringle法阻断肝门并切除肿瘤。切除后处理同对照组。
(1)观察指标:术中、术后指标分别见表2,表3。(2)评价标准:手术时间:自切皮开始至完成切口包扎;术中出血(g)=血纱布总质量(g)-干纱布总质量(g)+吸引器瓶中血量(g),1 g以1.16 ml计算。胆瘘:腹水量每天不少于10 ml,内有大量胆汁,且连续超过5 d。胃瘫:除外其他原因所致胃排空障碍,在拔除胃管进食时出现恶心呕吐。腹腔出血:腹腔引流液呈鲜红色。腹泻:胃肠道功能恢复后,大便呈黄色稀水样,5~8次/d。肺部感染的诊断标准参照文献[12]。腹腔感染:术后3 d出现畏寒、高热、腹胀、肠麻痹等症状,持续超过24 h,实验室检测提示感染。
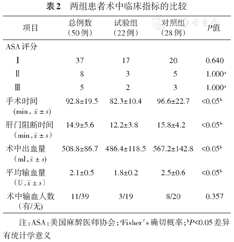
两组患者术中临床指标的比较
两组患者术中临床指标的比较
| 项目 | 总例数(50例) | 试验组(22例) | 对照组(28例) | P值 | |
|---|---|---|---|---|---|
| ASA评分 | |||||
| Ⅰ | 37 | 17 | 20 | 0.640 | |
| Ⅱ | 8 | 3 | 5 | 1.000a | |
| Ⅲ | 5 | 2 | 3 | 1.000a | |
手术时间(min, ± s) ± s) | 92.8±19.5 | 82.3±10.4 | 96.6±22.7 | <0.05b | |
肝门阻断时间(min, ± s) ± s) | 14.9±5.6 | 12.2±3.8 | 15.8±4.2 | <0.05b | |
术中出血量(ml, ± s) ± s) | 508.8±86.7 | 486.4±118.5 | 567.2±142.8 | <0.05b | |
平均输血量(U, ± s) ± s) | 2.1±0.5 | 1.8±0.2 | 2.5±0.6 | <0.05b | |
| 术中输血人数(有/无) | 11/39 | 3/19 | 8/20 | 0.357 | |
注:ASA:美国麻醉医师协会;aFisher′s确切概率;bP<0.05差异有统计学意义
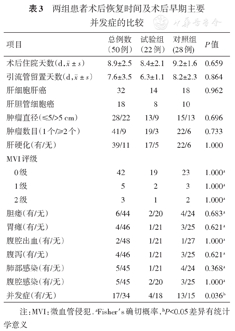
两组患者术后恢复时间及术后早期主要并发症的比较
两组患者术后恢复时间及术后早期主要并发症的比较
| 项目 | 总例数(50例) | 试验组(22例) | 对照组(28例) | P值 | |
|---|---|---|---|---|---|
术后住院天数(d, ± s) ± s) | 8.9±2.5 | 8.4±2.1 | 9.2±1.6 | 0.659 | |
引流管留置天数(d, ± s) ± s) | 7.6±3.5 | 6.3±1.1 | 8.2±2.3 | 0.864 | |
| 肝细胞肝癌 | 32 | 14 | 18 | 0.962 | |
| 肝胆管细胞癌 | 18 | 8 | 10 | ||
| 肿瘤直径(≤5/>5 cm) | 28/22 | 13/9 | 15/13 | 0.696 | |
| 肿瘤数目(1个/≥2个) | 41/9 | 19/3 | 22/6 | 0.733 | |
| 肝硬化(有/无) | 39/11 | 17/5 | 22/6 | 1.000 | |
| MVI评级 | |||||
| 0级 | 42 | 19 | 23 | 1.000a | |
| 1级 | 5 | 2 | 3 | 1.000a | |
| 2级 | 3 | 1 | 2 | 1.000a | |
| 胆瘘(有/无) | 6/44 | 2/20 | 4/24 | 0.683a | |
| 胃瘫(有/无) | 4/46 | 1/21 | 3/25 | 0.621a | |
| 腹腔出血(有/无) | 2/48 | 1/21 | 1/27 | 1.000a | |
| 腹泻(有/无) | 4/46 | 1/21 | 3/25 | 0.621a | |
| 肺部感染(有/无) | 5/45 | 1/21 | 4/24 | 0.368a | |
| 腹腔感染(有/无) | 5/45 | 2/20 | 3/25 | 1.000a | |
| 并发症(有/无) | 17/34 | 4/18 | 13/15 | 0.036b | |
注:MVI:微血管侵犯. aFisher′s确切概率,bP<0.05差异有统计学意义
数据分析计算应用SPSS 17.0,正态分布的计量资料表示为 ±s,组间比较用t检验;偏态分布的计量资料以M表示,计数资料之间的比较用χ2检验或者Fisher确切概率。检验水准α=0.05。
±s,组间比较用t检验;偏态分布的计量资料以M表示,计数资料之间的比较用χ2检验或者Fisher确切概率。检验水准α=0.05。
复杂肝癌相比常规肝癌的手术难度及风险均较高,尤其是存在CT及磁共振检查均难以发现的肝静脉变异时[4],因肝静脉引流障碍将对肝血运障碍产生明显影响[13,14]。三维可视化技术可以直观地呈现肝血管的分布及变异,MR导航则可以在术中准确定位肝静脉。
传统手术中需边分离肝实质边寻找血管及胆管,如术中发现肝内变异,还需辨认变异类型,并考虑是否更改手术方案,切除过程耗时较长。而通过仿真手术,可在术前明确肝内变异,并通过修正而获得最优的个体化手术方案,术中按术前规划进行,有的放矢,缩短手术时间。同时在MR导航下,术者直视肿瘤及周边血管,目标明确,可迅速处理,进一步缩短手术时间。
术中失血量和输血量对术后并发症发生率有很大影响,所以减少术中失血和输血对提高手术治疗效果有重要意义[15]。而MR技术则可实现精确的术中实时导航,明确血管位置,既保证了手术安全性,又缩短了阻断肝门血流的时间、减少术中出血量及输血量。
本研究采用回顾性分析,排除了BMI、AST与血小板比值(APRI)等影响肝切除术后并发症发生率的因素[16,17]。对复杂性肝癌患者,三维可视化技术可以在术前预先计算切除及剩余肝脏体积,精确判定手术可行性。MR导航技术能在术中清晰地展现肿瘤及周边血管和胆管,使术者透过肝实质,直视肿瘤和血管,进而使手术时间和肝门血流阻断时间缩短,术中出血量和输血量减少,术后并发症发生率降低。本研究中入组患者生存情况需进一步随访研究。
所以,我们得出结论:术中MR导航技术联合三维可视化技术在复杂性肝癌肝切除术中具有临床推广价值。
所有作者均声明不存在利益冲突



























