
本研究通过病例对照的方法,分析肝癌相关脑梗死与单纯肝癌患者的临床资料,发现血浆AFP、D-二聚体、血小板升高是肝癌相关脑梗死发生的独立危险因素;提示AFP可能通过激活血小板的途径导致肝癌相关脑梗死的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
癌症患者发生脑梗死的风险增高[1,2],提示部分患者脑梗死的发生与癌症相关,即癌症相关脑梗死。新近研究显示,癌症相关脑梗死的发生可能与癌症侵犯临近的左心房、血管[3,4]、导致非感染性血栓性心内膜炎[5,6]及血液高凝状态[7,8]等有关。然而,前期癌症相关脑梗死的研究是以"癌症患者"为研究对象开展的,难以发现确切的癌症相关脑梗死发生机制。肝癌是细胞成分较为单一的癌症,而且既往的研究提示肝癌相关脑梗死(liver cancer- related stroke,LCRS)理论上存在[1]。然而LCRS的研究尚罕见报道。本研究回顾性分析LCRS患者的临床资料,旨在探讨其的可能发病机制。
选择2006年1月至2016年12月在广西医科大学第一附属医院住院的LCRS患者作为试验组;同时按照1∶2的比例连续性收集同期住院治疗的年龄、性别相匹配的单纯肝癌患者(liver cancer,LC)作为对照组。
LCRS组入组标准:参考Guo等[9]定义"癌症相关脑梗死"的方法,将LCRS定义为:肝癌尚未治愈、合并急性脑梗死、且无高血压、糖尿病及高血脂等常见脑卒中危险因素的患者。原发性肝癌的诊断参照法国Giammarile等[10]的标准。脑梗死的诊断参照美国心脏协会/美国卒中协会最新修订的脑梗死诊断标准[11]。排除标准:排除肝癌诊断5年以上、无证据表明肝癌复发或转移且合并脑梗死的患者;肝癌发生颅内转移的患者;肝癌合并脑出血等其他神经系统疾病患者;排除存在心、肺、肝、肾等重要器官功能衰竭的患者。入组的患者分别由对本研究不知情的肿瘤学、神经病学专家各1名共同审核确定。本研究获得广西医科大学第一附属医院医学伦理委员会批准[批准号:2018(KY-E-0530)]。
收集2组患者临床资料:收集患者的一般情况及高血压等传统脑卒中危险因素;主要临床表现、病理类型、是否转移、相关治疗方案等肝癌相关资料;主要症状、梗死部位及治疗措施等脑梗死相关资料。同时收集血常规、血生化、凝血指标、D-二聚体、甲胎蛋白(alpha fetoprotein,AFP)等肿瘤标志物以及心电图、心脏彩超、颈部血管多普勒、头颈部CTA、头颅MRI等检查结果资料。为了尽可能减少因为肝癌进展对患者运动功能的影响,在脑梗死发病30 d,采用改良Rankin量表(mRS)评分评估患者的预后,mRS≥3分为预后不良。
运用SPSS 20.0软件进行统计分析,计量资料以 ±s表示,计量资料采用两独立样本t检验分析,计数资料采用χ2检验、Fisher法分析。对两组患者临床资料比较中有意义的变量(P<0.05),进一步进行Logistic回归分析,以筛选肝癌发生脑梗死的危险因素,采用Pearson相关分析研究AFP与D-二聚体、血小板之间的相关关系。P<0.05为差异有统计学意义。
±s表示,计量资料采用两独立样本t检验分析,计数资料采用χ2检验、Fisher法分析。对两组患者临床资料比较中有意义的变量(P<0.05),进一步进行Logistic回归分析,以筛选肝癌发生脑梗死的危险因素,采用Pearson相关分析研究AFP与D-二聚体、血小板之间的相关关系。P<0.05为差异有统计学意义。
本研究共筛查肝癌患者12 518例,其中肝癌合并脑梗死患者87例(0.69%),符合LCRS入组标准患者56例(0.45%),男50例,女6例,年龄(65±9)岁;录入LC患者112例,两组患者性别、年龄差异无统计学意义(表1)。
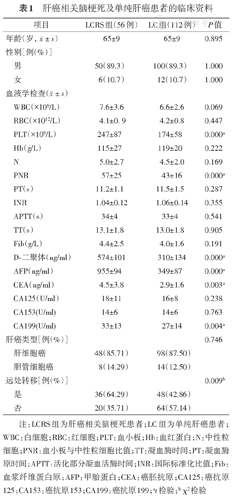
肝癌相关脑梗死及单纯肝癌患者的临床资料
肝癌相关脑梗死及单纯肝癌患者的临床资料
| 项目 | LCRS组(56例) | LC组(112例) | P值 | |
|---|---|---|---|---|
年龄(岁, ± s) ± s) | 65±9 | 65±9 | 0.895 | |
| 性别[例(%)] | ||||
| 男 | 50(89.3) | 100(89.3) | 1.000 | |
| 女 | 6(10.7) | 12(10.7) | 1.000 | |
血液学检查( ± s) ± s) | ||||
| WBC(×106/L) | 7.6±3.6 | 6.6±2.6 | 0.069 | |
| RBC(×1012/L) | 4.1±0. 9 | 4.2±0.8 | 0.447 | |
| PLT(×109/L) | 247±87 | 174±58 | 0.000a | |
| Hb(g/L) | 115±27 | 119±20 | 0.222 | |
| N | 5.0±2.7 | 4.5±2.0 | 0.169 | |
| PNR | 57±25 | 43±16 | 0.000a | |
| PT(s) | 11.2±1.1 | 11.5±1.5 | 0.287 | |
| INR | 1.04±0.12 | 1.06±0.14 | 0.355 | |
| APTT(s) | 34±4 | 33±4 | 0.541 | |
| TT(s) | 13.1±1.8 | 13.0±1.8 | 0.905 | |
| Fib(g/L) | 4.4±2.5 | 4.0±1.6 | 0.191 | |
| D-二聚体(ng/ml) | 574±101 | 310±134 | 0.000a | |
| AFP(ng/ml) | 955±94 | 349±87 | 0.000a | |
| CEA(ng/ml) | 4.5±3.8 | 2.9±1.6 | 0.003a | |
| CA125(U/ml) | 18±11 | 16±8 | 0.238 | |
| CA153(U/ml) | 14±6 | 14±6 | 0.763 | |
| CA199(U/ml) | 33±13 | 27±14 | 0.004a | |
| 肝癌类型[例(%)] | 0.746 | |||
| 肝细胞癌 | 48(85.71) | 98(87.50) | ||
| 胆管细胞癌 | 8(14.29) | 14(12.50) | ||
| 远处转移[例(%)] | 0.009b | |||
| 是 | 36(64.29) | 48(42.86) | ||
| 否 | 20(35.71) | 64(57.14) | ||
注:LCRS组为肝癌相关脑梗死患者;LC组为单纯肝癌患者;WBC:白细胞;RBC:红细胞;PLT:血小板;Hb:血红蛋白;N:中性粒细胞;PNR:血小板与中性粒细胞比值;TT:凝血酶时间;PT:凝血酶原时间;APTT:活化部分凝血活酶时间;INR:国际标准化比值;Fib:血浆纤维蛋白原;AFP:甲胎蛋白;CEA:癌胚抗原;CA125:癌抗原125;CA153:癌抗原153;CA199:癌抗原199;at检验;b χ2检验
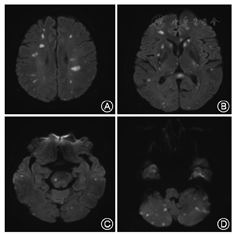
所有患者均有突然出现的肢体乏力、麻木、构音障碍等局灶性神经功能缺失的表现,在症状出现后的3 d内经头颅CT排除脑出血、头颅MRI平扫及DWI证实颅内有可以解释症状的新发病灶,且多数患者(36例,64.29%)头颅MRI显示出现分布于双侧大脑半球、小脑、脑干的多发脑梗死病灶(图1);21 d后再次行头颅MRI平扫和DWI证实上述病灶符合脑梗死改变,且无出血转化和癌性增生的征象;脑梗死发病后30 d,30例(53.57%)患者预后不良,其中死亡8例(14.29%)。

与LC组患者相比,LCRS患者发生远处转移比例更高,且血浆D-二聚体、PLT、血小板与中性粒细胞比值PNR、AFP、CEA、CA199水平更高,差异均有统计学意义(P<0.05)(表1)。
将上述两组比较中P<0.05的变量远处转移、AFP、D-二聚体、CEA、CA199、PLT、PNR纳入多因素Logistic回归分析模型,结果显示血浆AFP(OR=1.002,95%CI 1.000~1.003,P=0.013)、D-二聚体(OR=1.018,95%CI 1.011~1.024,P=0.000)、PLT(OR=1.018,95%CI 1.008~1.028,P=0.000)升高为肝癌发生脑梗死的独立危险因素(表2)。Pearson相关分析结果显示,血浆AFP分别与PLT(r=0.444,P<0.05)和D-二聚体(r=0.676,P<0.05)均呈正相关。
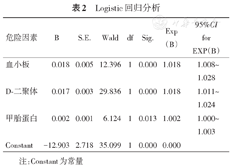
Logistic回归分析
Logistic回归分析
| 危险因素 | B | S.E. | Wald | df | Sig. | Exp(B) | 95%CI for EXP(B) |
|---|---|---|---|---|---|---|---|
| 血小板 | 0.018 | 0.005 | 12.396 | 1 | 0.000 | 1.018 | 1.008~1.028 |
| D-二聚体 | 0.017 | 0.003 | 29.836 | 1 | 0.000 | 1.018 | 1.011~1.024 |
| 甲胎蛋白 | 0.002 | 0.001 | 6.124 | 1 | 0.013 | 1.002 | 1.000~1.003 |
| Constant | -12.903 | 2.718 | 35.099 | 1 | 0.000 | 0.000 |
注:Constant为常量
癌症患者罹患脑梗死的风险增加[1,2],提示癌症相关脑梗死理论上存在。前期以"癌症患者"为对象的研究发现,癌症合并急性脑梗死中、部分患者不存在脑卒中常见的危险因素,其脑梗死的发生可能与癌症有关,即临床上的"癌症相关脑梗死"[9]。既往的研究还发现,癌症有时可以通过侵犯临近血管等途径、直接导致脑梗死的发生[3,4,5,6];癌症相关脑梗死患者常存在血液高凝状态,提示后者可与癌症相关脑梗死的发生有关[7,8]。
瑞典的Zöller等[1]的研究发现,肝癌患者在确诊肝癌后1年内,脑梗死的发生率较正常人群升高为80%,提示部分肝癌患者脑梗死的发生与肝癌有关,即LCRS理论上存在。然而,LCRS的发病机制如何,这值得探讨。本研究以"肝癌合并急性脑梗死、且无常见脑梗死危险因素"的患者为对象,结果发现,与LC组比较,LCRS组患者血浆AFP、D-二聚体、PLT、CEA、CA199以及PNR升高;进一步的回归分析显示血浆AFP、PLT、D-二聚体升高为LCRS的独立危险因素。上述危险因素如何导致LCRS的发生,目前尚不清楚。Jovin等[12]的研究发现,血浆具有黏蛋白特性的癌抗原(CA)125水平显著升高与脑梗死发生有关。此外,动物实验还证实癌细胞分泌的黏蛋白会诱发血小板和中性粒细胞的相互作用,触发血液中微小血栓形成[13]。以上研究提示,癌细胞可能通过分泌具有黏蛋白分泌物诱发血小板与中性粒细胞相互作用,进而导致血液凝固性增高、触发微小血栓形成,最终导致癌症相关脑梗死的发生。本研究中肝癌患者血浆AFP、PLT、D-二聚体升高为LCRS的独立危险因素,而且血浆AFP与PLT呈正相关,提示肝癌细胞分泌具有黏蛋白特点的AFP,也可能通过上述途径,激活血小板、触发血管内微小血栓形成,并最终导致LCRS的发生。然而,仅仅是回顾性的资料,是本研究的不足,上述LCRS的发生机制还需要进一步研究证实。
所有作者均声明不存在利益冲突



























