
探索建立稳定的盆底神经损伤动物模型,用于女性盆底功能障碍性疾病神经损伤机制及治疗方法的研究。
选取55只10周龄未生育SD大鼠,大鼠体质量(220±15)g,雌性。随机数字表法将大鼠分为3组:正常组5只、假手术组(SO)25只和动物模型组(BPNB)25只。正常组大鼠于实验开始时处死并进行阴道前壁的取材,SO组和BPNB组分别于术后3 d、1周、1和3个月处死并进行阴道前壁取材进行组织学、分子检测分析。每组每时间点处死5只。
BPNB组大鼠阴道前壁神经纤维数量较SO组自术后第3天明显降低,至术后1周降至最低值,并可维持至术后3个月;BPNB组大鼠前壁泛素羧基端水解酶(UCHL)mRNA表达水平术后1周、1、3个月均明显低于SO组,巢蛋白(Nestin)mRNA表达水平术后1、3个月明显低于SO组。
双侧阴部神经阻断法制备的盆底神经损伤大鼠模型,可作为盆底障碍性疾病盆底神经损伤较为稳定、实用的动物模型。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
盆底功能障碍性疾病(PFD)严重影响中老年女性的健康及生活质量,但目前其发病机制尚不明确。已有的研究证实PFD不仅存在盆底神经损伤和肽类神经递质异常,同时盆底肌肉普遍存在失神经支配现象,揭示了盆底神经损伤机制是PFD发生发展中的重要环节[1]。随着对PFD发病高危因素的深入了解,盆底支持结构的神经损伤机制成了PFD病因学研究及优化目前诊治方法探索研究新的切入点和热点[2]。本实验拟建立一种结果稳定、构建简单的盆底神经损伤的动物模型,以为将来拓展PFD治疗的研究提供可靠的动物模型。
Trizol(Invitrogen公司)、RNA酶抑制剂(TaKaRa公司)、2×SYBR PCR mixture(ABI公司)、一抗:UCHL(CST公司)、二抗:辣根过氧化物酶偶联山羊抗兔和山羊抗小鼠二抗(Santa cruz公司)、苏木精-伊红染液(武汉谷歌生物科技)、苏木精染液(武汉谷歌生物科技)、正常兔血清(Boster)、BSA(Solarbio)、ABI 2720PCR仪(Applied Biosystems公司)、正置光学显微镜(日本尼康)。
选取55只10周龄未生育SD大鼠,体质量(220±15)g,雌性。随机数字表法将大鼠分为3组:正常组(5只)、假手术组(25只)和动物模型组(25只)。正常组大鼠不做处理,动物模型组进行双侧阴部神经阻断术,假手术组进行与双侧阴部神经阻断术类似的手术操作,手术中游离双侧阴部神经,但不切断双侧阴部神经。正常组大鼠于实验开始时处死并进行阴道前壁的取材,假手术组和动物模型组分别于术后3 d、1周、1个月和3个月处死并进行阴道前壁取材。每组每时间点处死5只。大鼠双侧阴部神经阻断术:腹腔注射5%水合氯醛(0.7 ml/100 g体质量)麻醉。由近臀侧背部正中线打开皮肤,钝性分离皮下筋膜,由脊柱侧缘向外沿臀大肌边缘打开肌层,暴露出股外侧肌及内收大肌的间隙,其中可见沿股骨走向的坐骨神经。沿腰骶干向上游离,看到其分支股后皮神经。继续向上分离,于近脊柱处可见两支神经分支,近处一支即为阴部神经,与阴部内动、静脉伴行,远处一支为盆底神经肌支,向内下方延伸。从阴部神经起始处向远端游离8~10 mm,切断双侧阴部神经约2~3 mm。腹腔注射头孢呋辛钠预防感染。
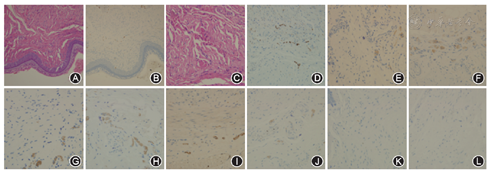
阴道前壁制备石蜡切片采用免疫组织化学染色,方法参见文献[3],显微镜下观察神经纤维呈棕色,分别于100倍及200倍视野下观察并拍照,可见阴道前壁上皮下层内神经纤维弥散分布。于400倍视野下计数每个视野内神经纤维数量并拍照,共每张切片进行10个视野计数。
(1)细胞总RNA的提取:①于液氮中取出组织样本,置入1.5 ml EP管中,向内加入100 μl Trizol,剪刀剪碎组织至组织碎片<1 mm,操作于冰上进行。②向EP管内加入900 μl Trizol,冰上静置10 min,涡旋振荡30 s,冰上再次放置10 min,待Trizol溶解组织碎片。③RNA的萃取、沉淀、清洗、干燥及溶解。(2)cDNA的合成及Real time PCR反应:Real time PCR反应所用引物序列如下:GAPDH:F:GATGGTGAAGGTCGGTGTGA;R:TGAACTTGCC GTGGGTAGAG。UCHL-1:F:ACGCAGTGGCCAA TAACCAA;R:TTTGTCGTCTACCCGGCAC。Nestin:F:GACCTCCTTAGCCACAACCC;R:GTTC CCAGATTTGCCCCTCA。
所有数据以 ±s表示,基因相对表达量的比较采用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
±s表示,基因相对表达量的比较采用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
大鼠阴道前壁中有细小周围神经弥散分布,泛素羧基端水解酶(UCHL)蛋白广泛分布于神经细胞胞体和轴突,是神经组织最常用的特异性蛋白。采用免疫组化染色方法使UCHL蛋白着色(图1),显微镜下观察并计数阴道前壁神经纤维的数量(表1)。结果发现,正常大鼠阴道前壁神经纤维含量为(18.5±2.9)个/高倍视野(HPF),假手术组(SO)阴道前壁神经纤维数量与正常组无明显差异,而双侧阴部神经阻断组(BPNB)阴道前壁神经纤维数量自术后第3天便明显降低,至术后1周降至最低值,并可维持至术后3个月(图2),各时间点明显低于假手术组(图2)。提示双侧阴部神经阻断术后,大鼠阴道前壁神经纤维数量明显减少。
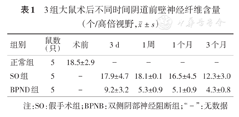
3组大鼠术后不同时间阴道前壁神经纤维含量(个/高倍视野, ±s)
±s)
3组大鼠术后不同时间阴道前壁神经纤维含量(个/高倍视野, ±s)
±s)
| 组别 | 鼠数(只) | 术前 | 3d | 1周 | 1个月 | 3个月 |
|---|---|---|---|---|---|---|
| 正常组 | 5 | 18.5±2.9 | - | - | - | - |
| SO组 | 5 | - | 17.9±4.7 | 18.1±0.1 | 16.5±4.5 | 12.3±3.0 |
| BPND组 | 5 | - | 9.2±3.2 | 5.3±0.9 | 5.1±0.9 | 4.3±0.8 |
注:SO:假手术组;BPNB:双侧阴部神经阻断组;"-":无数据

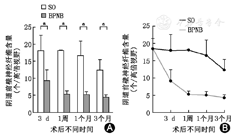

取大鼠阴道前壁组织,提取mRNA,逆转录为cDNA后采用qRT-PCR的方法检测多种神经相关mRNA的表达量(图3)。结果显示,广泛分布于神经元胞体及轴突的标记蛋白UCHL在假手术组中变化不明显,而在双侧阴部神经阻断组中术后3 d变化不明显,术后1周、1、3个月均明显减低(图3A)。神经干细胞标记蛋白Nestin在双侧阴部神经阻断组中术后在术后3 d、1周、3个月差异无统计学意义,术后1、3个月明显低于假手术组(图3B)。上述结果提示双侧阴部神经阻断之后,大鼠阴道前壁的神经元及神经纤维于术后1周开始出现含量降低,神经干细胞的含量在术后1个月可能降低,并均维持至术后3个月。


目前,PFD相关盆腔支持缺陷的病因尚不清楚,鉴于妊娠分娩和衰老与PFD发病关系密切,盆底支持组织的神经损伤学说,如妊娠分娩相关的盆底神经损害和衰老相关的神经退行性变逐渐成为研究者们关注的热点[4]。虽然具体的盆底神经损伤机制尚未完全阐述,已有的文献显示盆底神经损伤的高危因素主要有:(1)妊娠和阴道分娩:妊娠期及阴道分娩时,盆底支持组织持续负重过度扩张,相较于盆底肌肉可以承受相当于200%自身长度的牵拉,周围神经纤维一般可承受6%,超过15%将导致不可逆的神经损伤。当盆底神经纤维被极度牵拉,尤其是多次妊娠及阴道分娩的女性,盆底神经肌肉发生了不可逆的损伤改变[5,6]。(2)年龄:随着年龄增加,衰老的发生,全身脏器包括盆底神经肌肉组织不可避免地发生失神经支配现象[7]。(3)便秘等生活习惯:研究表明,慢性便秘患者阴部神经传导潜伏期延长,便秘或长期提重物等类似的生活习惯可能导致盆底神经肌肉组织长期反复过度牵拉伸张[8]。(4)先天畸形:研究报道隐性骶部发育异常(如脊柱裂)患者较常人发生POP风险增高[9]。
动物模型是研究疾病发生机制及探索新的治疗方法的有效工具,动物模型可在一定程度上模仿疾病的状态,进而进行下一步的研究。目前,已有的PFD的动物模型制作具有很高的挑战性。人类与动物有不同的盆底解剖和功能特点:首先,人类双足着地站立及行走,盆底组织需要承受盆腹腔脏器的重力;其次人类具有相对困难的分娩过程,分娩造成的盆底损伤与动物不同。人类和动物盆底解剖特点的差异,使得PFD的动物模型的制备难度增大。多种动物可用于PFD动物模型的制备,包括小鼠、大鼠、兔子、绵羊、牛、猪、狗、猴子和非人灵长类等。啮齿类动物是最常用的动物模型,具有处理方便、生命周期短、费用低的特点,但啮齿类动物盆底肌水平走向,主要作用是控制尾部活动,啮齿类动物胎儿头颅径线小,盆底组织的分娩损伤小[10]。目前已有的PFD动物模型主要包括盆腔脏器脱垂模型和压力性尿失禁模型。盆腔脏器脱垂模型多数是由动物多次分娩后自发出现盆腔脏器脱垂制作,模型是否成功多数由肉眼观察判别。此外亦有多种基因工程小鼠应用于PFD动物模型的研究中,主要通过基因操作的手段,影响胶原纤维、弹性纤维等盆底支持结构的代谢,从而使盆底组织的支持能力减弱[11,12]。既往曾有阴部神经阻断法用于压力性尿失禁动物模型的建立,相较阴道扩张法和阴部神经钝性损伤,可以获得更为稳定的模型。但已有的有限研究多仅限于评估该法对模型动物漏尿点压力的影响,而未对盆底组织中神经损伤相关表现进行进一步的评估[13]。
盆底提供支持力量的组织主要包括肌肉和胶原结缔组织,其间分布着丰富的神经纤维,主要由交感神经、副交感神经和躯体神经支配。躯体神经的感觉神经和运动神经经阴部神经支配盆底组织。本研究拟通过双侧阴部神经阻断的方法,用来模仿PFD中的神经损伤,制备盆底神经损伤的大鼠模型。UCHL1(ubiquitin carboxyl-termial hydrolases L1)泛素羧基端水解酶L1,属于泛素羧基端水解酶家族,是一种半胱氨酸蛋白酶,广泛分布于神经元胞体及轴突,与神经损伤及退行性疾病有着密切的关系。Nestin是一种中间丝类型的蛋白,能够特异性的表达在神经上皮干细胞上一种分子标志物,为神经干细胞的特征性标志物。本研究采用半定量方法评价神经纤维含量,结果显示BPNB组神经纤维明显减少,通过组织病理学研究揭示了双侧阴部神经阻断后阴道黏膜失神经支配的形态学改变,且证实神经损伤效应可至少持续至术后3个月,为深入了解PFD的神经损伤发病机制研究提供了基础。此外离断双侧阴部神经后,影响神经干细胞功能,进一步阻断了神经的再生修复,保证了疾病动物模型建立的稳定性,为后续PFD相关神经损伤的修复提供了可靠的实验动物模型。
所有作者均声明不存在利益冲突



























