
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊髓性肌萎缩症(spinal muscular atrophy,SMA)是由于脊髓前角及延髓运动神经元变性,导致近端肢体和躯干进行性、对称性肌无力和肌萎缩的神经变性病。尽管SMA可由多种基因突变引起,但一般特指由于运动神经元存活基因1(survival motor neuron,SMN1)突变所导致的常染色体隐性遗传病[1]。该病在欧美人群存活新生儿中的发病率约为1/10 000,携带者频率为1/40~1/50[2],位居2岁以下儿童致死性遗传病的首位。目前中国尚无发病率的确切数据,中国人群中的携带者频率约为1/42[3,4]。随着病情的进展,肌无力可进一步导致骨骼系统、呼吸系统、消化系统及其他系统异常,其中呼吸衰竭是最常见的死亡原因。因此,SMA的治疗往往需要多学科的评估和综合管理。尽管国际同仁已制定了至少两版SMA多学科诊治共识[5,6,7],但由于我国患者多、分布广、经济条件发展不平衡,对本病的诊断、治疗、处理需要一个规范化意见。为此,儿童及成人神经内科、遗传学科、呼吸内科、骨科/脊柱外科、康复医学科、临床营养等专业的专家共同制定了我国SMA多学科管理共识,以协助临床医生、实验室诊断和产前诊断相关人员规范SMA的诊断和治疗。
该病临床表现差异较大,根据患者起病年龄和所获得的最大运动功能,将SMA由重到轻分为4型。
也称Werdnig-Hoffman病,即婴儿型,约占全部SMA病例的45%[8]。患儿出生后6个月内起病,出现迅速发展的进行性、对称性四肢无力,最大运动能力不能达到独坐。肌无力以近端为著,由于显著肌张力低下,平躺时下肢呈"蛙腿"样姿势。患儿表情及眼球运动正常,舌肌束颤,口咽部肌群无力导致哭声低弱、吸吮无力、咽反射减弱,易发生误吸。由于肋间肌受累比膈肌更重,导致矛盾呼吸,胸廓呈现特征性"钟形"畸形(图1)。呼吸肌无力突出,多数患儿在2岁内死于呼吸衰竭[8]。
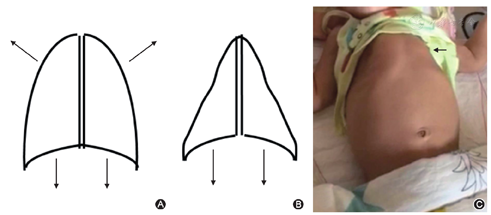

注:图A:正常胸廓示意图,主动呼吸时主要靠肋间外肌和膈肌运动,平静呼气时主要靠胸廓本身的弹性回缩力;吸气时如箭头所指,胸廓充分扩张;图B:"钟形"胸廓示意图,由于肋间肌无力,膈肌是呼吸的主要肌肉,吸气时如箭头所示,胸廓塌陷,肺容积缩小;图C:患儿"钟形"胸廓表现(箭头所示)
也称Dubowitz病,即中间型,约占30%~40%[8]。患者多在生后6~18个月起病,进展较1型慢,最大运动能力可达到独坐,但独坐年龄可能落后于正常同龄儿,不能独站或独走。肌无力以近端为著,下肢重于上肢,面肌及眼外肌不受累,舌肌萎缩伴肌束颤,四肢腱反射消失,肢体远端可观察到肌束颤。随着病程进展,出现吞咽困难、咳嗽无力、呼吸功能不全、脊柱侧弯、关节挛缩等合并症。部分患儿在儿童期丧失独坐能力。尽管寿命缩短,但多数可以活到成年期。
也称Kugelberg-Welander病,即青少年型,约占20%。患者多在出生18个月后起病,早期运动发育正常,可独走,部分独走时间延迟。随年龄增长出现以近端为主的肌无力,下肢重于上肢,最终部分丧失独走能力,逐渐依赖轮椅。随病情进展,可出现肢体肌束颤、足部畸形,部分患者因脊柱侧弯、呼吸功能不全等影响日常生活,预期寿命不缩短或轻度下降[9]。
晚发型,即成人型,早期运动发育正常,成人起病,出现肢体近端无力,进展缓慢,预期寿命不缩短。
位于染色体5q11.2-q13.3的SMN1基因是5q SMA的主要致病基因[10],SMN1基因致病性突变引起编码的运动神经元存活蛋白表达水平下降或功能丧失。SMA的主要突变类型为SMN1基因第7或第7、8外显子纯合缺失突变,在我国SMA人群中约占95%[11]。另一种突变类型为复合杂合突变,即1个SMN1基因缺失伴随另1个SMN1基因内的微小突变,约占5%[12]。2个SMN1基因均发生点突变者极少,国内尚无报道。
SMA的修饰基因SMN2与SMN1基因高度同源,仅能表达少量全长有正常功能的SMN蛋白,故而SMN2基因拷贝数与SMA表型严重程度呈负相关[11,13]:SMN2基因拷贝数在最严重的1型患儿中多为2拷贝,在2型患儿中多为3拷贝,3型患者多为3~4拷贝,4型患者多>4拷贝[14]。国外还有SMN2基因5拷贝,而SMN1基因纯合缺失的无症状个体的报道[15]。需要注意的是,SMN2拷贝数并不能完全预测表型严重程度。
临床疑诊为SMA的患者,即表现为躯干和四肢近端肢体为主的进行性、对称性肌无力和肌萎缩、肌束颤、腱反射减弱或消失、智力正常,可以选择以下辅助检查以明确诊断。(1)基因检测:多重连接探针扩增法(MLPA)、实时荧光定量PCR(qPCR)、PCR限制性酶切分析法(RFLP)和变性高效液相色谱(DHPLC)等检测SMN1基因第7或第7、8外显子纯合缺失突变。MLPA、qPCR和DHPLC可用于SMN1和SMN2基因拷贝数检测,酶切法可以用于SMN1基因外显子7、8的纯合缺失检测;SMN1基因测序用于检测SMN1基因内是否存在微小突变。(2)血清肌酸激酶(CK):患者血清CK水平正常或少数轻中度升高。(3)肌电图:显示广泛神经源性损害。(4)肌肉病理:显示神经源性病理改变。
临床表现典型、高度怀疑SMA的患者,可直接行基因检测。如果疑诊神经肌肉病,诊断指向不明者,可同时行血清CK、肌电图、神经传导速度检查或肌活检病理检查,此类检查不能确诊SMA,但有助于鉴别诊断及引导下一级诊断方向。基因检测推荐采用MLPA、qPCR或DHPLC检测SMN1拷贝数,或PCR-RFLP法快速诊断。SMN1基因第7外显子或第7、8外显子纯合缺失(0拷贝)即可诊断SMA。如果患者为SMN1基因杂合缺失(即1拷贝),临床表型与SMA相符,则进行SMN1基因序列测定,确定是否存在微小突变[16],以明确复合杂合SMA的诊断。如患者有2个SMN1拷贝,且父母为近亲结婚,则进一步进行SMN1基因测序检测微小突变;如果父母为非近亲结婚,则为SMA的可能性极低。对于具有1个或1个以上SMN1拷贝,且通过SMN1基因测序方法未发现微小突变的患者,如EMG或病理检查证实为神经源性损害,考虑可能为其他类型运动神经元病(非5q SMA),可结合高通量基因测序以明确诊断(图2)。婴幼儿神经肌肉病种类繁多,应结合详细病史询问、体格检查和上述检查结果的提示,与先天性肌病、先天性及各类肌营养不良、代谢性肌病、重症肌无力、先天性肌无力综合征、周围神经病、Prader-Willi综合征等疾病相鉴别。
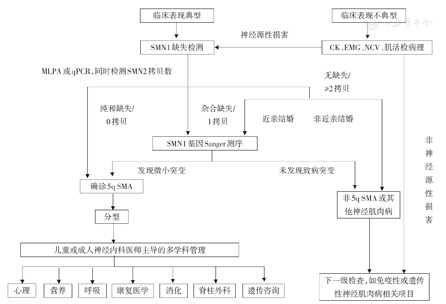

注:MLPA:多重连接探针扩增技术;qPCR:实时荧光定量PCR;CK:肌酸激酶;EMG:肌电图;NCV:神经传导速度
SMA病因治疗近年进展很快。基于SMA遗传学基础,治疗的目标是增加具有完整功能的SMN蛋白的含量,主要策略包括:(1)通过调节基因表达,促进SMN2基因第7号外显子的转录。如反义寡核苷酸药物Nusinersen治疗1型、2型SMA,已完成3期临床试验[17,18],并获得美国食品药品监督管理局和欧洲药品管理局批准,2019年2月25日,该药物获得中国国家药品监督管理局正式批准,用于治疗SMA患者[19]。因药物无法透过血脑屏障,需要鞘内注射给药,由于药物随时间发生降解,需要每4个月给药1次,终身治疗。另有通过高通量筛选的方法发现的小分子化合物如SMN-C3,可调节SMN2基因外显子7的剪接,增加SMN蛋白的表达,正在进行Ⅱ/Ⅲ期临床试验。(2)使用病毒载体的基因替代治疗AVXS-101[20]正在1型和2型SMA患儿临床试验阶段,并取得了一定的疗效。(3)保护SMN蛋白,提高其稳定性的药物也在研究中。(4)曾在一些国家的临床实践中,对2型和3型患者经验性使用沙丁胺醇治疗,其疗效仍需进一步研究。
由于SMA涉及多系统损害和并发症,所以多学科综合管理对SMA患者至关重要[21,22]。患者的多系统评估和综合管理需要由专业的小儿神经内科或成人神经内科医生协调安排,多学科专家参与,对患者病程进行动态评估,并进行前瞻性的护理、处理建议。推荐成立多学科联合门诊,为患者提供一站式服务。
明确诊断后应首先与患者及家属充分沟通,使其了解疾病过程、分型、预后及治疗方案,并进行多器官系统的评估,明确患者所处的病情阶段及其他器官系统损害的程度,制定相应的个体化治疗措施。针对SMA患者肌肉骨骼系统和相关功能障碍的评估,主要包括运动发育里程碑评估、肌力、关节活动度、脊柱曲度和髋关节发育等方面的体格检查和影像学检查,建议使用的运动功能量表包括Hammersmith运动功能量表(Hammersmith functional movement screen,HFMS)、运动功能评估量表(motor function measure,MFM)等[23,24],以及功能活动计时测试,如6分钟步行试验[25]、10米跑/走计时试验、由卧位站起所需时间等。同时还应该评估患者营养状况、呼吸功能、是否存在胸廓变形、脊柱侧弯和髋关节脱位。以上评估应由专业人员每6个月进行1次。
由于当前可治疗SMA的药物尚不能广泛使用,因此,定期物理治疗(PT)、正确使用支具或矫形器、规律运动训练等积极的康复治疗仍是目前干预、延缓疾病进展的主要手段[8,26,27,28]。即使今后应用"可治疗药物",康复训练仍应贯穿治疗全程。
SMA的运动功能障碍评估、康复治疗目标和方法因其功能损害部位、严重程度不同而有所差异。不能独坐者(主要指1型和运动功能倒退后的2型),多数时间处于卧位,康复治疗的目标为尽可能预防或延缓关节挛缩,通过辅助器具促进抗重力体位的维持及提高移动能力。采用被动牵伸、主动-助力牵伸以及矫形器、带支撑的站立架、石膏固定等辅助具维持四肢关节的活动度,建议每周最少进行3~5次牵伸治疗。夜间佩戴踝足矫形器(ankle-foot orthoses,AFO)有助于延缓踝关节挛缩,佩戴时间可从60 min起始,直至整夜佩戴,每周至少佩戴5次。可使用沙袋、成型枕、楔形垫以及定制的床垫来辅助卧位肢体摆放,以预防关节挛缩,避免长时间处于蛙式体位。建议使用个体化定制的轮椅辅助维持坐位,坐位时还需要使用颈部支具辅助头控和胸部支具协助躯干支撑,胸部支具应依据患者呼吸能力进行相应调整,例如在腹部位置开口,以避免限制呼吸运动。针对上肢运动训练,可选用重量较轻、具有反馈效果的物品,如带有开关的玩具、拨浪鼓等,促进上肢主动运动,还可采用手臂支撑设备辅助上肢去重力下的活动。在有合适的头颈部支撑以及全程监护的情况下,可通过水疗进行全身运动训练。为了提高移动和转移能力,建议使用靠背角度可调节的婴儿手推车和电动轮椅。
对于能独坐的患者,康复治疗目标为预防或延缓关节挛缩和脊柱畸形,促进坐位平衡和上肢功能,借助辅助具维持站立体位,尽可能自我驱动轮椅进行移动并参与社会活动。针对四肢关节,每周应至少进行5~7次牵伸治疗,同时可使用膝关节固定器、AFO等来维持下肢关节活动度,并辅助站立。夜间佩戴AFO的时间和频率与不能独坐者相同。每次辅助站立时间不超过60 min,每周最少进行3~5次。为延缓脊柱侧弯的发生,可指导患儿进行腰、腹部躯干肌群力量训练,且可在坐位和辅助站立时佩戴胸腰骶椎支具以辅助维持良好的脊柱姿势。依据患者四肢肌力评估,可进行相应的助力-主动、抗重力或渐进抗阻肌力训练等,鼓励进行融合于日常活动或游戏中的功能性肌力训练,通过游泳、骑车、设备辅助下行走等有氧运动训练,提高活动耐力。运动训练的强度、时间应为低、中等水平,避免疲劳。外出时可使用定制的有躯干支撑和靠背角度可调节的轮椅。对颈部控制能力较差的患儿,可使用颈部支具。
对能独走的患者,康复治疗目标是维持关节活动度、预防脊柱侧弯,同时提高或维持肌力和耐力。加强髋、膝、踝等下肢关节的牵伸,除被动牵伸和主动-助力牵伸外,通过主动姿势性牵伸以维持或提高关节活动度,建议每周进行3~5次牵伸治疗。夜间佩戴AFO以预防踝关节挛缩。能独走患者进行腰、腹部躯干肌群训练延缓脊柱侧弯发生。必要时佩戴胸部支具辅助维持良好的坐姿。进行适当的站立平衡训练,以提高站立和行走过程中的平衡能力,降低跌倒风险。尚可通过游泳、行走、骑自行车、瑜伽、划船等有氧运动训练,逐步提高活动耐力。但需物理治疗师或作业治疗师制定有氧运动方案。训练最佳持续时间为30 min以上。
吞咽障碍是SMA患者常见症状,会导致误吸、支气管痉挛、气道阻塞、窒息、脱水和营养不良等。儿童可通过外界口部刺激,观察口唇、舌运动情况,明确患儿吞咽功能障碍程度,并制定对应的康复方案。常用的训练方法:(1)唇功能训练:让患儿对镜独立紧闭口唇练习,或用压舌板放于双唇间练习,要求双唇夹住压舌板,训练改善口腔闭合功能,减少食物或水从口中漏出。同时做缩唇展唇训练,加强唇力量。(2)颊肌、咀嚼肌功能训练:可用吹气球、吹口哨和口腔按摩来训练颊肌、咀嚼肌。(3)舌肌运动训练:让患者伸舌及侧顶颊部,或以舌尖舔吮口唇周围。
包括呼吸肌肌力训练、维持胸廓顺应性训练、咳嗽和排痰训练等。呼吸肌肌力训练可通过吹气球、大声朗诵和唱儿歌等游戏类活动来进行,也可在评估膈肌活动度后通过卧位时剑突下放置适当重量的沙袋来训练膈肌。训练时应避免出现呼吸困难和疲劳。主动或被动的肋间肌牵伸和肋骨活动可以维持胸廓的顺应性,延缓胸廓畸形和胸部顺应性的下降。开展自主咳嗽训练、主动叠加吸气咳嗽法有助于自主清理气道分泌物,胸部的叩击、摇震和体位引流等可以促进气道分泌物的清除,在感染或围手术期时可采用咳痰机辅助排痰。
60%~90%的1型和2型SMA患者在儿童早期出现脊柱侧凸并持续发展[21,29],伴有不同程度的胸椎后凸,应常规作临床脊柱检查、正侧位脊柱全长X片检查。如脊柱侧弯角度>20˚时应每6个月复查1次,直至骨骼发育成熟后每年复查1次。侧弯角度>20˚时建议使用脊柱矫形器。
是否采用手术干预主要取决于脊柱侧弯程度(主弯Cobb角≥50˚)和进展速度(每年≥10˚)。其他因素如呼吸功能减弱、肋骨变形、脊柱后凸、活动受限、骨盆倾斜和躯干失衡也应考虑在内。肺功能检查应作为术前评估的一部分,以确定手术风险和术后呼吸管理方案。对于骨骼未发育成熟的<8~10岁的患者,可以选择在稳定和改善脊柱畸形的同时还能允许脊柱继续生长的术式[22,30,31]。对于8~12岁的患者,术式选择取决于骨骼成熟度和脊柱发育水平。12岁以上的骨骼发育几近成熟的患者,应当采用脊柱后路融合术,是否延长至骨盆取决于骨盆是否参与构成侧弯[32]。手术时可在中线位置保留一至两个中节段腰椎,以便腰椎穿刺给药使用如Nusinersen反义寡核苷酸等无法透过血脑屏障的药物。术前应进行详尽多学科讨论,尤其是麻醉评估,围手术期使用咳痰机和康复训练尽早介入有助于术后恢复。
髋关节脱位在SMA 1型和2型患者中常见。早期研究认为手术治疗后易出现再脱位,且髋关节病变很少引起疼痛感[30],不建议进行外科干预。对于不能行走的患者建议采用保守石膏固定,但固定时间应<4周,以避免加重肌萎缩和废用性骨质疏松。
由于生存率较低,目前针对1型SMA患者的脊柱管理鲜有经验。可以在不影响患者肺功能的前提下考虑使用保持患者稳定坐姿的硬支具,仰卧位或使用支具后的坐位Cobb角角度可用于后续的跟踪评估。新治疗方法如基因治疗等使1型患者的生存时间延长,改善了患者运动功能[18],脊柱管理方案正在改变。由于骨骼废用、骨质疏松和低维生素D水平,1型和2型SMA患者易发生骨折。应定期进行骨密度检查、血清钙、维生素D3的测定,必要时提供充足的钙和维生素D摄入。
应定期进行生长和营养状况评估,并有专业营养师参与调整饮食结构。在监测体重、身高、头围、上臂围的同时,也应详细询问其进食时间、食量和食物种类,以监测每天总热量、液量和关键营养素的摄入量,尤其是促进骨骼健康的钙及维生素D的摄入量[33,34]。询问并详细记录胃肠道症状,例如是否存在呕吐、腹痛、胃食道返流、腹胀和便秘,是否使用抑酸药和胃肠道调节剂等。患者若出现吞咽困难、喂养困难、进食呛咳或不能自主吞咽时,有条件者推荐做视频荧光镜评估吞咽功能和吸入性肺炎的风险,可临时使用鼻饲管喂食,而长期喂养建议通过胃造口管。患者若出现腹部不适,可做24 h胃食道反流检查,明确胃酸返流的情况。定期监测患者身高、上臂围、体重、头围、体质指数(BMI)、骨密度、血清钙、磷、维生素D3、血红蛋白,根据患者的生长发育和营养摄入状况,调节热量、液体、营养素的摄入量。建议进食富含纤维的食物,促进胃肠蠕动;并保证充足的液体入量。适当服用肠道调节药物以减少便秘。必要时补充锌铁钙和维生素A、维生素D等关键营养素。减少超重患者的热量摄入,但需最大限度地保证关键营养素的摄入,而体重不足的患者应增加摄入热量。在紧急医护期间应尽量缩短禁食时间,保证充分的液体摄入。SMA患儿营养护理复杂,建议由营养师定期评估,制定个体化饮食需求。
SMA患者的肺功能障碍主要为限制性通气功能障碍,表现为用力肺活量(FVC)、第1秒用力呼气容积(FEV1)下降,而FEV1/FVC正常,流速容量环形状正常但面积减小。
可检测出夜间低通气及夜间血氧饱和度下降。出现低通气和持续低氧血症时,建议夜间使用呼吸机辅助通气。如果没有二氧化碳的监测,持续或严重的脉氧饱和度下降可作为参考。
患者可在院外进行脉氧饱和度监测,便捷地监测患者的血氧饱和度情况。有条件者推荐经皮血氧饱和度及呼气末/经皮二氧化碳分压监测,经皮血氧饱和度可以连续无创的监测患者的血氧饱和度情况。
如出现呼吸费力,或合并发热、咳嗽、呼吸频率增快等呼吸道感染表现时,建议行胸片检查。SMA患者由于咳痰无力,除肺部感染外,容易出现分泌物堵塞,引起肺不张。胸片检查有助于及时发现肺不张,并给予更积极的处理。此外,对于严重脊柱侧弯,可能导致肺组织受挤压的2型SMA患者,还应该行脊柱X片检查以了解脊柱侧弯情况。
当存在咳嗽无力时,给予辅助咳嗽,包括物理拍痰、体位引流及咳痰机,可有效减少气道分泌物潴留的风险。推荐所有1型患者在确诊后即准备咳痰机,2型患者在有呼吸道感染、咳痰无力时应给予辅助排痰,有条件的患者可考虑使用咳痰机。
建议选择患儿舒适的面罩,采用双水平气道正压(bi-level positive airway pressure,BiPAP)模式辅助通气,而不建议单水平持续气道正压(continuous positive airway pressure,CPAP)模式,以使呼吸肌得到更充分的休息。
可明显延长SMA患者的生存时间,但气管切开后,患者需要特殊装置才能说话,对患者本身及患者家庭的生活质量均造成巨大影响,因此应谨慎决定是否进行有创呼吸机辅助通气。
各型SMA患者每次随访时应注意呼吸功能[35]。对存在呼吸衰竭特别是无创通气无法改善的患者家庭应进行深度沟通,了解监护人及患者(18岁以上有自主决定能力)对气管插管及有创通气的意愿,以对突发呼吸事件做出相应的反应。1型患者建议每3个月评估1次,了解脉氧饱和度情况,有条件者可行耳血动脉化血气或呼气末/经皮二氧化碳监测,存在呼吸道症状的患者尚应进行多导睡眠监测是否存在低通气及夜间血氧饱和度降低,并积极应用双水平气道正压呼吸机辅助通气。2型患者每6个月评估1次,进行肺功能检查包括咳嗽峰流速测定,怀疑有夜间低通气的患者则进一步行多导睡眠监测,如证实有夜间低通气的患者,可先进行夜间双水平气道正压呼吸机辅助通气;当病情进展至日间也出现二氧化碳潴留,则进行全天无创呼吸机辅助通气[36];当病情进一步发展,最后可能需要气管插管或者气管切开有创呼吸机辅助通气。1型和2型患者还需要关注脊柱侧弯对呼吸造成的影响。3型患者推荐每年行肺功能检查(含咳嗽峰流速)。
在病情急性加重时,可行血气分析、血常规及胸片检查以协助诊治。
平常良好的呼吸道管理及辅助咳痰管理(包括每天物理拍痰和使用咳痰机)对SMA 1型和2型患者尤其重要。另外,推荐患者按计划常规接种疫苗,每年接种流感疫苗,规范接种呼吸道合胞病毒和肺炎球菌疫苗。
在疾病确诊后应对患者家人给予家庭护理方案的指导:如何监测患者生命体征和呼吸功能,如监测脉氧饱和度;如何清除呼吸道分泌物,以及咳痰机和辅助呼吸使用等,有条件的家庭可准备家用无创通气呼吸机,并培训监护人。SMA患者极易出现急性呼吸失代偿,这与呼吸道感染、误吸和分泌物清除障碍有关[37,38],应制定紧急抢救时转运方案。建议1型和2型SMA患者在三级医疗中心住院治疗。建议适时使用双水平无创气道正压呼吸机,加强分泌物清理,及早治疗呼吸道细菌感染。在没有进行正压通气或CO2监测的情况下,不建议经验性高流量吸氧。
建议患者按计划接种各种疫苗,2岁前全程接种13价肺炎球菌疫苗(2.5、3.5、4.5、12.5月龄各1针,共4针),2岁以上患者每5年接种1次23价肺炎球菌疫苗,每年接种流感疫苗,有条件者接种呼吸道合胞病毒疫苗。
此病为慢性进展性疾病,家庭及患者的心理支持很重要。随着新治疗药物的研发和治疗水平的提升,更多病人获得更长的生存期,将超越儿科和成人科的界限。这些患者的随诊治疗应由儿童神经科向成人神经科平稳过渡,使患者能够获得具有延续性的良好诊治。
SMA为常染色体隐性遗传病,在已明确诊断的SMA家庭中,每生育一胎的再发风险为25%,男女患病机会均等。患儿父母多为SMN1单拷贝携带者,但需要注意的是,约有4%的SMA携带者为"2+0"类型(携带2个SMN1拷贝,但是2个SMN1基因位于同一条染色体)[39]。目前的技术并不能直接检测出"2+0"类型携带者,需要依据确诊的SMA患者父母的SMN1基因拷贝数结合家族史调查确定。对于"2+0"类型携带者家庭的再发风险和产前诊断策略与SMN1单拷贝携带者相同。由于SMA的基因突变情况复杂,产前诊断前必须先进行先证者及父母的预分析,明确先证者的SMN1突变类型,再制定在该家系中实行的产前诊断途径和策略。
产前诊断应由具备产前诊断资质的专业人员进行。当先证者是缺失型SMN1突变时,首先推荐采用MLPA或qPCR对胎儿进行SMN1基因拷贝数分析。当先证者是SMN1复合杂合突变类型患者时,则必须对胎儿同时进行SMN1基因拷贝数检测和SMN1基因序列测定。由于SMA以SMN1纯合缺失型为主,母源污染是导致错误产前诊断的重要根源。对胎儿绒毛组织要尽可能去除可能的母源物质,当羊水有血性污染时要进行细胞培养。并且应同时采用直接检测基因突变(缺失检测)与多态性连锁分析两套分析途径,当多态性标记出现2个母亲等位基因时,提示母源污染的可能。
产前诊断的时间窗口可以选择10~12孕周采集绒毛,18~22+6孕周采集羊水,植入前遗传学诊断是指在胚胎着床前即对配子或胚胎进行遗传物质分析,选择没有遗传物质异常的胚胎移植。
总之,此版专家共识是基于现有证据制定的,未来会不断更新,如有更多证据和经验,尤其涉及心理支持和姑息治疗等,将来可考虑制定临床实践指南。
执笔者:葛琳(北京大学第一医院儿科);魏翠洁(北京大学第一医院儿科)
《脊髓性肌萎缩症多学科管理专家共识》制定专家委员会成员(按姓氏汉语拼音排序):曹玲(首都儿科研究所附属儿童医院呼吸科);陈凯珊(香港大学玛丽医院儿童脑神经科);陈万金(福建医科大学附属第一医院神经内科);戴毅(中国医学科学院北京协和医院神经内科);葛琳(北京大学第一医院儿科);洪思琦(重庆医科大学附属儿童医院神经内科);黄真(北京大学第一医院康复医学科);李淳德(北京大学第一医院骨科);李海峰(浙江大学医学院附属儿童医院康复医学科);李西华(复旦大学附属儿科医院神经内科);梁芙蓉(北京大学第一医院儿科);吕俊兰(国家儿童医学中心 首都医科大学附属北京儿童医院神经内科);马祎楠(北京大学第一医院实验中心);彭晓音(首都儿科研究所附属儿童医院神经内科);秦炯(北京大学人民医院儿科);瞿宇晋(首都儿科研究所遗传研究室);阙呈立(北京大学第一医院呼吸和危重症医学科);沈定国(解放军总医院神经内科);宋昉(首都儿科研究所遗传研究室);王朝霞(北京大学第一医院神经内科);魏翠洁(北京大学第一医院儿科);吴丽文(中南大学湘雅医院儿科);吴士文(解放军总医院第三医学中心神经内科);熊晖(北京大学第一医院儿科);许志飞(国家儿童医学中心首都医科大学附属北京儿童医院呼吸科);袁云(北京大学第一医院神经内科);张成(中山大学附属第一医院神经内科)
华益民(苏州大学神经科学研究所),美儿SMA关爱中心,詹思延(北京大学公共卫生学院流行病与卫生统计学系,北京大学第三医院临床流行病学研究中心,北京大学循证医学中心),钟育志(台湾高雄医科大学)
所有作者均声明不存在利益冲突


























