
观察药物涂层球囊(DCB)治疗下肢动脉长段狭窄闭塞性病变的中期疗效。
回顾性分析2017年2月至2018年1月中国医科大学附属第一医院血管外科收治的下肢动脉粥样硬化症患者80例(病变长度>10 cm),接受DCB治疗及支架置入治疗(BMS),比较两组患者术前、术后靶病变的一期通畅率、踝肱指数(ABI)、卢瑟福血管外科分级(Rutherford)、截肢率及临床症状和生活质量的变化。
DCB组60例、BMS组20例,80例患者手术均获得技术成功。DCB组术后6、12个月的通畅率为83.33%、75.00%,BMS组为85.00%、65.00%。两组患者术后ABI与术前相比明显提高,行走距离较术前增加,Rutherford分级以及临床症状较术前改善。手术中DCB组1例出现限流性夹层、1例预扩后狭窄程度仍>50%,后行支架置入补救术。
DCB治疗下肢动脉长段狭窄闭塞性病变可以获得较好的近、中期临床疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
下肢动脉硬化闭塞症(ASO)是导致下肢动脉血管壁变硬、管腔狭窄、继发血栓形成,进而造成下肢供血不足的常见原因,股动脉和腘动脉是ASO最常见的病变部位[1]。临床表现为间歇性跛行、静息痛、缺血坏死等。随着腔内治疗技术的广泛应用,更多的患者接受腔内治疗,经皮腔内血管成形术(PTA)治疗下肢动脉疾病可获得95%的初步技术成功率。然而,在6~12个月之后,再狭窄发生率高达40%~60%[2]。与PTA术相比,金属裸支架置入术可以获得较高的血管通畅率。但是接受股腘动脉支架术后的患者,术后1年再狭窄(ISR)发生率为18%~40%[3]。而在下肢动脉长段病变中,由于病变长度更长、病变相对较复杂,传统腔内治疗术后的远期通畅率、技术成功率均较低。因此如何降低ISR发生率以及远期通畅率已刻不容缓。药物涂层球囊(DCB)技术的出现或许为减少ISR提供了一种新的选择。国外研究表明[4],药物涂层球囊术治疗下肢动脉长段病变1年一期通畅率为83.2%,而在国内下肢动脉长段病变病例中应用较少,关于股腘动脉长段病变治疗的报道更少[5,6]。本研究对接受DCB治疗、支架植入治疗(BMS)的患者中期疗效进行观察并随访,评估DCB、BMS在治疗下肢动脉疾病1年后的治疗效果。
回顾性分析2017年2月至2018年1月中国医科大学附属第一医院血管外科接受DCB治疗(60例)、BMS治疗(20例)的股腘动脉长段病变患者(病变长度>10 cm[7])的临床资料,纳入研究的患者均为初次诊断为下肢动脉硬化闭塞症,未接受过下肢血管手术治疗,并经CTA或血管超声证实病变血管为股腘动脉。本研究患者中原发病变80条肢体,5条肢体为支架内再狭窄病变;原发狭窄性病变24例,闭塞性病变56例。Rutherford分级在4级以上表现为静息痛或足趾坏死25例,Fontaine分级Ⅰ级5例,Ⅱ级43例,Ⅲ级32例。所有患者的一般资料见表1。
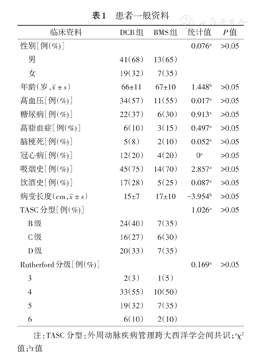
患者一般资料
患者一般资料
| 临床资料 | DCB组 | BMS组 | 统计值 | P值 | |
|---|---|---|---|---|---|
| 性别[例(%)] | 0.076a | >0.05 | |||
| 男 | 41(68) | 13(65) | |||
| 女 | 19(32) | 7(35) | |||
年龄(岁, ±s) ±s) | 66±11 | 67±10 | 1.448b | >0.05 | |
| 高血压[例(%)] | 34(57) | 11(55) | 0.017a | >0.05 | |
| 糖尿病[例(%)] | 22(37) | 6(30) | 0.913a | >0.05 | |
| 高脂血症[例(%)] | 6(10) | 3(15) | 0.497a | >0.05 | |
| 脑梗死[例(%)] | 5(8) | 2(10) | 0.052a | >0.05 | |
| 冠心病[例(%)] | 12(20) | 4(20) | 0a | >0.05 | |
| 吸烟史[例(%)] | 45(75) | 14(70) | 2.857a | >0.05 | |
| 饮酒史[例(%)] | 17(28) | 5(25) | 0.087a | >0.05 | |
病变长度(cm, ±s) ±s) | 15±7 | 17±10 | -3.954b | >0.05 | |
| TASC分型[例(%)] | 1.026a | >0.05 | |||
| B级 | 24(40) | 7(35) | |||
| C级 | 16(27) | 6(30) | |||
| D级 | 20(33) | 7(35) | |||
| Rutherford分级[例(%)] | 0.169a | >0.05 | |||
| 3 | 2(3) | 1(5) | |||
| 4 | 33(55) | 10(50) | |||
| 5 | 19(32) | 7(35) | |||
| 6 | 6(10) | 2(10) | |||
注:TASC分型:外周动脉疾病管理跨大西洋学会间共识;aχ2值;bt值
(1)年龄(周岁)>18岁;(2)第一次接受介入治疗(即第一次诊断为ASO),病变部位为股浅动脉到腘动脉之间发生>70%的重度狭窄或闭塞性病变(原发或者继发);(3)患肢踝肱指数(ABI)≤0.5(Rutherford分级在2~5级之间);(4)病变累计总长度>10 cm。
(1)发生了急性血栓并且需要溶栓或取栓治疗,或42 d内做过溶栓治疗或下肢动脉手术;(2)需要干预不止1条血管;(3)对本次治疗中可能用到的药物如阿司匹林、氯吡格雷、肝素、紫杉醇等过敏;(4)病变部位导丝导管无法通过,无法行球囊扩张术;(5)考虑支架内再狭窄;(6)有出血倾向、凝血功能欠佳;(7)妊娠和哺乳期;(8)存在恶性肿瘤、严重肝肾功能不全、严重心力衰竭、心脏病等疾病。
所有患者术前均常规生化检验,门诊检查ABI、血管彩超及CT血管造影(CTA)证实为下肢动脉狭窄或粥样硬化病变。无严重的心、肺、肝、肾功能不全以及出血和脑梗死风险,并同意接受药物球囊扩张术。数字减影血管造影(DSA)下选择合适的穿刺入路(对侧或同侧股动脉),若股动脉入路不佳,则选左侧肱动脉穿刺。穿刺点常规消毒铺巾,以2%的利多卡因5 ml于腹股沟区拟穿刺点局部麻醉,结合术前CTA图像明确诊断并近一步对手术方案进行评估与完善。以Sedinger技术穿刺动脉成功后,引入Simon、Cobra导管及泥鳅导丝,翻山进入对侧闭塞狭窄的病变动脉。用高压注射器进行造影,显示靶血管病变情况。置换翻山鞘,用V18/14导丝配合CX1开通导丝成功开通病变段后,根据术中造影显示的病变血管的长度、直径和位置选择合适规格的普通球囊逐级预扩狭窄或闭塞动脉2~3 min。若预扩后造影显示狭窄程度≤50%或存在非限流性夹层(不影响血流动力学),则选择合适相同规格(普通球囊与药涂球囊直径比为1∶1,长度不能超过DCB长度)的药涂球囊(北京先瑞达医疗科技公司)扩张3 min。若普通球囊预扩后显示狭窄仍>50%或存在限流性夹层(影响血流动力学),改用金属裸支架补救术。如再次造影显示造影剂通过顺畅,术毕拔管,穿刺点按压10 min,压迫器压迫止血,患者安返病房。图1为DCB治疗长段下肢动脉病变手术影像资料。
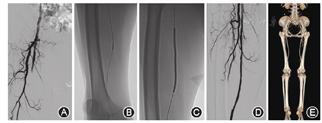

注:A图:术中DSA提示右侧股浅动脉长段闭塞;B图:导管配导丝开通病变;C图:术中用5 mm×200 mm药涂球囊扩张;D图:术后造影提示血流通畅;E图:术后12个月复查CTA提示右侧股浅动脉通畅;DSA:数字减影血管造影;CTA:CT血管造影
术后绝对戒烟、多饮水、适度锻炼。注意控制血糖、血脂、血压以及下肢保暖。出院后短期抗凝治疗,并口服双联抗血小板药物治疗至少6个月,随后长期口服阿司匹林。
术后第6、12个月进行随访,门诊复查下肢动脉彩色多普勒超声、ABI、CTA。评价患者术前、术后的皮温、肤色等以及患者感知的行走速度和距离的改变(患者口述),手术前后ABI的变化,术后的血管通畅率,通过CTA和血管超声衍生收缩期峰值速度比<2.4来判断靶病变是否通畅[7]。评价患者是否需要再次手术干预。随访终点为发生与手术相关或其他原因导致的死亡、截肢、靶病变血管血栓形成等。随访期间无需要手术再次干预的患者,也未发生与手术或器械相关的出血、死亡、截肢等临床事件。
采用SPSS 20.0统计学软件进行数据分析。正态分布计量资料均采用 ±s表示。计数资料以百分率表示。正态分布资料比较采用配对样本t检验或独立样本t检验,非正态分布资料比较采用秩和检验,Rutherford分级比较用秩和检验,应用Kaplan- Meier生存分析表示一期通畅率,用χ2检验比较两组通畅率,应用Cox回归分析评估影响靶血管一期通畅率的危险因素,P<0.05为差异有统计学意义。
±s表示。计数资料以百分率表示。正态分布资料比较采用配对样本t检验或独立样本t检验,非正态分布资料比较采用秩和检验,Rutherford分级比较用秩和检验,应用Kaplan- Meier生存分析表示一期通畅率,用χ2检验比较两组通畅率,应用Cox回归分析评估影响靶血管一期通畅率的危险因素,P<0.05为差异有统计学意义。
DCB组和BMS组患者术后即刻以及术后6、12个月与术前相比,ABI明显提高(均P<0.05),术后12个月DCB组患者ABI增长值高于BMS组,差异有统计学意义(P<0.05)。两组患者术后行走距离较术前均有所改善(均P<0.05),两组之间术后6、12个月行走距离差异无统计学意义(P>0.05),详见表2。
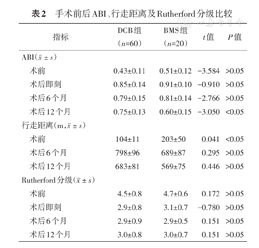
手术前后ABI、行走距离及Rutherford分级比较
手术前后ABI、行走距离及Rutherford分级比较
| 指标 | DCB组(n=60) | BMS组(n=20) | t值 | P值 | |
|---|---|---|---|---|---|
ABI( ±s) ±s) | |||||
| 术前 | 0.43±0.11 | 0.51±0.12 | -3.584 | >0.05 | |
| 术后即刻 | 0.85±0.14 | 0.91±0.10 | -0.910 | >0.05 | |
| 术后6个月 | 0.79±0.15 | 0.81±0.14 | -2.766 | >0.05 | |
| 术后12个月 | 0.75±0.13 | 0.60±0.15 | -3.050 | <0.05 | |
行走距离(m, ±s) ±s) | |||||
| 术前 | 104±11 | 203±50 | 0.041 | <0.05 | |
| 术后6个月 | 798±96 | 689±87 | 0.295 | >0.05 | |
| 术后12个月 | 683±81 | 569±75 | 0.446 | >0.05 | |
Rutherford分级( ±s) ±s) | |||||
| 术前 | 4.5±0.8 | 4.7±0.6 | 0.172 | >0.05 | |
| 术后即刻 | 2.9±0.8 | 3.1±0.7 | -0.780 | >0.05 | |
| 术后6个月 | 2.9±0.9 | 2.9±0.5 | 0.151 | >0.05 | |
| 术后12个月 | 3.0±0.8 | 3.0±0.7 | 0.151 | >0.05 | |
通过Cox回归分析对可能影响靶病变血管通畅情况的因素进行分析,纳入因素包括年龄、性别、高血压、糖尿病、高血脂、手术方式(DCB或BMS)、吸烟、脑梗死、冠状动脉粥样硬化性心脏病、病变长度、饮酒。发现糖尿病是影响血管通畅率的危险因素(OR=3.373,P=0.005),DCB是影响血管通畅率的保护性因素(OR=0.391,P=0.045),见表3,表4及图2。DCB组术后6、12个月的通畅率为83.33%、75.00%,差异有统计学意义(P<0.01);BMS组术后6、12个月的通畅率为85.00%、65.00%,差异有统计学意义(P<0.05)。DCB和BMS组术后6、12个月通畅率比较差异均无统计学意义(均P>0.05)。
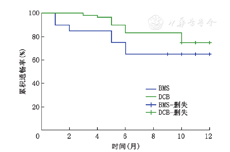

注:BMS:支架植入;DCB:药物涂层球囊
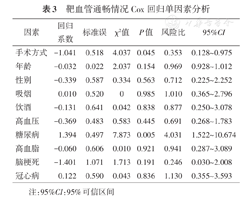
靶血管通畅情况Cox回归单因素分析
靶血管通畅情况Cox回归单因素分析
| 因素 | 回归系数 | 标准误 | χ2值 | P值 | 风险比 | 95%CI |
|---|---|---|---|---|---|---|
| 手术方式 | -1.041 | 0.518 | 4.037 | 0.045 | 0.353 | 0.128~0.975 |
| 年龄 | -0.032 | 0.022 | 2.037 | 0.154 | 0.969 | 0.928~1.012 |
| 性别 | -0.339 | 0.587 | 0.334 | 0.563 | 0.712 | 0.225~2.252 |
| 吸烟 | 0.010 | 0.520 | 0 | 0.985 | 1.010 | 0.365~2.796 |
| 饮酒 | -0.131 | 0.641 | 0.042 | 0.838 | 0.877 | 0.250~3.078 |
| 高血压 | -0.369 | 0.483 | 0.583 | 0.445 | 0.691 | 0.268~1.783 |
| 糖尿病 | 1.394 | 0.497 | 7.873 | 0.005 | 4.031 | 1.522~10.674 |
| 高血脂 | -0.060 | 0.606 | 0.010 | 0.921 | 0.941 | 0.287~3.089 |
| 脑梗死 | -1.401 | 1.071 | 1.713 | 0.191 | 0.246 | 0.030~2.008 |
| 冠心病 | 0.122 | 0.590 | 0.043 | 0.836 | 1.130 | 0.355~3.593 |
注:95%CI:95%可信区间
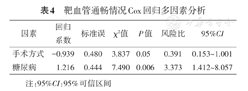
靶血管通畅情况Cox回归多因素分析
靶血管通畅情况Cox回归多因素分析
| 因素 | 回归系数 | 标准误 | χ2值 | P值 | 风险比 | 95%CI |
|---|---|---|---|---|---|---|
| 手术方式 | -0.939 | 0.480 | 3.837 | 0.05 | 0.391 | 0.153~1.001 |
| 糖尿病 | 1.216 | 0.444 | 7.490 | 0.006 | 3.373 | 1.412~8.057 |
注:95%CI:95%可信区间
目前下肢动脉长段病变仍然是外周血管疾病腔内治疗的主要挑战之一,外科自体静脉旁路移植术仍然被认为是股腘动脉TASC分型C、D型患者治疗的金标准[8]。随着医学技术的发展,血管腔内治疗被认为是股腘动脉疾病的一种安全有效的治疗方法,被现行指南推荐为一线方法,特别是在TASC分型C、D型案例中[9,10]。标准方法包括普通球囊血管成形术PTA、金属支架植入术和DCB等。在血管成形术的基础上,增加技术复杂性,支架使用更加频繁,尤其是复杂病变(溃疡、高度钙化斑块)的治疗[11]。由于金属裸支架在胯关节和下肢较长病变的动脉中易发生断裂、损伤血管、遮挡侧支循环和长期的异物刺激限制了其发展[7]。目前国内外关于下肢动脉长段病变治疗的文献报道较少,Micari等[4,12]的研究证明,DCB与支架植入术治疗长段的下肢动脉病变(平均病变长度>15 cm),术后1、2年的通畅率为83.2%比70%、70.4%比50%。Bausback等[13]的研究表明,DCB与普通球囊成形术比较,术后6个月通畅率为87%比60%,Steiner等[14]的研究表明,DCB与普通球囊成形术比较,术后1年的通畅率为86.4%比78.5%。国内关于下肢动脉长段病变的两项研究显示,药涂术后6个月一期通畅率分别为89.5%[6](病变长度>15 cm)、81.8%(病变长度>20 cm)[5]。国内首个前瞻性、多中心随机对照临床试验数据显示[15],DCB术后1年的通畅率为76.1%,对照组为33.7%。本研究DCB组术后6、12个月的通畅率为83.33%、75.00%;BMS组术后6、12个月的通畅率为85.00%、65.00%,以上国内外的研究数据与本研究结果类似。表明与支架植入和普通球囊扩张术相比,DCB可以获得较高的1年一期通畅率。最新一代的药物涂层球囊的原理是采用独有的涂层技术将紫杉醇药物和基质(硬脂酸镁)混合后一起涂到球囊表面,DCB在展开和部分充气的同时进行涂层,然后将它放气并折叠成最终装置。基质层可增强药物涂层稳定性、减少输送中的紫杉醇丢失、贴壁时促进药物的快速释放等,该涂覆方法允许大部分药物在递送至靶病变期间由球囊折叠保护,并提供向动脉的均匀周向递送。与传统的手术方式相比,药涂球囊具有安全有效、药效持久、应用广泛、临床收益高等优点。长久抑制病变处血管内膜增生,减少再狭窄的发生,同时弥补了支架植入术不适用于胯关节、长段、多阶段的动脉病变方面的不足。DCB在短病变的效果已毋庸置疑,对于长病变、支架内再狭窄等复杂病变,DCB也表现出了不错的效果[16,17]。本研究为回顾性小样本研究,具有一定的局限性,局限性包括其非随机,侧重于单一治疗策略,且原发病变多为非复杂病变,不能代表全部临床患者群体。总之,与金属裸支架植入和普通球囊扩张术相比,紫杉醇涂覆的药涂球囊在治疗股腘动脉长段狭窄闭塞性疾病中能够获得较高的12个月血管一期通畅率。在安全性方面,药物涂层球囊也不劣于标准血管成形术。
所有作者均声明不存在利益冲突



























