
研究异柠檬酸脱氢酶(IDH)、端粒酶逆转录酶基因启动子(TERT)及1p/19q的突变情况对间变性少突胶质瘤患者临床预后的影响。
研究样本入组选取了2011至2016年在郑州大学第一附属医院确诊的间变性少突胶质瘤患者,收集临床资料,随访得到生存资料,共计纳入66例。χ2检验用来分析IDH、TERT及1p/19q和各个临床因素之间的关系,采用Kaplan-Meier法进行生存分析,不同组间生存率差异的比较采用Log rank检验。Cox比例风险模型进行独立预后影响因素的多因素分析。
IDH-wt和IDH-mt两组患者的中位生存期分别为16.10及42.00个月,差异有统计学意义(P=0.001);1p/19q非联合缺失和1p/19q联合缺失两组的中位生存期分别为22.40及42.00个月,差异有统计学意义(P=0.012);而TERT-wt和TERT-mt两组的中位生存期分别为20.00及36.00个月,差异无统计学意义(P=0.176)。不同分子病理学分型分组显示,IDH-mt和1p/19q联合缺失组比IDH-wt和1p/19q非联合缺失组(P=0.001)(中位生存期42.00个月比16.05个月)(P=0.001)、IDH-mt和1p/19q非联合缺失组比IDH-wt和1p/19q非联合缺失组(P=0.041)(中位生存期36.50个月比16.05个月)(P=0.041)组间差异有统计学意义。多因素分析显示,分子病理学分型是影响间变性少突胶质瘤患者预后的独立影响因素(P=0.008)。
具有IDH和(或)1p/19q联合缺失的间变性少突胶质瘤患者有着较好的临床预后,IDH和1p/19q突变情况可作为潜在的预测间变性少突胶质瘤患者预后的标志物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
世界卫生组织(WHO)Ⅲ级少突胶质细胞瘤即间变性少突胶质细胞瘤(AO)是对化疗独特敏感的罕见的原发性脑恶性肿瘤,具有独特的组织病理学,预后差异较大,其确诊需要异柠檬酸脱氢酶(IDH)突变和1p/19q共缺失型二者同时存在,部分具有典型组织学特点但缺乏完整分子病理学诊断的AO则被归类为间变性少突胶质细胞瘤(NOS)[1]。目前,规范治疗方法是初期进行最大程度神经外科手术切除,术后尽快进行规范的放疗和化疗[2]。研究发现,不同的AO患者的预后生存时间差异很大,具有1p/19q联合缺失的AO患者的临床预后显著好于非1p/19q缺失患者,并且具有IDH突变的患者的临床预后也优于无IDH突变的患者[3]。端粒酶逆转录酶基因启动子(TERT)突变多存在于AO和胶质母细胞瘤中,其对患者的临床预后具有重要价值,但在AO中研究较少[4],本研究中对IDH、TERT及1p/19q的突变情况和AO的临床预后的关系进行了回顾性的研究,以期发现三者与AO的预后关系,以指导临床诊疗。
选取2011至2016年在郑州大学第一附属医院确诊的AO患者。入组标准:所有AO患者均为经过手术切除并经病理科确诊的初发胶质瘤患者;术前一般临床资料完整,术前未接受任何放化疗及手术治疗。经过筛选后最终获得73例符合入组条件的AO患者。通过嘉和病历系统查询患者所有的相关资料,包括性别、年龄、术前KPS评分、切除程度、放疗、化疗及病理学报告等信息。
根据嘉和病历系统采集的患者信息(电话号码)对入组患者进行电话随访,末次随访时间为2018年9月,最长随访日期66个月。生存时间为手术日期至死亡日期或随访结束日期。经过系统随访获得66例,失访7例,失访率9.59%。
所有肿瘤石蜡标本均从郑州大学第一附属医院病理科收集,选取肿瘤石蜡组织进行常规脱蜡、烘干;(1)IDH和TERT检测:进行引物设计及PCR扩增,随后对PCR产物进行纯化,对PCR样品进行1.5%的琼脂糖凝胶电泳,检测其纯度和浓度;随后样品采用基因分析仪检测。PCR扩增循环条件:95 ℃ 5 min;95 ℃变性20 s;退火温度57 ℃,30 s;延伸温度72 ℃ 1 min,共40次循环;72 ℃,5 min,10 ℃ 10 min;测序反应体系:PCR产物5 μl,saq酶2 μl,测序循环条件:37 ℃ 40 min,80 ℃ 15 min。PCR循环条件:96 ℃ 1 min;96 ℃变性10 s;退火温度50 ℃ 5 s,60 ℃ 2 min;共30个循环。(2)1p/19q检测:组织常规脱蜡、烘干、复水、柠檬酸盐修复液高压处理、室温SSC溶液漂洗、蛋白酶K中孵育、SSC溶液漂洗后进行变性杂交,变性温度83 ℃ 5 min,杂交温度42 ℃ 16 h,然后进行玻片洗涤、暗处自然干燥,随后将15 μl复染液加于杂交区域,暗处放置15 min后进行荧光显微镜观察。上述数据应用Gene Mapper 4.0软件进行结果分析。
本研究所有生存分析采用SPSS 25.0进行。采用Kaplan-Meier法进行生存分析,不同组件生存率差异的比较采用Log rank检验。Cox比例风险模型进行独立的预后影响因素的多因素分析。以P<0.05为差异有统计学意义。
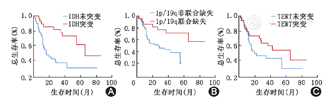
根据IDH、TERT和1p/19q的检测结果,IDH-野生型(IDH-wt)和IDH突变型(IDH-mt)(R132H)患者分别为39例(59.09%)和27例(40.91%),TERT-野生型(TERT-wt)和TERT突变型(TERT-mt)(C228T)分别为33例(50.00%)和33例(50.00%),1p/19q非联合缺失和1p/19q联合缺失患者分别为44例(66.67%)和21例(31.82%)。进行生存分析和描绘生存曲线。结果显示:IDH-wt和IDH-mt两组的中位生存期分别为16.10及42.00个月,差异有统计学意义(P=0.001)(图1A),1p/19q非联合缺失和1p/19q联合缺失两组的中位生存期分别为22.40和42.00个月,差异有统计学意义(P=0.012)(图1B),而TERT-wt和TERT-mt两组中位生存期分别为20.00及36.00个月,差异无统计学意义(P=0.176)(图1C)。

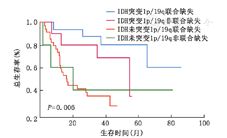
根据IDH和1p/19q不同的突变情况将二者不同组合分为四组,即IDH-mt和1p/19q联合缺失组(16例)、IDH-mt和1p/19q非联合缺失组(10例)、IDH-wt和1p/19q联合缺失组(5例)以及IDH-wt和1p/19q非联合缺失组(34例),进行生存分析显示,上述4组的中位生存期分别为42.00、36.50、20.00及16.05个月,P=0.006,其中IDH-mt和1p/19q联合缺失组VSIDH-wt和1p/19q非联合缺失组(P=0.001)、IDH-mt和1p/19q非联合缺失组VSIDH-wt和1p/19q非联合缺失组(P=0.041),组间差异有统计学意义,余组间差异无统计学意义(图2)。将其纳入多因素分析显示,分子病理学分型是影响AO患者预后的独立影响因素(P=0.008)。

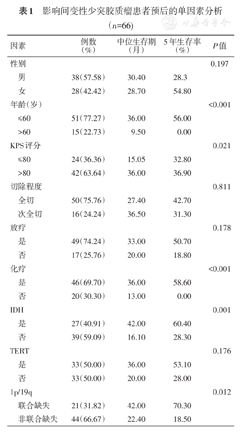
单因素分析结果显示:年龄(≤60或>60岁)(P<0.001)、KPS评分(P=0.021)、化疗(是或否)(P<0.001)是影响AO患者预后的影响因素。而性别(P=0.197)、切除程度(全切或次全切)(P=0.811)和放射治疗(是或否)(P=0.178)不是AO患者生存预后的影响因素(表1)。将上述单因素分析有意义的因素进行多因素分析显示:年龄(≤60或>60岁)(P=0.002)和KPS评分(P=0.026)是影响AO患者预后的独立因素。
影响间变性少突胶质瘤患者预后的单因素分析(n=66)
影响间变性少突胶质瘤患者预后的单因素分析(n=66)
| 因素 | 例数(%) | 中位生存期(月) | 5年生存率(%) | P值 | |
|---|---|---|---|---|---|
| 性别 | 0.197 | ||||
| 男 | 38(57.58) | 30.40 | 28.3 | ||
| 女 | 28(42.42) | 28.70 | 54.80 | ||
| 年龄(岁) | <0.001 | ||||
| ≤60 | 51(77.27) | 36.00 | 56.00 | ||
| >60 | 15(22.73) | 9.50 | 0.00 | ||
| KPS评分 | 0.021 | ||||
| ≤80 | 24(36.36) | 15.05 | 32.80 | ||
| >80 | 42(63.64) | 36.00 | 36.90 | ||
| 切除程度 | 0.811 | ||||
| 全切 | 50(75.76) | 27.40 | 42.70 | ||
| 次全切 | 16(24.24) | 36.50 | 31.30 | ||
| 放疗 | 0.178 | ||||
| 是 | 49(74.24) | 33.00 | 50.70 | ||
| 否 | 17(25.76) | 20.00 | 18.80 | ||
| 化疗 | <0.001 | ||||
| 是 | 46(69.70) | 36.00 | 58.60 | ||
| 否 | 20(30.30) | 13.00 | 0.00 | ||
| IDH | 0.001 | ||||
| 是 | 27(40.91) | 42.00 | 60.40 | ||
| 否 | 39(59.09) | 16.10 | 28.30 | ||
| TERT | 0.176 | ||||
| 是 | 33(50.00) | 36.00 | 53.10 | ||
| 否 | 33(50.00) | 20.00 | 28.00 | ||
| 1p/19q | 0.012 | ||||
| 联合缺失 | 21(31.82) | 42.00 | 70.30 | ||
| 非联合缺失 | 44(66.67) | 22.40 | 18.50 | ||
Eckel-Passow等[5]于2015年对IDH、TERT及1p/19q突变和胶质瘤进行了重要阐述和系统分类,揭示了基于三种肿瘤标志物和五种主要分组对胶质瘤分子生物学特征的显著影响[5],2016年修订的世界卫生组织中枢神经系统肿瘤分类中也阐述了IDH和1p/19q突变对浸润性胶质瘤诊断和治疗中的重要作用[1]。目前,国内关于分子病理学和AO的研究较少,多集中于单一的1p/19q和IDH对病理学诊断和预后的意义的研究[6,7],尚未检索到联合IDH、1p/9q和TERT单独对AO患者预后影响的研究报道。
IDH是三羧酸循环中细胞呼吸的必需酶,其活性位点的精氨酸残基的突变和肿瘤的发生、发展和增殖关系密切[8]。研究发现,IDH突变是神经胶质瘤发生过程中的常见早期突变事件,IDH有3种亚型:IDH1、IDH2和IDH3,其中IDH突变多发生于IDH1位点,其突变存在于约70%左右的低级别胶质瘤中,并且可能和1p/19q缺失及TP53突变有关[9]。在胶质母细胞瘤中,IDH突变的患者的中位生存时间(4年)明显长于野生型IDH患者(1.2年)[10],在间变性星形细胞瘤中,具有IDH突变的患者的预后显著优于具有野生型IDH的患者,同样在IDH突变高发生率的少突胶质瘤中,IDH突变型的患者具有更有好的预后[11],本结果与上述结论较一致,IDH突变的有利预后可能与IDH-mt的高的化疗敏感度有关,IDH突变可通过增加2-羟基戊二酸的水平进而抑制组蛋白的去甲基化[12]。
1号染色体的短臂(1p)和19号染色体的长臂(19q)的联合缺失是诊断少突胶质瘤的重要标志物,生存分析显示,具有1p/19q联合缺失的少突神经胶质瘤患者的中位生存期为11.9年,而非联合缺失的患者的中位生存期为8.1年,二者有明显的差异[13]。一项长达20年的回顾性的研究指出,无论肿瘤分级如何,进行了前期化疗的1p/19q联合缺失的少突神经胶质瘤患者的5、10及15年的总生存率分别为96.8%,88.7%和80.0%,显示出了具有1p/19q联合缺失的少突神经胶质瘤患者的生存优势[14]。端粒酶逆转录酶基因启动子(TERT)的突变多存在于胶质母细胞瘤和少突神经胶质瘤中,研究显示其对胶质瘤的有重要的预后价值,但是在不同类型的胶质瘤中其预后价值是不同的,当TERT与IDH1和1p/19q改变同时发生时,其具有较好的预后,但在本研究中可能受限于样本例数原因,TERT在AO中对临床预后不具有预测意义。
具有不同的IDH和1p/19q的状态的AO患者有着对放化疗不同的敏感性进而有着迥然不同的临床预后,在EORTC26951研究中,显示出了丙卡巴肼、洛莫司汀和长春新碱(PCV)的化疗方案对AO的有效性,进行了放疗和PCV化疗患者的总生存期明显延长,并且具有1p/19q联合缺失患者的PCV效果更佳,同时IDH突变状态对预后具有预测意义[3]。在前瞻性RTOG9402的研究中,具有1p/19q联合缺失状态的AO患者进行PCV化疗加放疗能获得更好的临床预后[2]。少突神经胶质瘤中具有1p/19q联合缺失患者进行PCV加放疗治疗的良好预后和IDH的突变有关。众多的相关研究证实了1p/19q和IDH状态对AO的治疗及预后的重要意义。
所有作者均声明不存在利益冲突



























