
评价直肠腔内超声(ERUS)对直肠癌新辅助治疗后T再分期诊断的准确性以及影响准确性的因素。
回顾性分析2014年7月至2018年2月福建省肿瘤医院86例行新辅助放化疗后的直肠癌患者,术前通过ERUS检查并与术后病理T分期进行对照分析。
ERUS的T再分期总体准确率为67.4%(58/86),中位和高位直肠癌的准确率较高分别为76.1%(35/46),100%(4/4)。单因素分析显示,肿瘤发生部位是影响ERUS准确性的独立因素(P值为0.033)。
ERUS可作为直肠癌新辅助治疗后T再分期的有效手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
直肠癌是常见恶性肿瘤,术前新辅助放化疗已被列入直肠癌临床实践指南。但目前尚无新辅助治疗效果的影像评价标准[1]。本研究旨在通过直肠腔内超声(ERUS)对直肠癌新辅助放化疗后T再分期与术后病理T分期结果相互对照,探讨ERUS在直肠癌新辅助治疗后T再分期的价值及影响因素。
回顾性分析福建省肿瘤医院2014年7月至2018年2月收治的86例直肠癌患者,其中男53例,女33例,年龄(55.5±9.4)岁。86例患者中17例为单纯放疗,69例为同步放化疗。入组标准:(1)经肠镜活检病理证实为直肠癌;(2)肿瘤下缘距肛缘<15 cm;(3)治疗前影像学检查T分期为T3期及以上;(4)完成新辅助放化疗;(5)均接受全直肠系膜切除术,并于术前1周内行ERUS检查。
采用ESMO-2017指南的定义,根据肿瘤下缘距肛缘的距离分为低,中,高位直肠癌(<5 cm为低位,5~10 cm为中位,10~15 cm为高位)[2]。本组病例低位直肠癌36例,中位46例,高位4例。
采用Philips Elite彩色超声诊断仪(荷兰,Philips公司),腔内端头为C9-5端扫探头,频率5~9 MHz。直肠灌注造影剂选用浙江省湖洲东亚医药用品有限公司生产的"天下牌"胃肠超声助影剂(浙食药监械生产许20100095号)。
肠道准备后,患者取左侧卧位,先采用灌肠冲洗器灌注胃肠超声助影剂1 000 ml,然后进行超声探测。探头缓慢置入直肠内,顶端置于肿瘤下端,取纵、横切面扫查。当探及肿瘤后,观察并记录肿瘤的位置、大小、形态、内部回声、血流情况、肿瘤浸润肠壁深度及范围、有无浸润周围组织及脏器,记录测量数据并保存图像。由2名具有5年以上超声诊断经验的医师分别对图像进行分析并作出超声T分期。
直肠癌浸润深度的超声分期uT分期(u代表超声)采用Beynon等[3]和本单位之前研究[4]分期标准:uT0期:肠壁5层结构显像清晰,黏膜层和肌层较周围肠管增厚。uTis期:肿瘤局限于黏膜层,第1层低回声模糊,第2层高回声带显像清晰、完整。uT1期:肿瘤局限于黏膜、黏膜下层,第2层高回声带完整。uT2期:肿瘤浸润固有肌层,第2层高回声带破坏,第2层低回声带增厚,第3层高回声带完整。uT3期:肿瘤累及全层,第3层高回声带破坏,可见低回声不规则锯齿状突起,并累及肠周组织。uT4期:肿瘤侵蚀邻近器官或组织,病灶周围脏器的正常边缘高回声带消失,与肿瘤低回声带无分界。
以术后病理结果为金标准,将超声uT分期结果与病理ypT(yp代表放化疗后病理)分期结果对照,采用SPSS 20.0分析软件,uT分期与术后病理ypT分期采用kappa检验及配对χ2检验。影响因素采用单因素分析。以P<0.05为差异有统计学意义。
1.超声诊断uT分期与病理诊断ypT分期结果对照(表1)。超声诊断T再分期总体准确率为67.4%(58/86,kappa=0.483),术后病理为T3期的超声诊断符合率最高为87.5%(42/48)。
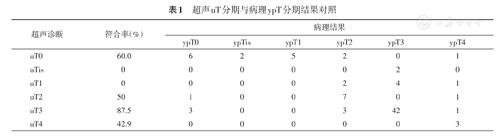
超声uT分期与病理ypT分期结果对照
超声uT分期与病理ypT分期结果对照
| 超声诊断 | 符合率(%) | 病理结果 | |||||
|---|---|---|---|---|---|---|---|
| ypT0 | ypTis | ypT1 | ypT2 | ypT3 | ypT4 | ||
| uT0 | 60.0 | 6 | 2 | 5 | 2 | 0 | 1 |
| uTis | 0 | 0 | 0 | 0 | 0 | 2 | 0 |
| uT1 | 0 | 0 | 0 | 0 | 2 | 4 | 1 |
| uT2 | 50 | 1 | 0 | 0 | 7 | 0 | 1 |
| uT3 | 87.5 | 3 | 0 | 0 | 3 | 42 | 1 |
| uT4 | 42.9 | 0 | 0 | 0 | 0 | 0 | 3 |
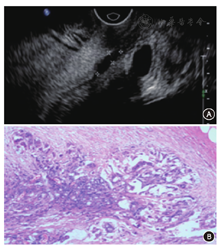
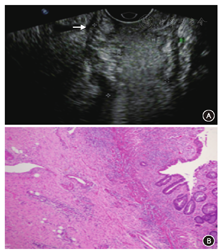
2.不同位置直肠癌的超声诊断结果与病理结果对照(表2)。低、中位直肠癌超声诊断的kappa值分别为0.27,0.63,高位直肠癌因例数太少无法统计kappa值,其准确率为100%。直肠腔内超声诊断对于中高位直肠癌的一致性较好,而低位的一致性差,而且出现T分期低估的比例较高达33.3%。超声诊断比照病理结果,出现低估和高估的图像(图1,图2)。


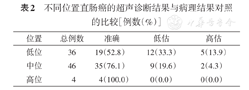
不同位置直肠癌的超声诊断结果与病理结果对照的比较[例数(%)]
不同位置直肠癌的超声诊断结果与病理结果对照的比较[例数(%)]
| 位置 | 总例数 | 准确 | 低估 | 高估 |
|---|---|---|---|---|
| 低位 | 36 | 19(52.8) | 12(33.3) | 5(13.9) |
| 中位 | 46 | 35(76.1) | 9(19.6) | 2(4.3) |
| 高位 | 4 | 4(100.0) | 0(0.0) | 0(0.0) |
3.影响因素分析:单因素分析结果显示,肿瘤发生的不同位置是影响超声诊断准确性的独立因素(P值分别为0.033);而年龄及性别对一致性的影响差异无统计学意义(P值分别为0.968,0.552)。
近年来,进展期直肠癌的在新辅助治疗后其治疗策略发生根本性改变,因此,对病灶准确地再分期显得尤为重要[5,6]。目前,直肠腔内超声(ERUS)、计算机断层扫描(CT)和磁共振成像(MRI)是临床评估的常用方法,MRI对病灶的T再分期准确率为44%~64.7%[7,8],ERUS对病灶的T再分期的准确率为32%~75%[9,10]。Martellucci等[11]研究认为ERUS在肿瘤浸润深度的判断方面,优于MRI检查及CT。ERUS能够清晰显示直肠壁的5层结构,同时较MRI有价格和检查时长优势,较CT可避免辐射影响。本研究ERUS的总体准确率为67.4%,和既往文献相比属于较好水平。本研究在检查时增加了胃肠助影剂的灌注,使得肠壁分层显像更为清晰[4],是提高准确率的重要手段。
本研究中出现不同程度分期过高或过低,其中以低估较多(21例,24.4%),与文献不同[12]。回顾图像发现21例低估患者中,均为小病灶,范围在1~2 cm,可能由于病灶较小,加上新辅助治疗后,局部组织间质纤维化、组织变性,直肠壁结构紊乱,影响超声对病灶的结构分辨力[13](图1)。高估7例(8.1%,7/86),回顾图像发现,可能与病灶部位的病理改变有关,病理变化多提示为重度放疗反应,在镜下呈黏液湖、大量炎性细胞浸润(图2),超声图像中肠壁黏膜层增厚、肌层与直肠系膜分界不清,误以为是肿瘤浸润。
本研究单因素分析显示,肿瘤的发生部位是EURS再分期诊断准确性的独立因素(P=0.033)。中位直肠癌的准确率为76.1%(35/46),高位的准确率为100%(4/4),而低位的准确率仅为52.8%,而且低估率高达33.3%。这提示临床上对于低位直肠癌新辅助治疗后的T再分期评价可能需要辅助其他影像学手段。低位直肠癌的准确率较低,可能与该部位的特殊解剖有关。因为低位直肠包括肛管、腹膜反折以下的直肠,该段直肠包绕内、外括约肌、肛提肌等肌群,无明显外膜结构。新辅助治疗后,各肌层分界不清,导致T分期错误。
本研究尚存在不足,缺乏MRI做同期对照,另外在对肿瘤发生部位对诊断准确性的研究上,数量匹配欠佳,高位直肠癌的病例偏少。在今后的研究中将对上述不足进一步探讨。
综上所述,ERUS对直肠癌新辅助治疗后T再分期的诊断准确性较高,尤其是中位和高位直肠癌。ERUS可作为再分期诊断的有效手段。
所有作者均声明不存在利益冲突



























