
探讨慢性高原病(CMS)骨髓有核红细胞中VHL/低氧诱导因子(HIF)-α信号通路的表达情况以及相互影响。
以2016年1月至2017年12月在青海大学附属医院就诊的25例CMS患者及21例健康对照人群为研究对象,免疫磁珠分选出CD71+CD235a+的骨髓有核红细胞,实时荧光定量PCR法以及Western印迹法分别测定骨髓有核红细胞HIF-1α、HIF-2α以及VHL mRNA和蛋白表达水平并进行比较,了解各指标的变化及相互关系。
CMS患者骨髓有核红细胞中HIF-2α mRNA[1.68(0.81,2.22)]表达水平高于健康对照组[0.98(0.60,1.19)](P<0.05),HIF-1α及VHL mRNA表达差异均无统计学意义(均P>0.05);Spearman相关分析提示CMS患者骨髓有核红细胞中HIF-2α mRNA与血红蛋白呈正相关(ρ=0.504,P<0.05),HIF-2α mRNA与VHL mRNA呈正相关(ρ=0.647,P<0.05);Western印迹测定CMS骨髓有核红细胞HIF-2α表达水平为0.94(0.68,3.30),高于健康对照组0.59(0.30,0.88),差异有统计学意义(P<0.05);但HIF-1α及VHL表达差异均无统计学意义(均P>0.05)。
CMS患者骨髓有核红细胞中HIF-2α表达异常增高,可能促进下游低氧感受基因异常表达,参与CMS的发生发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性高原病(chronic mountain sickness,CMS)是由于高原人群对高原低压低氧环境失代偿而导致的临床综合征,其主要特征是红细胞过度增生和低氧血症,发病机制尚未完全阐明。低氧诱导因子(HIF)是机体低氧反应的中枢,其下游靶基因在胞内、组织局部及全身的缺氧反应中均发挥重要作用[1]。HIF-α活性受氧浓度调控[2]:常氧时,HIF-α被脯氨酸羟化酶羟化,与VHL肿瘤抑制蛋白(pVHL)结合经泛素-蛋白酶体途径降解;低氧时,HIF-α羟化受抑,稳定性增强,与HIF-β结合成异源二聚体,调控下游靶基因表达。多项临床研究证据表明[3,4],HIFs通路可能参与CMS发病。低氧刺激是CMS发病的始动因素,但骨髓低氧过反应可能是导致CMS的根本原因。本课题组前期在青藏高原CMS患者骨髓单个核细胞中检测出HIF-2α基因高表达[5]。骨髓有核红细胞受骨髓微环境多种因素调控,分化、发育为成熟的红细胞,与CMS红细胞的过度积累直接相关,但是目前没有CMS患者骨髓有核红细胞中HIFs变化的研究。本研究以25例CMS及21例健康对照人群为研究对象,免疫磁珠分选出CD71+CD235a+的骨髓有核红细胞,采用实时荧光定量PCR法和Western印迹测定骨髓有核红细胞HIF-1α、HIF-2α以及VHL mRNA和蛋白表达水平并进行比较,以期为进一步阐明CMS发病机制提供理论依据。
(1)CMS组:25例,为2016年1月至2017年12月青海大学附属医院就诊CMS患者,均为男性汉族,年龄(50±10)岁,长期居住于海拔3 000 m以上地区。按照2004年第六届国际高原医学大会的CMS青海积分标准[6],CMS积分≥5分,同时血红蛋白≥210 g/L者为入组标准,排除真性红细胞增多症、慢性肺病、心血管疾病、慢性肾病以及肿瘤性疾病等可继发红细胞增多症者。(2)健康对照组:21例,为同时期在青海大学附属医院就诊的血象与骨髓象均正常的骨科取内固定手术者和健康志愿者,均为男性、汉族,长期居住于海拔2 500 m以上地区,年龄(47±15)岁。完善心电图、尿常规、胸部X线片、肝功能、肾功能及B超等检查均显示正常。采集所有研究对象骨髓液,检测骨髓有核红细胞中HIF-1α、HIF-2α以及VHL表达并进行比较。本研究取得青海大学附属医院伦理委员会的批准,受试对象均签署知情同意书。
人淋巴细胞分离液(英国Sigma公司),总RNA提取剂Trizol(美国Invitrogen公司),CD71磁珠抗体和CD235a磁珠抗体(德国Miltenyi公司),ABI 7500 PCR仪(美国ABI公司),高速低温离心机5417R(德国Eppendorf公司),cDNA合成试剂盒及荧光定量试剂盒(北京宝日医生物技术有限公司),紫外/可见光分光光度计(美国NanoDrop 2000公司),兔抗人HIF-1α多克隆抗体、兔抗人HIF-2α多克隆抗体、兔抗人VHL多克隆抗体、兔抗人β-肌动蛋白多克隆抗体及辣根过氧化物酶(Horse Radish Peroxidase,HRP)标记的山羊抗兔IgG(美国Abcam公司),自动化学发光凝胶成像分析仪(美国GE Amersham Imager 600),蛋白电泳仪(美国Bio-Rad公司)。
EDTA抗凝试管收集骨髓液15 ml,磷酸盐缓冲液稀释2倍后,加至等体积的Ficoll淋巴细胞分离液(比重1.007)面上,以密度梯度法分离骨髓单个核细胞(BMMNC),锥虫蓝染色后进行细胞计数,每1×107个细胞加入CD71抗体20 μl,4 ℃孵育15 min后进行磁珠分选。取CD71+细胞,细胞计数后,每1×107细胞加入CD235a抗体20 μl,4 ℃孵育15 min后进行磁珠分选,取CD235a+细胞,2 000转/min离心,弃上清,得到的细胞沉淀即为CD71+CD235a+细胞。将细胞分为2份:一份细胞沉淀中加入1 ml trizol,-80 ℃冰箱冻存,用于实时荧光定量PCR;另一份细胞沉淀直接置于-80 ℃冰箱冻存,用于Western印迹。
(1)引物合成:引物依据GeneBank中人HIF-1α、HIF-2α、VHL和β-actin基因序列设计引物,由德国凯杰生物工程公司合成。(2)提取总RNA和逆转录成cDNA:在分选好的CD71+,CD235+细胞中加入Trizol 1 ml,依据说明书提取RNA,测OD值,OD260/OD280值在1.7~2.0之间。RNA浓度在100 ng/μl~300 ng/μl之间。根据反转录试剂说明书,将RNA反转录成cDNA,-80 ℃保存。(3)RT-qPCR检测:反应体系的体积位20 μl,包括:SYBR Premix Ex Taq Ⅱ(TliRNaseH Plus)(2×)10 μl,PCR正向引物(10 μmol/L)0.8 μl,PCR反向引物(10 μmol/L)0.8 μl,ROX Reference Dye Ⅱ 0.4 μl,双蒸水6 μl,cDNA 2 μl。反应条件:预变性95 ℃ 30 s,1个循环;PCR反应:95 ℃ 5 s,60 ℃ 34 s,共40个循环。根据相对定量法,计算出目的基因mRNA表达水平[7]。每个样本设置3个复孔,取平均值。计算公式为目的基因的mRNA水平=2-ΔΔCt。(ΔCt值=目标基因Ct值-内参基因Ct值,以β-肌动蛋白为内参基因;ΔΔCt值=实验组目标基因ΔCt值-健康对照组目标基因ΔCt值)。
(1)样品制备:细胞用蛋白裂解液RIPA裂解,冰上放置1 h,14 000×g离心15 min,留上清。取一部分进行BCA蛋白定量,剩余的蛋白样本与4×上样缓冲液充分混合,100 ℃加热10 min,-80 ℃冰箱保存。(2)SDS-PAGE电泳:在孔道中加入待测样本20 μg和预染蛋白标记(marker)5 μl。5%浓缩胶60 V,20 min,至marker条带分开;10%,12%分离胶120 V,100 min,至上样缓冲液刚跑到末端。(3)转膜:HIF-1α、HIF-2α 15 mA,过夜转;VHL 200 mA,转30 min;β-肌动蛋白200 mA,转50 min。(4)封闭:转膜后,取出PVDF膜,蛋白面朝上,3%脱脂奶粉封闭,摇床室温2 h。(5)孵一抗:将PVDF膜浸入稀释后的一抗(HIF-1α、HIF-2α 1∶1 000,VHL、β-肌动蛋白1∶2 000),4 ℃摇床孵育过夜。缓冲盐溶液(Tris-Buffered Saline Tween-20,TBST)洗膜10 min×5次。(6)孵二抗:将PVDF膜浸入稀释后的二抗1∶5 000,室温摇床孵育1 h。TBST洗膜10 min×5次。(7)发光显影:避光条件下,A液与B液按1∶1比例混匀,湿润PVDF膜1 min。待膜与发光液充分接触后,置于Amersham Imager 600内显影。目的蛋白的相对表达量=目的条带吸光度值/β-肌动蛋白条带的吸光度值。
所有研究对象均采用全自动血细胞分析仪(日本Sysmex公司XE-2100)分析血常规,江苏鱼跃医疗公司指夹式脉搏血氧仪测定血氧饱和度。
采用SPSS 19.0统计软件进行数据分析。数据均为计量资料,正态性检验采用K-S检验。正态分布资料采用 ±s表示;非正态分布资料以[M(Q1,Q3)]表示,两组间差异的显著性检验采用Mann-Whitney U检验,指标间相关性分析采用Spearman秩相关分析。以α=0.05为检验水准。P<0.05为差异有统计学意义。
±s表示;非正态分布资料以[M(Q1,Q3)]表示,两组间差异的显著性检验采用Mann-Whitney U检验,指标间相关性分析采用Spearman秩相关分析。以α=0.05为检验水准。P<0.05为差异有统计学意义。
两组患者年龄差异无统计学意义。实验室检查,CMS组血红蛋白、红细胞数、红细胞压积均高于健康对照组(均P<0.001),而血氧饱和度显著低于健康对照组(P<0.05)。两组之间白细胞数、血小板数差异无统计学意义。根据第六届国际高原医学和低氧生理学术大会颁布的CMS青海诊断标准计分,CMS组中10例为轻度,9例为中度,6例为重度(表1)。
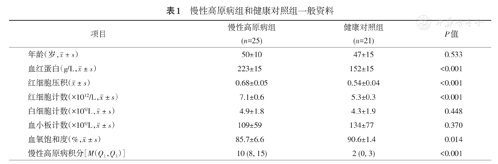
慢性高原病组和健康对照组一般资料
慢性高原病组和健康对照组一般资料
| 项目 | 慢性高原病组(n=25) | 健康对照组(n=21) | P值 |
|---|---|---|---|
年龄(岁, ±s) ±s) | 50±10 | 47±15 | 0.533 |
血红蛋白(g/L, ±s) ±s) | 223±15 | 152±15 | <0.001 |
红细胞压积( ±s) ±s) | 0.68±0.05 | 0.54±0.04 | <0.001 |
红细胞计数(×1012/L, ±s) ±s) | 7.1±0.6 | 5.3±0.3 | <0.001 |
白细胞计数(×109/L, ±s) ±s) | 4.9±1.8 | 4.3±1.9 | 0.448 |
血小板计数(×109/L, ±s) ±s) | 109±59 | 134±77 | 0.370 |
血氧饱和度(%, ±s) ±s) | 85.7±6.6 | 90.6±1.4 | 0.014 |
| 慢性高原病积分[M(Q1,Q3)] | 10 (8, 15) | 2 (0, 3) | <0.001 |
(1)CMS患者骨髓有核红细胞中HIF-2α mRNA明显高于健康对照组,差异有统计学意义(P=0.033);而CMS患者骨髓有核红细胞中HIF-1α和VHL mRNA与健康对照组相比较,差异无统计学意义(P=0.898,P=0.559)(表2)。(2)相关分析:CMS组骨髓有核红细胞中HIF-2α mRNA与血红蛋白呈正相关性(ρ=0.504,P=0.007);CMS组骨髓有核红细胞中HIF-2α mRNA与VHL mRNA呈正相关(ρ=0.647,P=0.002)。
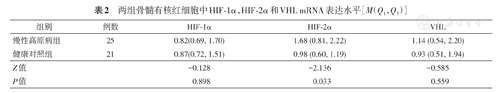
两组骨髓有核红细胞中HIF-1α,HIF-2α和VHL mRNA表达水平[M(Q1,Q3)]
两组骨髓有核红细胞中HIF-1α,HIF-2α和VHL mRNA表达水平[M(Q1,Q3)]
| 组别 | 例数 | HIF1α | HIF2α | VHL |
|---|---|---|---|---|
| 慢性高原病组 | 25 | 0.82(0.69, 1.70) | 1.68 (0.81, 2.22) | 1.14 (0.54, 2.20) |
| 健康对照组 | 21 | 0.87(0.72, 1.51) | 0.98 (0.60, 1.19) | 0.93 (0.51, 1.94) |
| Z值 | -0.128 | -2.136 | -0.585 | |
| P值 | 0.898 | 0.033 | 0.559 |
CMS患者骨髓有核红细胞中HIF-2α蛋白表达高于健康对照组,差异有统计学意义(P=0.036),而HIF-1α、VHL与健康对照组相比较,差异无统计学意义(P=0.239,P=0.670)(表3)。
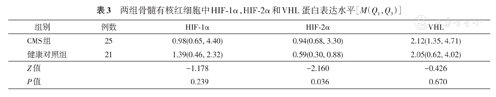
两组骨髓有核红细胞中HIF-1α,HIF-2α和VHL蛋白表达水平[M(Q1,Q3)]
两组骨髓有核红细胞中HIF-1α,HIF-2α和VHL蛋白表达水平[M(Q1,Q3)]
| 组别 | 例数 | HIF1α | HIF2α | VHL |
|---|---|---|---|---|
| CMS组 | 25 | 0.98(0.65, 4.40) | 0.94(0.68, 3.30) | 2.12(1.35, 4.71) |
| 健康对照组 | 21 | 1.39(0.46, 2.32) | 0.59(0.30, 0.88) | 2.05(0.62, 4.02) |
| Z值 | -1.178 | -2.160 | -0.426 | |
| P值 | 0.239 | 0.036 | 0.670 |
CMS是高原人群对高原低压低氧环境逐渐失习服而罹患的一种疾病,主要特征是红细胞增多和低氧血症,主要病因是机体缺氧。低氧诱导因子(HIF)是低氧反应的关键因素,HIF-α通过低氧信号通路中pVHL介导的E3泛素-蛋白酶体途径被降解。
骨髓是成年人红细胞生成最主要的造血组织。CD71在红系祖细胞、红系前体细胞早期阶段表达较高,随着红系发育成熟,表达逐渐降低;而CD235a表达与CD71的表达相反,随着红系发育成熟其表达逐渐升高。因此,CD71+CD235a+有核红细胞可作为骨髓有核红细胞群体的代表。本课题正是基于研究CMS患者骨髓有核红细胞中低氧信号通路的HIF-α,VHL的变化,初步探讨骨髓有核红细胞中低氧信号VHL/HIF通路在CMS病理过程中的作用和意义。
HIF-1α和HIF-2α有48%的氨基酸序列是相同的,蛋白质结构相似,但它们的功能并不重复,而且有不同的靶基因及调节机制。目前认为低氧的持续时间和氧浓度是调控HIF-1α和HIF-2α活化程度以及持续时间的"开关",HIF-1α和HIF-2α在不同的条件下活化程度以及持续时间不同,参与相互独立、但又相互补充的生理以及病理过程[8]。
研究发现,在某些细胞(如肝癌细胞、成神经细胞瘤细胞)中,HIF-1α在低氧的早期(2~24 h)以及严重缺氧(<0.1% O2)时活性最强,而在低氧48~72 h后或生理性低氧(<5% O2)条件下HIF-2α呈持续活化状态。由此可见,HIF-1α可启动最初的低氧反应,而慢性缺氧条件下是由HIF-2α发挥主要的调节作用[9]。
本研究发现CMS患者有核红细胞中异常活化的HIF-α亚基是HIF-2α而非HIF-1α。因此认为,高原慢性低氧环境失去习服而导致的CMS的发病机制中,HIF-2α发挥了重要的调节作用。进一步相关分析,HIF-2α mRNA与血红蛋白呈正相关,提示在某些高原个体,由于对低氧环境失习服,骨髓有核红细胞中HIF-2α异常活化后促进过度的红细胞生成,进而导致CMS的发生,但具体机制有待进一步研究。
有研究报道,CMS患者骨髓单个核细胞中红系特异性转录因子GATA1的表达显著高于健康对照组[10]。进一步的动物实验表明,CMS动物模型小鼠骨髓CD71+细胞中,HIF-2α和红系特异性转录因子GATA1 mRNA和蛋白的表达水平均高于正常,而且HIF-2α与GATA1呈正相关[11],GATA1在红系组细胞的发育过程中,发挥促进红系分化、成熟,抗凋亡的重要作用[12]。我们推测,低氧导致骨髓红系有核细胞HIF-2α持续活化增加,进一步诱导GATA1表达增强,促进红系分化增加,最终导致红细胞的过度积累,参与CMS发病,课题组后续的研究中也确实发现CMS患者骨髓有核红细胞中HIF-2α和GATA1表达呈正相关(结果待发表),但通过何种途径发挥调控作用有待进一步研究。
VHL蛋白(pVHL)和Elongin B,Elongin C,Cul2,Rbxl形成具有E3泛素-蛋白酶活性的复合物,识别羟基化的HIF-α,最终经26S蛋白酶体途径降解。VHL是一种主要的抑癌基因,其突变最早发生在以血管化程度较高的肿瘤为特征的VHL病患者,而且此类患者常表现为红细胞增多症,血清EPO水平显著增高,研究发现,此类型红细胞增多症与VHL突变后对于HIF-2α降解受到抑制所致[13]。那么,CMS患者骨髓组织以及有核红细胞中HIF-2α异常增高是否由于高原慢性低氧环境下骨髓细胞中VHL基因以及蛋白表达抑制所致。
然而,本研究并没有发现骨髓有核红细胞中VHL在两组研究对象中有表达差异,也没有发现VHL mRNA与血红蛋白相关,但骨髓有核红细胞中VHL mRNA与HIF-2α mRNA呈正相关,提示VHL可能间接参与CMS的发生及发展,具体机制有待进一步研究。
总之,本研究表明CMS患者骨髓有核红细胞中VHL/HIF-2α可能在CMS发病机制中发挥着重要作用,但其具体作用机制值得进一步研究。加强VHL/HIF-2α通路在CMS发生、发展中的研究,有利于进一步阐明其发病机制及病理过程,并可能为该病寻找出治疗和干预的新靶标。
所有作者均声明不存在利益冲突



























