
对脑深部电刺激术(DBS)术后颅内积气(ICA)与电极移位进行相关性分析,并对双侧出现ICA的情况下,两侧电极的精度进行对比研究。
收集北部战区总医院神经外科2017年2月至2019年2月双侧DBS手术患者133例,共植入电极266侧,其中丘脑底核(STN)160侧,丘脑腹中间核(Vim)2侧,苍白球内侧部(Gpi)104侧。所有病例均于术后2 h和术后1周复查头部CT三维重建(0.625 mm),与术前手术计划融合,测量植入电极与手术计划相对应靶点在靶点平面X轴和Y轴上的偏差距离。ICA体积由术后复查CT逐层测量相加得出。计量资料采用 ±s表示,行t检验,双变量关联性分析采用直线相关分析,P<0.05为差异有统计学意义。
±s表示,行t检验,双变量关联性分析采用直线相关分析,P<0.05为差异有统计学意义。
两侧电极在术后1周与术后2 h复查CT与术前计划的融合误差在X轴上[术后2 h误差(0.01~1.75)mm,平均(0.44±0.33)mm;术后1周误差(0~1.17)mm,平均(0.40±0.13)mm]差异无统计学意义,在Y轴上差异具有统计学意义。术后ICA体积与两次融合误差的差值在X轴不具有线性相关关系,在Y轴上具有直线相关关系,且为正相关,差异具有统计学意义。
ICA体积是影响DBS手术精度的重要因素,ICA体积越大,电极在Y轴上的移位越大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑深部电刺激术(DBS)目前已经成为治疗帕金森病、特发性震颤、肌张力障碍以及其他运动障碍性疾病的一种行之有效的治疗手段[1]。它具有创伤小、恢复快及可调节等优点。DBS术的治疗效果主要与靶点选择、电极的精准植入以及术后合理调控有关,在这其中电极的高精度植入是疗效的重要保证[2]。术后电极移位已经被众多学者报道[3,4,5],最主要的原因是颅内积气(ICA)对电极的影响,术后ICA会导致电极尖端产生移位,影响DBS的手术精度。本研究旨在找出ICA的体积与电极移位之间的关系,以及双侧DBS术两侧均出现ICA时,两侧电极的植入精度是否有差异。
选取北部战区总医院神经外科2017年2月至2019年2月行双侧DBS术患者133例,其中男73例,女60例,年龄15~86(62.32±12.02)岁;病程4~34年,平均(8.81±1.41)年。133例患者中帕金森病118[丘脑底核(STN)154侧,苍白球内侧部(Gpi)82侧]、特发性震颤1例[丘脑腹中间核(Vim)2侧]、肌张力障碍6例(STN核6侧,Gpi核6侧)、梅杰综合征7例(Gpi核14侧)、抽动秽语综合征1例(Gpi核2侧);共植入电极266侧,其中STN核160侧,Vim核2侧,Gpi核104侧。
(1)帕金森病;符合中国帕金森病诊断标准(2016年版)[6];(2)特发性震颤:符合德国DBS治疗特发性震颤专家共识(2009年)[7];(3)肌张力障碍:符合欧洲神经学会联盟肌张力障碍诊断和治疗指南(2011年)[8];(4)梅杰综合征:符合我国Meige综合征诊断和治疗专家共识(2018年)[9];(5)抽动秽语综合征:符合欧洲抽动秽语综合征和其他抽动障碍指南(2011年)[10]。
(1)除原发性帕金森病以外的帕金森综合征。(2)Hoehn-Yahr分期在Ⅴ期的患者。(3)因植入心脏起搏器、心脏除颤器的金属植入物而无法进行MRI检查的患者。(4)合并严重心脏、肝肾功能衰竭。(5)合并严重精神及认知障碍。
见文献[11]。
所有入组病例均于术后2 h和术后1周复查头部三维重建,将术后CT图像传输至ROSA计算机工作站中,并与术前CT融合,在"Axial(AC-PC)"图像上选取靶点平面,计算植入电极中心位置与手术计划相对应靶点在X轴和Y轴上的偏差距离。ICA体积由术后2 h复查CT逐层测量相加得出(图1,图2,图3)。


术后复查CT观察有无颅内出血、电极偏移、颅内感染及切口愈合不良等相关并发症。
采用SPSS21.0统计软件,检验水准为双侧α=0.05;计量资料采用 ±s表示,差异统计学检验行配对t检验,双变量关联性分析采用直线相关分析,以P<0.05为差异有统计学意义。
±s表示,差异统计学检验行配对t检验,双变量关联性分析采用直线相关分析,以P<0.05为差异有统计学意义。
全部266根治疗电极均成功植入,STN核160侧,Vim核2侧,Gpi核104侧。未发生颅内出血、颅内感染和偏瘫等严重并发症,也未出现电极折断现象。在133例双侧DBS的患者中,17例两侧均没有出现ICA;3例第一侧出现ICA,而第二侧没有;12例第二侧出现ICA,而第一侧没有;共101例两侧均出现1CA。
第一侧植入电极在术后2 h及术后1周复查CT与术前计划融合之后的误差进行对比分析:在X轴上:术后2 h误差(0.01~1.75)mm,平均(0.44±0.33)mm;术后1周误差(0~1.17)mm,平均(0.40±0.13)mm,差异无统计学意义(t=1.28,P>0.05)。在Y轴上:术后2 h电极误差(0.02~2.73)mm,平均(0.75±0.19)mm;术后1周电极误差(0~1.55)mm,平均(0.57±0.05)mm,差异有统计学意义(t=4.12,P<0.05),表1。
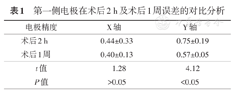
第一侧电极在术后2 h及术后1周误差的对比分析
第一侧电极在术后2 h及术后1周误差的对比分析
| 电极精度 | X轴 | Y轴 |
|---|---|---|
| 术后2 h | 0.44±0.33 | 0.75±0.19 |
| 术后1周 | 0.40±0.13 | 0.57±0.05 |
| t值 | 1.28 | 4.12 |
| P值 | >0.05 | <0.05 |
第二侧植入电极在术后2 h及术后1周复查CT与术前计划融合之后的误差进行对比分析:术后1周复查CT所示全部患者ICA消失。X轴:术后2 h误差(0~2.21)mm,平均(0.51±0.36)mm;术后1周误差(0.01~1.75)mm,平均(0.46±0.26)mm,差异无统计学意义(t=2.29,P>0.05)。Y轴术后2 h(0.01~1.9)mm,平均(0.78±0.35)mm;术后1周误差(0.01~1.55)mm,平均(0.58±0.27)mm,差异有统计学意义(t=4.9,P<0.05),表2。
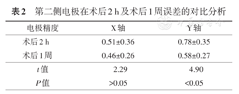
第二侧电极在术后2 h及术后1周误差的对比分析
第二侧电极在术后2 h及术后1周误差的对比分析
| 电极精度 | X轴 | Y轴 |
|---|---|---|
| 术后2 h | 0.51±0.36 | 0.78±0.35 |
| 术后1周 | 0.46±0.26 | 0.58±0.27 |
| t值 | 2.29 | 4.90 |
| P值 | >0.05 | <0.05 |
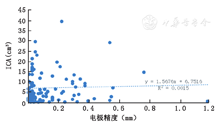
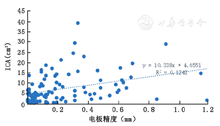
分别记录两侧电极X轴、Y轴在术后2 h及术后1周与术前计划融合误差的差值,在术后2 h复查CT中算出1CA的体积,其中104例患者第一侧电极发生1CA。第一侧植入电极X轴的误差变化△X1(0~1.15)mm,平均(0.13±0.18)mm,对应1CA体积(0.1~39.3)cm3,平均(6.95±7.35)cm3,差异无统计学意义(r=0.038,P>0.05);Y轴的误差变化△Y1(0~1.18)mm,平均(0.22±0.25)mm,差异有统计学意义(r=0.352,P<0.05),图4,图5。


第二侧电极中113例患者发生1CA,第二侧植入电极X轴的误差变化△X2(0~1.19)mm,平均(0.16±0.19)mm,对应1CA体积(0.05~38.2)cm3,平均(5.97±7.24)cm3,差异无统计学意义(r=0.009,P>0.05);Y轴的误差变化△Y2(0~1.4)mm,平均(0.23±0.21)mm,差异有统计学意义(r=0.513,P<0.05),图6,图7。


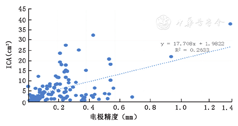

本研究结果说明,术后1CA体积与两次融合电极误差的差值在X轴不具有线性相关关系,在Y轴上具有直线相关关系,差异有统计学意义,且为正相关。
DBS术已被广泛应用于帕金森病、特发性震颤、肌张力障碍以及其他运动障碍性疾病的治疗中。DBS的手术精度是患者获得满意疗效的重要保障[12],也是该手术最重要的一点。术后电极移位是近年来DBS术相关的研究热点,造成术后电极移位的原因包括术后ICA、手术方式的机械误差、术者操作不熟练所造成的误差。排除其他因素干扰,ICA导致的脑漂移最终增加电极植入误差,有时是临床上不可回避的问题[13,14]。有研究显示,术后3 d至2周,由DBS术所导致的1CA会明显较少,ICA所导致的脑组织移位会回到原来的位置[15]。所以,术后1周复查CT所示电极位置可以认为就是最终的电极植入位置。Elias等[16]在分析ICA与额叶皮层和前联合的运动时发现,ICA的体积与这两个点的向后移位有关,ICA达到20 cm3会导致电极2 mm的移位,但是这次研究的主要缺陷在于没有分析ICA体积与电极植入精度之间的关系。ICA的产生会导致电极尖端的移动,在电极移位超过1 mm的病例当中,均发现了体积较大的ICA。实际上,van d等[17]分析了26根植入电极的误差平均为(1.2~2.6)mm。在该研究中,ICA体积为(17±24)cm3,并得出结论电极在X轴、Y轴与Z轴上的移位均与ICA体积有关,笔者认为这可能与该研究中患者的1CA体积较大(是本研究3倍)有关。ICA体积较大会导致电极移位的不确定性,无论在哪个方向上均有移位,所以得出的结论并不完全正确。有研究显示,在术后即刻和6个月评估电极位置,电极末端与近骨孔处电极的偏移均与ICA有关[18]。以上研究均说明,术后ICA的体积与电极精准度有着密不可分的关系,但是目前还缺少针对两者之间的确切分析。
本研究发现,电极在术后2 h的融合误差要大于其在术后1周的融合误差,而这种误差在Y轴上差异有统计学意义。因为术后1周ICA已经消失,电极精度为最终的植入精度,所以本研究结果提示,1CA的消失可能与电极在Y轴上的精度变化有相关关系。对此本研究进一步分析了ICA的体积与2次融合误差的变化量之间的关系,通过统计学分析发现,ICA的体积与电极在X轴上的移位并无相关关系,而在Y轴上差异有统计学意义,呈线性正相关。说明,ICA的体积越大,所造成的电极在Y轴上的移位就越多,进一步印证了本文作者对于ICA体积与电极在Y轴上的移位相关关系的猜想。在本组全部患者中,术后1周融合图像的电极位置均比术后2 h融合图像中相对应(同一患者,同一侧,同一坐标轴)的位置向前移位,这项结果提示,ICA的体积是电极位置偏后的一个重要原因,ICA消失后,电极会随着脑组织向前漂移而移位。
多数学者研究发现,ICA形成之后,在术后当时电极位置是准确的,而当患者ICA消失时,在术中因ICA形成所导致的脑组织向后移位会向前回弹,脑组织向前移位使颅内电极的位置也会向前移位,使电极比预设计划位置偏前,误差变大[19,20]。而本研究发现,术后2 h的电极位置比手术计划偏后,在ICA消失后,电极随着脑组织向前移位,从而使电极更加贴近手术计划,误差更小,与国外学者的研究结果并不相符。这是因为,在手术过程中,切开硬脑膜之后,脑脊液会开始流失,当微推进器到达指定位置之后,金属套管置入脑组织内,此时金属套管与脑组织的相对位置不变,由于本中心在硬膜切开与将套管置入脑组织的时间较短,平均在1 min 25 s左右,因此在套管置入之后,脑脊液还在持续流失当中,但因金属套管置入脑组织所产生的支撑作用,颅内电极相对于头部的位置不会改变;当电极植入成功,金属套管拔出时,由于脑组织失去了套管针的相对支撑作用会向后移位,此时颅内电极随着脑组织的后移而后移,导致术后2 h CT融合显示电极位置偏后。如果在脑脊液流失、脑组织已经后移之后才置入套管,这样电极就会在术中看起来很准,而在远期随访时发现电极偏前。本文作者推测,国外中心报道电极移位的变化主要与他们术中脑脊液流失多,需要调整靶点,反复调整套管针位置有关;同时也与使用多通道微电极记录、硬膜切口大有关。本文作者体会:(1)在脑脊液还未流失就置入微电极套管能够有效降低脑脊液流失对电极精度的影响,所以最好一次性精准植入电极,如果调整靶点,因1CA所致脑漂移将影响电极植入精度。(2)机器人激光定位以及手术计划已经确定了皮层穿刺点,硬膜切口很小、正对皮层及手术计划已经准确避开血管都与手术时间、电极植入精度及减少脑脊液流失有关。(3)植入电极时选择在脑回进针而不是脑沟进针也很关键,这是因为:在脑回进针时由于皮质与蛛网膜距离较近,无需切开蛛网膜(或适当电凝烧灼)即可植入电极,进而减缓脑脊液流失的速度或不流失。如果选择在脑沟处进针,皮质与蛛网膜之间距离较大,需要切开蛛网膜后才能植入电极,蛛网膜间隙大,脑脊液流失速度快,影响电极精度。更为关键的是,脑沟进针也容易损伤血管导致穿刺道出血。(4)电极植入以后直接骨腊封闭骨孔和硬膜孔,也可避免脑脊液进一步流失。减少ICA对植入电极精度的影响,其重中之重就是在脑脊液流失之前置入微电极套管,并且尽可能避免调整靶点,如果调整靶点,需要拔出套管针,则与国外文献报道一致。(5)根据本研究数据可以发现,在脑脊液已经流失,或者术中需要调整靶点时,为了减少脑脊液流失对于电极精度的影响,可以将靶点向后调整0.5~1 mm。
减少ICA体积已经成为提高DBS手术精度的关键,为了减少ICA体积可以采用以下方法:(1)应用机器人辅助DBS手术。因为机器人具有操作简便、安全快捷的特点,不需要安装定位弧弓,微推进器在硬膜切口之前已经安装在机械臂的固定基座上,减少了硬膜切开后的操作程序,使术者能够尽快将套管置入脑组织,以减少ICA对电极精度的影响。机器人辅助DBS术的另一个优点就是精准度高,这使本研究在术中可以将硬膜切口的直径控制在2 mm,也能减缓脑脊液流失的速度;而且在术中很少需要调整靶点,避免了套管置入之后反复调整位置所带来的精准性变化隐患和安全性隐患。使用机器人辅助DBS手术,能使ICA对电极植入精度的影响降到最低,但是在排除掉ICA对于颅内电极的影响之后,电极位置依旧存在0.4~0.6 mm的误差,表明该误差可能是由于其他因素,如机器人本身的系统误差所导致,还需各位学者进行深入研究,使DBS手术精度越来越高。(2)在使用传统立体定向辅助(如Nexframe、Leksell等)时,因其定位基环比较大,影响术者操作空间,使套管置入与硬脑膜切开之间的时间增加,套管置入时,脑脊液流失基本完成,这时电极植入的位置在术后2 h的CT中精确度较高,而在ICA消失后,脑组织向前移位,使得电极会比预设靶点偏前。在使用传统框架辅助DBS术的中心,减少脑脊液的流失是其关键,可以在切开硬脑膜之前,让助手将弧弓、推进器及套管提前准备好,尽力减少硬膜切开后的操作步骤;或是在套管置入脑组织后将生物蛋白胶均匀地喷涂在套管外围,亦或是将生物蛋白胶迅速涂抹在骨孔,在脑脊液流失已经出现后,可以经验性地将靶点向后调整0.5~1 mm来减少ICA体积电极精度的影响也是可取的,同时提升术者的手术熟练程度也是必不可少的。
综上所述,ICA体积是影响DBS手术精度的重要因素,ICA体积与电极在Y轴上的移位呈正相关。减少ICA体积能够减少电极在Y轴上的位移,提高电极植入精度,减少脑漂移对电极植入精度的影响。
所有作者均声明不存在利益冲突



























