
探讨过氧化物酶体增殖物激活受体γ辅激活因子(PGC)-1β在诱导小鼠单核巨噬细胞(RAW264.7)向破骨细胞分化及活化的调控作用及机制。
体外培养RAW264.7细胞,慢病毒转染下调或过表达PGC-1β后采用巨噬细胞集落刺激因子和重组细胞核因子κB受体活化因子配体体外诱导RAW264.7细胞向破骨细胞分化。细胞增殖-毒性检测试剂盒法检测细胞活性;流式细胞术检测细胞凋亡、周期,并联合细胞免疫荧光检测PGC-1β表达;抗酒石酸酸性磷酸酶(TRAP)染色鉴定成熟破骨细胞;甲苯胺蓝染色评估骨吸收陷窝面积。核浆分离联合蛋白质免疫印迹法检测PGC-1β表达及定位、破骨细胞相关蛋白[树突状细胞特异性跨膜蛋白(DC-STAMP)、组织蛋白酶K(cathepsin K)、TRAP和基质金属蛋白酶-9(MMP-9)表达及非经典核因子(NF)-κB通路关键分子NF-κB诱导激酶(NIK)和转录因子RelB的水平。
PGC-1β主要表达在RAW264.7细胞胞核中。下调或过表达PGC-1β不影响细胞活性、凋亡及周期。下调PGC-1β后成熟破骨细胞数(49个±21个比147个±42个,P=0.004)及骨吸收陷凹面积(42.11μm2±11.30 μm2比204.80μm2±31.09 μm2,P<0.001)较其对照组显著减少,cathepsin K、TRAP及MMP-9表达下降,而DC-STAMP无明显变化。过表达PGC-1β促进破骨细胞分化活化及cathepsin K、TRAP、MMP-9表达,下调PGC-1β抑制RAW264.7细胞胞浆NIK和胞核RelB表达。
PGC-1β可激活非经典NF-κB通路NIK/RelB促进RAW264.7细胞向破骨细胞分化及促进骨吸收功能,有望成为治疗骨质疏松症的新靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨质疏松症是一种以骨量减少和骨组织微结构受损为特征的代谢性骨病,可导致骨脆性增加并引起骨折。骨质疏松性骨折及骨折后的并发症危害巨大,是老年患者致残甚至致死的主要原因之一[1,2]。我国50岁以上人群骨质疏松症年龄标化患病率女性为29.13%,男性为6.46%,对家庭及社会造成沉重的负担[3]。破骨细胞异常分化活化导致骨吸收异常是引起骨质疏松的主要原因。随着对破骨细胞生物学特性研究的深入,以细胞信号通路为靶点是开发新型骨质疏松治疗药物的热点和方向[4]。过氧化物酶体增殖活化受体γ共激活分子(PGC)-1β是一种共激活转录因子,在调节能量代谢和细胞因子信号转导中起重要作用[5]。动物实验结果表明,条件敲除造血细胞PGC-1β的小鼠与野生型小鼠比较12周龄时股骨骨量显著升高[6],提示PGC-1β可能参与调控骨吸收功能。本研究拟利用小鼠破骨细胞前体细胞——小鼠单核巨噬细胞(RAW264.7)构建PGC1-β下调或过表达细胞模型,通过体外功能及机制实验探讨PGC-1β在破骨细胞分化及活化中的调控作用及其具体机制。
RAW264.7购自中国科学院上海细胞库;RPMI1640培养基和胎牛血清购自美国Gibco公司;下调或过表达PGC-1β慢病毒载体购自上海吉凯基因公司;细胞核浆蛋白分离抽提试剂盒购自美国Pierce公司;细胞增殖-毒性检测试剂盒(CCK-8)和蛋白质免疫印迹法(WB)相关试剂购自上海碧云天生物公司,总RNA提取试剂(Trizol)和实时定量PCR(qRT-PCR)相关试剂购自日本Takara公司;流式细胞术检测和荧光染色使用的兔抗人/小鼠PGC-1β抗体购自北京博奥森公司;重组细胞核因子kappa B受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(M-CSF)购自美国PeproTech公司;WB一抗和流式检测使用的山羊抗兔-FITC荧光二抗购自美国CST公司;Alexa Fluor® 594荧光二抗购自美国Invitrogen公司;FITC标记的Annexin V购自美国BD公司;抗酒石酸酸性磷酸酶(TRAP)染色剂购自美国Sigma公司。本实验所需仪器和设备均由中山大学孙逸仙纪念医院医学研究中心提供。
RAW264.7细胞用含有10%胎牛血清的RPMI1640培养基在37℃、5% CO2培养箱中培养,取处于对数生长期细胞进行后续实验。
采用流式细胞术检测RAW264.7细胞中PGC-1β阳性细胞百分率。采用细胞免疫荧光染色结合激光共聚焦显微镜观察PGC-1β在RAW264.7细胞中的表达。采用qRT-PCR检测PGC-1β mRNA。PGC-1β上游引物序列为5′ACTATCTCGCTGACACGCAG3′,下游引物序列为5′GGCTGTACTGGTTGGGTTCA3′;β-肌动蛋白上游引物序列为5′GGACTTCGAGCA AGAGATGG3′,下游引物序列为5′TGTGTTGGCG TACAGGTCTTTG3′。2-ΔΔCt法计算PGC-1β和β-肌动蛋白mRNA相对表达量。
下调PGC-1β(Lv-sh-PGC-1β)靶基因序列为shRNA1:5′CCGGAGTATGACACCGTATTT3′,shRNA2:5′CATGAGCTCTCGGGAACTAAA3′,shRNA3:5′GGAGGTGAAACGGGATGTTAA3′,以空载shRNA慢病毒(Lv-sh-GFP)作为对照。将全长PGC-1β cDNA克隆进入上调慢病毒载体pLV[Exp],作为上调慢病毒组(Lv-PGC-1β),以空载上调慢病毒(Lv-GFP)作为对照。稳定转染的细胞经嘌呤霉素(1μg/ml)筛选48 h后,采用qRT-PCR和WB检测PGC-1β表达,选择转染效率最高的靶基因序列构建稳转细胞株。
RAW264.7细胞以5×103个每孔接种在96孔板中,细胞同步化处理6 h后,加入CCK-8试剂,放入培养箱中继续孵育4 h。在450 nm测定吸光度(A)值,并根据吸光度计算各组细胞活性:细胞活性(%)=[A(实验组)-A(空白组)]/[A(对照组)-A(空白组)]×100%。
将RAW264.7细胞经胰酶消化后收集、离心,用PBS洗涤、离心,缓冲液重悬,流式细胞术结合Annexin V/PI试剂检测细胞凋亡。另一组RAW264.7细胞冰乙醇固定及加入RNA酶后,PI染色,流式细胞术检测细胞周期。
将RAW264.7细胞按1×106/孔接种于24孔板,贴壁后加入100 μg/L重组RANKL和50 μg/L的M-CSF诱导破骨细胞分化。TRAP染色检测成熟的破骨细胞数量。成熟破骨细胞定义为TRAP染色阳性(胞质内有均匀的酒红色颗粒沉积)且细胞核≥3个的细胞。在48孔培养皿底部放置牛膝骨片,将5×105个RAW264.7细胞均匀接种在骨片上,加入100 μg/L重组RANKL和50 μg/L的M-CSF,甲苯胺蓝染色检测骨吸收陷凹,并用Image J 1.47图像分析系统计算骨吸收陷凹的面积。
采用细胞核浆蛋白分离抽提试剂盒提取RAW264.7细胞胞浆或核蛋白。蛋白经电泳分离、转膜、封闭后,分别在树突状细胞特异性跨膜蛋白(DC-STAMP)、组织蛋白酶K(cathepsin K)、TRAP、基质金属蛋白酶(MMP)-9、NF-κB诱导激酶(NIK)及β-tubulin一抗(均1∶1 000稀释)中4℃孵育过夜检测细胞胞浆蛋白表达,Fibrillarin、PGC-1β及NF-κB/Rel家族转录因子RelB(均1∶1 000稀释)一抗4℃孵育过夜检测细胞核蛋白表达。室温孵育二抗2 h后用增强化学发光液曝光蛋白条带。采用Image J 1.47图像分析系统分析条带灰度值,以β-tubulin作为内参进行相对定量。
所有数据采用SPSS 20.0软件进行统计学处理,并用Graphpad Prism6软件绘制相应图形。正态分布资料以 ±s来表示,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
±s来表示,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
流式细胞仪检测显示,96.74%±2.46%的RAW264.7细胞表达PGC-1β(图1A)。细胞免疫荧光染色显示,PGC-1β主要表达在细胞核(图1B)。细胞蛋白核浆分离后WB结果证实PGC-1β蛋白主要表达在细胞核(胞核95.60%±4.24%,胞浆4.40%±3.19%,图1C)。


注:A.流式细胞术检测过氧化物酶体增殖物激活受体γ辅激活因子1β(PGC-1β)阳性细胞率;B.细胞免疫荧光检测PGC-1β表达及定位;C.核浆分离联合蛋白质免疫印迹法检测RAW264.7细胞浆和细胞核中PGC-1β的表达。Isotype:同型对照;FITC-PGC-1β:异硫氰酸荧光素标记的PGC-1β;DAPI:细胞核染色(蓝色);Merge:叠加合成图片;β-Tubulin:胞浆蛋白内参;Fibrilanrin:核内蛋白内参
与下调空载(Lv-sh-GFP)组相比,shRNA1、2、3组PGC-1β的mRNA水平分别下调84.26%、58.19%及67.83%,蛋白相对表达量分别下调91.66%、59.28%及80.14%(图2A)。shRNA1序列在3组中沉默效果最佳,因此选择该序列进行后续实验。过表达PGC-1β(Lv-PGC-1β)组较过表达空载(Lv-GFP)组PGC-1β mRNA和蛋白相对表达量分别上调2.42、2.02倍(均P<0.001,图2B),提示已建立下调和过表达PGC-1β稳转RAW264.7细胞株。CCK-8法及流式细胞术检测提示PGC-1β不影响RAW264.7细胞活性、凋亡和细胞周期(均P>0.05)。


A.使用3种不同的shRNA序列敲减后细胞中过氧化物酶体增殖物激活受体γ辅激活因子1β(PGC-1β)的mRNA和蛋白相对表达量;B.过表达PGC-1β后细胞中mRNA和蛋白的相对表达量,与下调空载组相比aP<0.001,bP<0.01,与上调空载组相比cP<0.001。Lv-sh-GFP:下调空载组;Lv-sh-PGC-1β-1:shRNA序列1下调PGC-1β组;Lv-sh-PGC-1β-2:shRNA序列2下调PGC-1β组;Lv-sh-PGC-1β-3:shRNA序列3下调PGC-1β组;Lv-GFP:上调空载组;Lv-PGC-1β:上调PGC-1β组
RANKL和M-CSF诱导RAW264.7细胞第12天时,除空白对照组外,各组均可见成熟破骨细胞,其中下调PGC-1β组成熟破骨细胞数量显著低于其空载对照组(49个±21个比147个±42个,P=0.004);过表达PGC-1β组则显著高于其空载对照组(198个±20个比140个±32个,P=0.021,图3)。甲苯胺蓝染色检测发现除了空白对照组外,各组骨片均有骨吸收陷凹形成,其中下调PGC-1β组骨吸收陷凹面积显著低于其空载对照组(42.11μm2±11.30 μm2比204.80 μm2±31.09 μm2,P<0.001),而过表达PGC-1β组则显著高于其空载对照组(297.62μm2±34.17 μm2比217.25μm2±29.84 μm2,P=0.037,图4)。提示,PGC-1β可促进破骨细胞分化及其骨吸收功能。
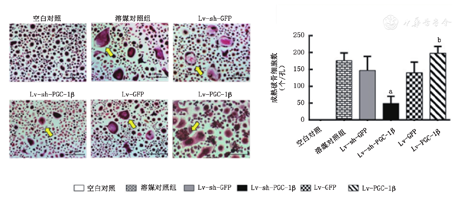

黄色箭头示成熟破骨细胞,与下调空载组相比aP<0.01;与上调空载组相比bP<0.05;空白对照:RAW264.7细胞不加RANKL+M-CSF;溶媒对照组:RAW264.7细胞加RANKL+M-CSF诱导;Lv-sh-GFP:下调空载组;Lv-sh-PGC-1β:下调PGC-1β组;Lv-GFP:上调空载组;Lv-PGC-1β:上调PGC-1β组
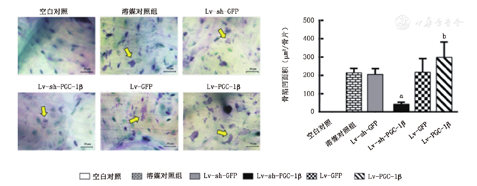

黄色箭头示骨吸收陷凹,与下调空载组相比aP<0.001;与上调空载组相比bP<0.05
WB检测结果显示,下调PGC-1β后RAW264.7细胞中破骨细胞相关蛋白cathepsin K、TRAP和MMP-9的蛋白表达显著低于其空载对照组(均P<0.05),而过表达PGC-1β组则显著高于其空载对照组(均P<0.05)。DC-STAMP蛋白表达各组间差异无统计学意义(图5)。
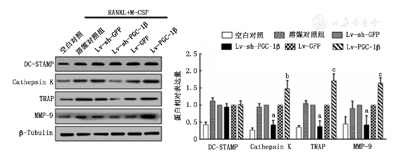

与下调空载组相比aP<0.01;与上调空载组相比bP<0.05,cP<0.01;RANKL:重组细胞核因子κB受体活化因子配体;M-CSF:巨噬细胞集落刺激因子;DC-STAMP:树突状细胞特异性跨膜蛋白;cathepsin K:组织蛋白酶K;MMP-9:基质金属蛋白酶-9
WB检测结果显示,下调PGC-1β后RAW264.7细胞胞浆中NIK蛋白和胞核内RelB的蛋白表达水平较下调空载组显著降低(均P<0.01,图6),提示PGC-1β可能通过激活非经典NF-κB通路促进破骨细胞分化及其骨吸收功能。
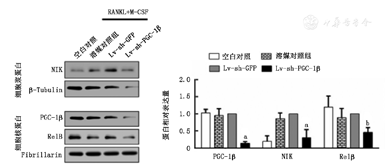

与下调空载组相比aP<0.001,bP<0.01;NIK:NF-κB诱导激酶;RelB:NF-κB/Rel家族转录因子RelB
目前,对破骨细胞分化活化的机制研究发现,RANKL与破骨细胞前体细胞表面受体RANK结合,激活下游信号通路以及破骨细胞相关蛋白的表达。通过上调DC-STAMP促进破骨细胞前体细胞的融合,通过促进细胞伪足形成和TRAP、cathepsin K、MMP-9的表达,降解骨组织有机和无机成分,最终导致骨质流失[7,8]。抗骨质疏松症药物双磷酸盐可与骨骼羟磷灰石特异性结合,覆盖骨重建活跃的骨表面,抑制破骨细胞骨吸收功能,但由于可能产生胃肠道不良反应、流感样症状及肾脏毒性,影响患者长期的应用[9]。RANKL抑制剂Denosumab可特异性抑制RANKL与RANK的结合,减少破骨细胞的形成,从而降低骨吸收,有效治疗骨质疏松症。然而双磷酸盐和Denosumab长期应用可出现过度骨吸收,导致下颌骨坏死或非典型性股骨骨折[9,10]。因此,从破骨细胞自身异常分化活化的调控机制入手,以胞内信号通路为靶点可能是开发更高效低毒的骨质疏松治疗药物的关键。
PGC-1β是由Ppargc1b编码的转录因子,广泛参与调控氧化代谢、糖异生、肝脏脂肪合成及血管生成等过程的不同信号转导通路[11]。Zhang等[6]研究发现,特异性敲除髓系细胞PGC-1β小鼠的骨髓巨噬细胞体外RANKL+M-CSF诱导5 d后形成成熟破骨细胞数量与野生型小鼠骨髓巨噬细胞比较无显著差异,但骨吸收功能显著下降,提示PGC-1β具有调控破骨细胞骨吸收功能的作用。我们前期研究发现常用于构建体外诱导破骨细胞分化模型的小鼠单核巨噬细胞RAW264.7细胞株表达PGC-1β。因此,本研究采用RAW264.7细胞株作为研究PGC-1β对破骨细胞分化及骨吸收功能的工具细胞。我们通过慢病毒转染RAW264.7细胞下调或过表达PGC-1β,发现PGC-1β可促进RAW264.7细胞形成成熟破骨细胞并提高其骨吸收活性,促进破骨细胞相关蛋白TRAP、cathepsin K和MMP-9的表达,提示PGC-1β可促进破骨细胞分化及骨吸收功能。与既往研究结果的差异可能因为本研究使用的RAW264.7细胞株与小鼠骨髓巨噬细胞相比具有更强的分化能力,且诱导时间更长,能更好地发现PGC-1β对破骨细胞分化的调控作用。
NF-κB的激活存在经典和非经典两种途径。其中非经典NF-κB信号通路在RANKL诱导的破骨细胞分化中起重要作用。NIK是非经典NF-κB通路的关键信号分子。RANKL与RANK在破骨细胞前体表面结合后可通过膜受体信号传导激活NIK,进一步激活下游IκB激酶(IKK)α和磷酸化p100,p100与NF-κB的亚基RelB解离后形成RelB:p52二聚体并入核发挥转录功能,促进破骨细胞分化及活化[12]。Taniguchi等[13]研究发现,敲除RelB小鼠的骨髓细胞体外采用RANKL+M-CSF诱导无法形成破骨细胞,而在同时缺失RelB和经典NF-κB通路分子p65的小鼠骨髓细胞中分别进行补救实验,发现过表达RelB可恢复体外RANKL诱导的破骨细胞形成,而过表达p65不行,提示非经典NF-κB通路在破骨细胞分化活化中具有更重要的调控作用。本研究发现,PGC-1β能促进RAW264.7细胞胞浆NIK和核内RelB的表达,提示PGC-1β可能通过激活非经典NF-κB信号通路促进破骨细胞分化活化,进一步阐明了PGC-1β对破骨细胞分化活化的下游调控机制。今后PGC-1β如何调控NIK和RelB的表达的具体机制值得进一步研究。
综上所述,本研究发现RAW264.7细胞胞核表达的PGC-1β可通过激活NIK/RelB信号通路上调cathepsin K、TRAP、MMP-9的表达,促进破骨细胞分化及骨吸收功能。PGC-1β有望成为治疗原发性骨质疏松症的新靶点。
所有作者均声明不存在利益冲突































