
探究动态增强磁共振成像(DCE-MRI)及血氧水平依赖功能磁共振成像(BOLD-MRI)在评估抗肿瘤血管治疗期间血流动力学及肿瘤侵袭性方面的可行性。
利用HCT116细胞株在裸鼠建立结肠癌皮下移植瘤模型,将16只雌性裸鼠(鼠龄6~8周,体质量15~18 g,实验动物许可证编号:11400700325797)随机分为两组,分别于第1、4、7、10、13天经腹腔注射给予贝伐单抗注射液(治疗组)及生理盐水(对照组)处理,然后于第0、3、6、9、12、15天进行DCE-MRI及BOLD-MRI检查。通过病理检查验证肿瘤治疗后的血管成熟程度和微环境缺氧情况。统计学上主要进行单因素方差分析及相关性分析。
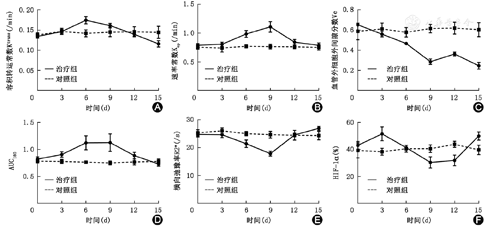
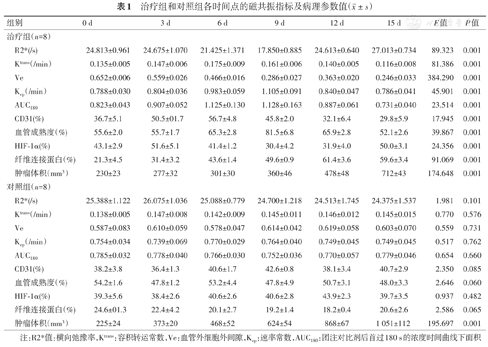
15 d后治疗组的肿瘤体积明显小于对照组,体积分别为(712±43)和(1 051±112)mm3,差异有统计学意义(t=7.969, P<0.01)。治疗组的容积转运常数(Ktrans)各时间点测值为(0.135±0.005)、(0.147±0.006)、(0.175±0.009)、(0.161±0.006)、(0.140±0.005)、(0.116±0.008)/min(F=81.386,P<0.01);速率常数(Kep)分别为(0.788±0.030)、(0.804±0.036)、(0.983±0.059)、(1.105±0.091)、(0.840±0.047)、(0.786±0.041)/min(F=45.901,P<0.01);血管外细胞外间隙(Ve值)分别为(0.652±0.006)、(0.559±0.026)、(0.466±0.016)、(0.286±0.027)、(0.363±0.020)、(0.246±0.033)(F=384.290,P<0.01);横向弛豫率(R2*值)分别为(24.813±0.961)、(24.675±1.070)、(21.425±1.371)、(17.850±0.885)、(24.613±0.640)、(27.013±0.734)/s(F=89.323,P<0.01),差异均有统计学意义。在第3~12天期间Ktrans值、肿瘤血管成熟度(VMI值)高于基态水平。CD31阳性染色率、VMI值与Ktrans值的相关性最高(r值分别为0.854、0.795),其次是AUC180值(r值分别为0.750、0.808),最后是Ve值(r值分别为0.744、0.712)及Kep值(r值分别为0.729、0.758,均P<0.05)。R2*值则与HIF-1α、纤维连接蛋白阳性染色率呈良好的正相关关系(r值分别为0.810、0.816,均P<0.05)。
DCE-MRI及BOLD-MRI可以无创、动态地观察血管抑制剂治疗期间肿瘤微循环灌注及缺氧程度的改变,R2*值可以预测肿瘤治疗期间的转移潜能变化。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肿瘤的生长、侵袭和转移与肿瘤血管的生成密切相关。当新生的肿瘤血管不足以提供肿瘤生长所需要的氧气时就会形成缺氧的微环境,并诱导肿瘤细胞的上皮-间质转化,使肿瘤的侵袭性及转移能力进一步提高[1]。抗血管治疗是当今肿瘤化疗的重要组成部分,但仍然存在一定的争议,如过度抑制新生血管将加重肿瘤缺氧及妨碍药物递送,另有研究报道抗血管治疗可以短暂诱导肿瘤血管的功能正常化,使肿瘤血供增加,乏氧改善[2]。以往利用磁共振成像(MRI)连续监测抗血管治疗后肿瘤微环境改变的研究并不多见,明确抗肿瘤血管治疗的潜在机制、血流动力学及缺氧微环境改变对于在联合放化疗方面有重要的临床意义。因此本研究拟利用动态增强磁共振成像(DCE-MRI)及血氧水平依赖功能磁共振成像(BOLD-MRI)动态监测抗血管生成药物贝伐单抗对裸鼠皮下移植瘤模型的血供及氧供的影响,并结合免疫病理结果,全面评估抗血管治疗后的肿瘤微环境及转移潜能的变化。
50只BALB/C nu/nu裸鼠购于北京维通利华实验动物技术有限公司(实验动物许可证编号:11400700325797),鼠龄6~8周,雌性,体质量15~18 g。相关动物实验操作程序已得到暨南大学实验动物使用与伦理管理委员会批准(批准文号:IACUC-20180410-02)。1%戊巴比妥钠溶液及人源性结肠癌细胞系HCT116由本校药学院赠送。
10 ml基质胶购于广州赛哲科技有限公司,二甲基亚砜和胎牛血清购自美国赛默飞世尔科技公司,抗CD31、α-平滑肌肌动蛋白(α-SMA)、纤维连接蛋白、HIF-1α抗体购于赛维尔生物科技有限公司,贝伐单抗注射液购于国药集团有限公司。主要仪器为美国GE公司的Signa 1.5 T MR扫描仪及AW4.5后处理工作站。
将细胞株培养成1×106个/ml密度的细胞悬液并按0.2 ml/只的量接种于裸鼠腹侧右后肢皮下。在无特定病原体级环境中饲养至瘤径约8 mm建立裸鼠结肠癌皮下移植瘤模型并开始实验。
筛选出43只成功建模的裸鼠进行分组。成像方面,治疗组和对照组各8只,最后一次成像结束后处死作为15 d时间点的病理结果,剩余35只分为病理组,其中3只作为两组共同的基态病理,于第3、6、9、12天分别取3只裸鼠肿瘤作为两组的平行病理对照。
采用间断腹腔注射方式给药,给药时间点均为第1、4、7、10、13天。治疗组选用贝伐单抗注射液,给药剂量为5 mg/kg,对照组选用同等剂量的生理盐水。
治疗组及对照组共16只裸鼠分别于第0、3、6、9、12、15天进行MR成像,扫描前使用1%戊巴比妥钠腹腔麻醉实验动物,采用美国GE公司的Signa 1.5 T MR扫描仪进行成像,小动物线圈,头先进,仰卧位,将移植瘤的中心定位于线圈及磁体的中心。使用快速自旋回波序列获得T1加权图像(T1WI)和T2WI。T1WI参数如下:重复时间(TR)/回波时间(TE)540 ms/14.7 ms,层厚/层间距2.0 mm/0.2 mm,扫描视野(FOV)5cm×5 cm,矩阵192×160;T2WI:TR/TE 2 140 ms/82.3 ms,层厚/层间距2.0 mm/0.2 mm,FOV 5 cm×5 cm,矩阵为256×192;BOLD-MRI参数:TR 160 ms,TE 3.4~92.1 ms(共16个TE:3.4、9.3、15.2、21.2、27.1、33.0、38.9、44.8、50.7、56.6、62.5、68.5、74.4、80.3、86.2、92.1 ms),层厚/层间距2.0 mm/0.2 mm,FOV 8.0 cm×6.4 cm,矩阵192×128;DCE-MRI参数,TR/TE 40 ms/2.4ms,矩阵为128×96,层厚/层间距2.0 mm/0.2 mm,矩阵为128×96,FOV 7.0 cm×5.6 cm。通过尾静脉留置针注射马根维显,注射剂量为0.1 mmol/kg,注射后用0.9%生理盐水0.3 ml冲管。
原始数据传输至GE AW4.5工作站处理,BOLD数据通过Functool软件包下的R2Star后处理程序获得横向弛豫率(R2*)伪彩图。DCE-MRI采用cine tool软件的双室药物动力学模型,处理后得到容积转移常数(Ktrans)、血管外细胞外间隙容积比(Ve)、速率常数(Kep)及团注对比剂后首过180 s的浓度时间曲线下面积(AUC180)。感兴趣区的选择参照常规T1WI及T2WI图像,勾画肿瘤最大层面面积的80%以上,不同时间点感兴趣区的选择层面及位置尽量保持相同。
用游标卡尺于第0、3、6、9、12、15天测量肿瘤的短径(a)和长径(b),肿瘤体积=a2×b×0.5(mm3)。
每个肿瘤标本进行常规的HE染色及免疫病理染色,荧光染色包括α-SMA与CD31双染及上皮-间质转化标记物纤维连接蛋白单染,HIF-1α采用免疫组化方法染色,其中α-SMA是肿瘤新生血管周细胞的标记物,与血管成熟度有关,纤维连接蛋白是上皮间质转化标志物,HIF-1α能表征肿瘤乏氧程度。图像定量分析选用Image-Pro Plus 6.0软件计算各个指标阳性染色区域的累积光密度(IOD)比率=阳性部分IOD/(阳性部分IOD+阴性部分IOD)×100%,结果以百分率表示。血管成熟度(VMI)=α-SMA累积光密度值/CD31累积光密度值×100%[3]。
选用SPSS 13.0统计软件对所得数据进行统计学分析,采用GraphPad Prism 6.0进行统计图的绘制。定量资料以 ±s表示,利用Kolmogorov-Smirnov法进行正态性检验,各时间点的Ktrans、Kep、Ve、AUC180、R2*值及CD31、HIF-1α、VMI百分数及肿瘤体积采用单因素方差分析。组间比较采用两独立样本t检验。选用15 d的MR指标及病理指标进行Pearson相关分析。P<0.05为差异有统计学意义。
±s表示,利用Kolmogorov-Smirnov法进行正态性检验,各时间点的Ktrans、Kep、Ve、AUC180、R2*值及CD31、HIF-1α、VMI百分数及肿瘤体积采用单因素方差分析。组间比较采用两独立样本t检验。选用15 d的MR指标及病理指标进行Pearson相关分析。P<0.05为差异有统计学意义。
抗血管治疗期间裸鼠未见明显的异常反应及死亡等情况,抗血管治疗15 d后肿瘤的平均体积669~756(712±43)mm3,对照组平均体积为939~1 164(1 051±112)mm3,治疗组的肿瘤体积较对照组明显缩小,差异有统计学意义(t=7.969, P<0.01)(图1,表1)。

治疗组和对照组各时间点的磁共振指标及病理参数值( ±s)
±s)
治疗组和对照组各时间点的磁共振指标及病理参数值( ±s)
±s)
| 组别 | 0 d | 3 d | 6 d | 9 d | 12 d | 15 d | F值 | P值 | |
|---|---|---|---|---|---|---|---|---|---|
| 治疗组(n=8) | |||||||||
| R2*(/s) | 24.813±0.961 | 24.675±1.070 | 21.425±1.371 | 17.850±0.885 | 24.613±0.640 | 27.013±0.734 | 89.323 | 0.001 | |
| Ktrans(/min) | 0.135±0.005 | 0.147±0.006 | 0.175±0.009 | 0.161±0.006 | 0.140±0.005 | 0.116±0.008 | 81.386 | 0.001 | |
| Ve | 0.652±0.006 | 0.559±0.026 | 0.466±0.016 | 0.286±0.027 | 0.363±0.020 | 0.246±0.033 | 384.290 | 0.001 | |
| Kep(/min) | 0.788±0.030 | 0.804±0.036 | 0.983±0.059 | 1.105±0.091 | 0.840±0.047 | 0.786±0.041 | 45.901 | 0.001 | |
| AUC180 | 0.823±0.043 | 0.907±0.052 | 1.125±0.130 | 1.128±0.163 | 0.887±0.061 | 0.731±0.040 | 23.514 | 0.001 | |
| CD31(%) | 36.7±5.1 | 50.5±01.7 | 56.7±4.8 | 45.8±2.0 | 32.1±6.4 | 29.8±5.9 | 17.945 | 0.001 | |
| 血管成熟度(%) | 55.6±2.0 | 55.7±1.7 | 65.3±2.8 | 81.5±6.8 | 65.9±2.8 | 52.1±2.6 | 39.867 | 0.001 | |
| HIF-1α(%) | 43.1±2.9 | 51.6±5.1 | 41.4±1.2 | 30.4±4.2 | 31.9±4.0 | 50.0±3.1 | 24.356 | 0.001 | |
| 纤维连接蛋白(%) | 21.3±4.5 | 31.4±3.2 | 43.6±1.4 | 49.6±0.9 | 61.4±3.6 | 59.6±3.4 | 91.069 | 0.001 | |
| 肿瘤体积(mm3) | 230±23 | 277±32 | 301±30 | 360±46 | 478±48 | 712±43 | 174.648 | 0.001 | |
| 对照组(n=8) | |||||||||
| R2*(/s) | 25.388±1.122 | 26.075±1.036 | 25.088±0.779 | 24.700±1.218 | 24.513±1.745 | 24.375±1.537 | 1.981 | 0.101 | |
| Ktrans(/min) | 0.138±0.005 | 0.147±0.008 | 0.142±0.009 | 0.145±0.011 | 0.146±0.012 | 0.145±0.015 | 0.770 | 0.576 | |
| Ve | 0.587±0.083 | 0.610±0.059 | 0.578±0.047 | 0.614±0.042 | 0.619±0.058 | 0.603±0.070 | 0.559 | 0.731 | |
| Kep(/min) | 0.754±0.034 | 0.739±0.069 | 0.770±0.029 | 0.764±0.040 | 0.749±0.045 | 0.749±0.045 | 0.517 | 0.762 | |
| AUC180 | 0.785±0.032 | 0.778±0.040 | 0.766±0.030 | 0.752±0.036 | 0.770±0.057 | 0.779±0.046 | 0.654 | 0.660 | |
| CD31(%) | 38.2±3.8 | 36.4±1.3 | 40.6±1.7 | 42.6±0.8 | 38.1±3.4 | 40.7±2.9 | 2.350 | 0.085 | |
| 血管成熟度(%) | 54.2±1.6 | 47.8±1.2 | 53.2±4.4 | 47.8±4.9 | 50.7±3.1 | 48.0±3.3 | 2.646 | 0.060 | |
| HIF-1α(%) | 39.3±5.6 | 38.4±2.6 | 40.6±2.6 | 40.6±2.8 | 43.9±2.3 | 39.7±3.5 | 0.937 | 0.482 | |
| 纤维连接蛋白(%) | 24.6±01.3 | 22.4±4.2 | 20.1±2.7 | 19.2±1.4 | 18.2±0.4 | 20.6±2.6 | 2.586 | 0.065 | |
| 肿瘤体积(mm3) | 225±24 | 373±20 | 468±52 | 624±54 | 868±67 | 1 051±112 | 195.697 | 0.001 | |
注:R2*值:横向弛豫率,Ktrans:容积转运常数,Ve:血管外细胞外间隙,Kep:速率常数,AUC180:团注对比剂后首过180 s的浓度时间曲线下面积
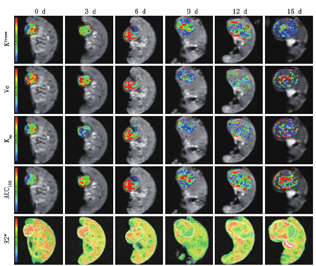
磁共振参数值及趋势图见表1及图1。治疗组裸鼠在常规T1WI上9 d前均未见明显的信号改变,12及15 d瘤体中心可见小片状的高信号影,意味着瘤体出血,T2WI上在第3天开始即出现数量不等的斑片状高信号影,表示为肿瘤坏死、液化改变。对照组在T2WI上亦出现高低混杂的信号影,但未及治疗组明显。治疗组各时间点Ktrans、Kep、Ve、AUC180及R2*值伪彩图见图2。Ktrans值在给药后逐渐升高,直至6 d后出现下降趋势,15 d达到最低值,差异有统计学意义(F=81.386,P<0.01)。Ve值在0~9 d以不同的速度下降,在12 d出现短暂升高后于15 d再次下降,差异有统计学意义(F=384.290,P<0.01)。Kep值在给药后逐渐升高,直至9 d达到峰值,然后逐渐下降,回到基态水平,差异有统计学意义(F=45.901,P<0.01)。AUC180值在0~6 d期间逐渐升高,于9 d出现一个短暂的平台期后开始下降,差异有统计学意义(F=23.514,P< 0.01)。R2*值在0~9 d逐渐下降,于9 d达到谷值后逐渐上升,差异有统计学意义(F=89.323,P<0.01)。对照组各项指标差异无统计学意义(均P>0.05)。

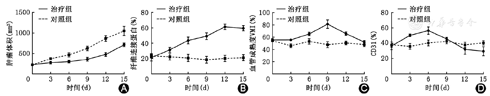
治疗组及对照组相关病理定量结果及趋势图见表1及图3。治疗组HE染色、α-SMA与CD31荧光双染、HIF-1α组化单染及纤维连接蛋白荧光单染切片分别见图4。HE染色显示给药后肿瘤出现数量不等的细胞坏死、凋亡改变,较对照组更为明显。治疗组的CD31染色率在给药后0~6 d仍然出现短暂的升高趋势,然后逐渐下降,直至15 d,差异有统计学意义(F=17.945,P<0.01)。VMI值在0~9 d逐渐上升,然后下降,差异有统计学意义(F=39.867,P<0.01)。上皮-间质转化标记物纤维连接蛋白染色率在给药后一直升高,12 d后达到平台期,差异有统计学意义(F=91.069,P<0.01)。HIF-1α染色率在给药后短暂升高,于3~9 d逐渐下降,于9~12 d短暂平台期后再次上升,差异有统计学意义(F=24.356,P<0.01)。对照组各指标时间点间差异无统计学意义(均P>0.05)。


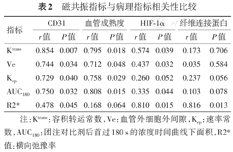
病理指标与磁共振指标各自具体的相关系数见表2。CD31阳性染色率、VMI值与Ktrans值的相关性最高(r值分别为0.854、0.795),AUC180值(r值分别为0.750、0.808)、Ve值(r值分别为0.744、0.712)及Kep值(r值分别为0.729、0.758,均P<0.05)亦显示出中度至良好的正相关关系。R2*值则与HIF-1α、纤维连接蛋白阳性染色率相关性最高(r值分别为0.810、0.816,均P<0.05)。
磁共振指标与病理指标相关性比较
磁共振指标与病理指标相关性比较
| 指标 | CD31 | 血管成熟度 | HIF-1α | 纤维连接蛋白 | ||||
|---|---|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| Ktrans | 0.854 | 0.007 | 0.795 | 0.018 | 0.574 | 0.039 | 0.173 | 0.706 |
| Ve | 0.744 | 0.034 | 0.712 | 0.048 | 0.437 | 0.032 | 0.035 | 0.584 |
| Kep | 0.729 | 0.040 | 0.758 | 0.029 | 0.260 | 0.052 | 0.237 | 0.056 |
| AUC180 | 0.750 | 0.032 | 0.808 | 0.015 | 0.335 | 0.044 | 0.103 | 0.078 |
| R2* | 0.478 | 0.045 | 0.168 | 0.064 | 0.810 | 0.015 | 0.816 | 0.013 |
注:Ktrans:容积转运常数,Ve:血管外细胞外间隙,Kep:速率常数,AUC180:团注对比剂后首过180 s的浓度时间曲线下面积,R2*值:横向弛豫率
Ktrans值大小与微循环灌注量及微血管通透性有关[4,5]。既往研究显示血管抑制剂可以促进肿瘤血管的周细胞增生及基底膜的修复,改善新生微血管的高渗漏状态,促进血管成熟及功能正常化[6,7],血管正常化可以起到修复血管的作用,使有效灌注的血管数量增多,血流量上升[8],因此Ktrans值上升。随后Ktrans值下降,推测可能是血管正常化现象的消退及血管抑制作用的显现共同作用的结果。本研究Ktrans值与CD31阳性染色率、VMI值较Kep、Ve、AUC180值显示出更强的相关性,变化趋势较为一致,能较好反映肿瘤血管密度及成熟度的情况。
对缺氧的检测及改善微环境缺氧是抗肿瘤治疗的重要组成部分。本研究利用BOLD-MRI评估血管抑制剂治疗后肿瘤微环境的氧供情况,发现R2*值在治疗后先降后升。R2*值在用药后出现下降主要因为贝伐单抗的微血管修复作用而进入血管正常化时间窗内,使微循环灌注短暂提升,乏氧状态改善。后期由于血管抑制作用导致R2*值回升[9,10]。在缺氧的微环境下,HIF-1α可以积累并诱导肿瘤细胞的上皮-间质转化,下调纤维连接蛋白的表达,获得较高的侵袭与转移能力。本研究利用贝伐单抗的血管正常化现象短暂改善了局部的微循环灌注及缺氧情况,抑制了上皮间质转化的作用,纤维连接蛋白合成增加,细胞间黏附力增强,限制细胞移动[11]。R2*值与纤维连接蛋白阳性染色率呈良好的正相关关系,提示R2*值可以用来评估血管正常化期间肿瘤侵袭性改变。
所有作者均声明不存在利益冲突



























