
探讨Ki67和异柠檬酸脱氢酶(IDH)在老年(年龄≥65岁)胶质母细胞瘤(GBM)中的表达以及性别、卡氏(KPS)评分、切除程度和放化疗等临床因素与老年GBM患者预后之间的潜在关系。
对象为郑州大学第一附属医院2013至2018年间收治的老年GBM患者,共54例。采用链霉卵白素-过氧化物酶法(SP)检测Ki67表达情况,采用Sanger测序的方法检测IDH突变情况。最终进行统计学分析以确定Ki67指数、IDH突变、性别、KPS评分、切除程度以及放化疗是否与患者的临床预后具有相关性。
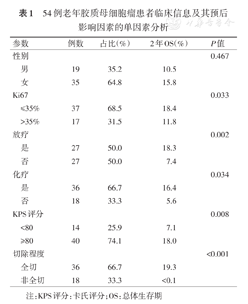
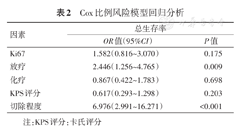
54例老年GBM患者均没有检测到IDH突变。单因素分析表明,Ki67指数(P=0.033)、KPS评分(P=0.008)和切除程度(P<0.001)是与老年GBM患者预后相关的影响因素之一。术后是否进行辅助放化疗与患者的预后具有明显相关性,进行放疗(P=0.002)和化疗(P=0.034)的患者具有更长的生存期。而性别(P=0.467)与本组患者的预后没有明显相关性。多因素分析表明,放疗(OR值2.446,P=0.009)及切除程度(OR值6.976,P<0.001)是老年GBM患者预后的独立预测因子。
IDH突变在老年GBM中确实罕见,提示老年GBM患者往往具有预后不良的分子病理学表型。Ki67、KPS评分、切除程度和放化疗是影响患者预后的因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多形性胶质母细胞瘤(GBM)是一组最具侵袭性和挑战性的中枢神经系统恶性肿瘤[1],中位生存期只有14个月[2]。近年来,随着人口老龄化程度不断加深,老年人群中枢神经系统肿瘤检出率逐年提高[3]。然而,研究显示,老年弥漫性浸润性胶质瘤患者中绝大多数具有预后不良的增殖表现和分子表型[4]。此外,在常规诊断、大型多中心研究以及临床终点判断中,准确和标准化的Ki67评分至关重要[5]。重视老年GBM患者这一群体,可能将有利于提高GBM患者整体的治疗效果。本研究旨在通过回顾性分析探讨Ki67、IDH突变以及性别、卡氏(KPS)评分、切除程度和放化疗等因素与老年GBM患者预后之间的潜在关系。
回顾性分析郑州大学第一附属医院神经外科2013至2018年间收治并进行手术治疗的老年GBM患者。入组标准:(1)患者年龄均≥65岁;(2)仅包括病理学诊断确诊的世界卫生组织(WHO)定义的Ⅳ级胶质瘤(胶质母细胞瘤);(3)只进行穿刺活体组织检查或者接受过二次切除手术的患者不予纳入。以上所有入组患者均为首次发现患病,并经过手术治疗、病理学确诊,手术前均未行化疗、放疗等。本研究经过郑州大学第一附属医院伦理委员会批准(伦理号:2019-KY-176),入组患者均事先签署知情同意书。
通过郑州大学第一附属医院嘉禾电子病历系统收集患者的临床和病理学相关资料,包括性别、年龄、KPS评分、肿瘤切除程度、是否放化疗、病理诊断结果及增殖标志物表达信息等。患者随访资料均以门诊复查、电话问询或查阅病历形式获得,每3个月通过电话、门诊进行随访1次,死亡为随访终点。总体生存期(OS)为手术当日至患者死亡的时间段。
肿瘤组织标本经过10%甲醛溶液固定石蜡包埋后进行苏木精-伊红(H&E)染色,病理学结果经过郑州大学第一附属医院病理科两位经验丰富的病理医生确认,如有意见相左者,通过进一步免疫组化确定。采用5 μm肿瘤组织石蜡切片,使用二甲苯、梯度浓度乙醇和磷酸缓冲盐溶液(PBS)进行常规脱蜡和水化,加入抗原修复液后经过加热、冷却修复抗原,用3%双氧水、PBS缓冲液和羊血清封闭内源性过氧化物酶和非特异性蛋白,经过一抗[增殖细胞核抗原(PCNA)1∶100,Ki67 1∶50,4 ℃过夜]和二抗(PCNA 1∶200,Ki67 1∶100,37 ℃恒温30 min)孵育后进行二氨基联苯胺(DAB)显色,经苏木素染液复染,脱水后封片。
样本采集以肿瘤细胞比例>20%为宜,用聚合酶链式反应(PCR)反应液、虾碱性磷酸酶(SAP)扩增,在八连排PCR管中经加液、振荡、避光静置、溶解及电泳进行测序产物纯化,测序仪测序后用chromas软件进行检测结果分析。
首先在低倍显微镜下观察免疫反应组织标本,以确定免疫标记肿瘤细胞核密度最高的区域。在使用网状系统对该区域进行系统取样并手动计数后,用标记核的阳性百分比报告Ki67免疫组化结果。
采用SPSS 21.0软件。X-tile用于计算最佳分界点,应用Kaplan-Meier方法绘制生存曲线,判断性别、Ki67、放疗、化疗、KPS评分和切除程度是否与老年GBM患者的临床预后具有相关性。应用Cox比例风险模型进行多因素分析,探究上述因素是否是老年胶质母细胞瘤患者预后的独立影响因素。以P<0.05为差异有统计学意义。
共54例老年GBM患者纳入本研究,其中男19例,女35例,男:女=0.54∶1,年龄65~78(68.5±3.8)岁。随访时间0.5~36.0个月,中位随访时间10.65(12.5±8.4)个月。通过X-tile软件计算得出Ki67的分界值为35%,其中Ki67指数≤35% 37例,>35% 17例。所有患者中均未检测到IDH1基因R132位点突变及IDH2基因R172位点突变。
肿瘤全切36例,非全切18例,切除程度≥95%定义为全切除,<95%定义为非全切[6]。术后行放疗27例,未放疗27例。术后行化疗36例,化疗方案均为替莫唑胺口服4~6个疗程,未化疗18例。其中24例同时接受了放疗和化疗,具体方案为同步放化疗42 d,给予替莫唑胺75 mg/m2,间歇4周后给予150~200 mg/m2辅助化疗4~6周。仅接受化疗的12例患者,按150~200 mg/m2辅助化疗4~6周。术后KPS评分<80分14例,≥80分共40例。随访期内共46例复发,48例死亡。
54例老年胶质母细胞瘤患者临床信息及其预后影响因素的单因素分析
54例老年胶质母细胞瘤患者临床信息及其预后影响因素的单因素分析
| 参数 | 例数 | 占比(%) | 2年OS(%) | P值 | |
|---|---|---|---|---|---|
| 性别 | 0.467 | ||||
| 男 | 19 | 35.2 | 10.5 | ||
| 女 | 35 | 64.8 | 15.8 | ||
| Ki67 | 0.033 | ||||
| ≤35% | 37 | 68.5 | 18.4 | ||
| >35% | 17 | 31.5 | 11.8 | ||
| 放疗 | 0.002 | ||||
| 是 | 27 | 50.0 | 18.3 | ||
| 否 | 27 | 50.0 | 7.4 | ||
| 化疗 | 0.034 | ||||
| 是 | 36 | 66.7 | 16.4 | ||
| 否 | 18 | 33.3 | 5.6 | ||
| KPS评分 | 0.008 | ||||
| <80 | 14 | 25.9 | 7.1 | ||
| ≥80 | 40 | 74.1 | 18.0 | ||
| 切除程度 | <0.001 | ||||
| 全切 | 36 | 66.7 | 19.3 | ||
| 非全切 | 18 | 33.3 | <0.1 | ||
注:KPS评分:卡氏评分;OS:总体生存期
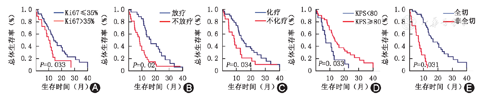
Ki67指数≤35%的亚组2年OS为18.4%,>35%亚组为11.8%。Ki67指数对患者2年OS有显著影响,P=0.033,图1A。是否放疗(P=0.002,图1B)、是否化疗(P=0.034,图1C)、KPS评分(P=0.008,图1D)和切除程度(P<0.001,图1E)对患者预后均有显著影响。术后进行辅助放化疗、KPS评分更高、接受肿瘤全切的患者预后更好。而性别(P=0.467)对患者生存预后无显著影响。

通过Cox比例风险模型进行多因素分析,结果显示,放疗(P=0.009)及切除程度(P<0.001)是预后的独立预测因子(表2)。
Cox比例风险模型回归分析
Cox比例风险模型回归分析
| 因素 | 总生存率 | |
|---|---|---|
| OR值(95%CI) | P值 | |
| Ki67 | 1.582(0.816~3.070) | 0.175 |
| 放疗 | 2.446(1.256~4.765) | 0.009 |
| 化疗 | 0.867(0.422~1.783) | 0.698 |
| KPS评分 | 0.617(0.293~1.298) | 0.203 |
| 切除程度 | 6.976(2.991~16.271) | <0.001 |
注:KPS评分:卡氏评分
胶质瘤是一组不同类型的神经上皮组织肿瘤,是中枢神经系统最常见的恶性肿瘤[7],而GBM是其中一种高度异质性的肿瘤,约占所有胶质瘤的50%[8],是成年人最常见的致命性脑内肿瘤。
迄今为止,已经有数百种抗体和抗原被认为是神经胶质瘤的潜在诊断标志物,但只有少数被证明是可靠的,其中最重要的标志物之一是为冰冻和石蜡切片建立的用于评估细胞增殖活性的Ki67抗原[9]。然而,Ki67在老年GBM患者预后中发挥的作用还没有得到充分的研究。因此本研究选取54例老年GBM患者,通过免疫组化染色和统计学分析试图揭示这种关系,同时纳入IDH突变、性别、KPS评分、切除程度和放化疗等参数,为老年GBM患者的临床诊断和预后判断提供有效的证据和支持。
Ki67是应用最为广泛的增殖标志物之一[10]。Ki67增殖指数是一种核增殖率,定义为Ki67阳性细胞占计数细胞总数的百分比。Ki67增殖指数与肿瘤的分化程度、浸润或转移及预后有密切关系,是判断肿瘤预后的重要参考指标之一(Ⅰ级证据)。已有研究证明,Ki67增殖指数是低级别胶质瘤患者特异性生存率的1个有效预测因子[11]。此外,Ki67指数在多种肿瘤的临床进展和预后判断中扮演了重要角色。Ki67作为可靠预后标志物的潜力已经在肺癌、前列腺癌和中枢神经系统癌症中有所显现[12]。在乳腺癌中以核抗原Ki67细胞染色比例为主的免疫组化检查结果的评估,已成为比较肿瘤样本间增殖情况使用最为广泛的方法[13]。此外,Ki67的表达率与宫颈病变的严重程度直接相关[14]。本研究显示Ki67指数与患者的总体生存率明显相关。
如今,分子病理学的发展为胶质瘤精准治疗提供了最佳的分层依据。IDH1及IDH2基因突变等对确定胶质瘤分子亚型、个体化治疗及临床预后判断也具有重要意义[15]。并且发现IDH1突变多发生于胶质瘤发病的早期,其在胶质瘤发病机理过程中起到重要作用。IDH1突变型的预后明显好于野生型[15]。IDH1基因第132位点的杂合突变可出现在80%以上的低级别胶质瘤中,75%继发性GBM可见,而原发性GBM少见,仅有5%[16]。本组老年GBM患者IDH1和IDH2均无突变。刘竞辉等[17]的研究显示,老年GBM这一亚组患者均无IDH1突变,与本研究结果一致。这提示IDH无突变是老年GBM患者预后不利的分子表型之一。
研究发现辅助化疗对于高级别胶质瘤患者的预后是有益的。还有研究证实,术后常规放疗加调强放射治疗辅助化疗治疗高级别胶质瘤能够取得较好的近期疗效,不良反应可耐受,而替莫唑胺化疗与患者预后无关。陈子阳等[18]的研究则表明,术前KPS评分、手术切除程度及是否进行标准放化疗是影响老年GBM患者预后的独立危险因素。
尽管执行了严格的入组标准,进行了严密的统计学分析,本研究仍然存在一定的局限性,如是回顾性分析,病例数较小。关于Ki67对老年GBM患者预后产生影响的具体机制仍有待进一步研究。IDH突变罕见这一分子特征仍需要大样本的研究总结。
所有作者均声明不存在利益冲突



























