
评价球囊肺动脉成形术(BPA)治疗慢性血栓栓塞性肺动脉高压(CTEPH)的效果和安全性。
连续入选2018年2月至2019年9月在中日友好医院呼吸中心住院的CTEPH患者,所有患者经多学科讨论确定无法行肺动脉血栓内膜剥脱术(PEA),具有BPA手术指征。BPA术前评估6 min步行距离(6MWD)、检测血N-末端脑钠肽前体(NT-proBNP)水平,行右心导管检查获得混合静脉血氧饱和度、平均肺动脉压(mPAP)、心指数和肺血管阻力(PVR),将BPA治疗前与最后一次BPA时各项参数进行对比分析。
行BPA治疗的CTEPH患者25例,共行67例次BPA治疗,其中男10例(40.0%),女15例(60.0%),年龄(57.8±7.1)岁,诊断CTEPH到BPA治疗间隔时间20.0(9.0,48.5)个月,共治疗肺动脉302支,18例患者BPA≥2次,术后随访时间5.0(3.5,8.3)个月,术后6MWD、心指数、混合静脉血氧饱和度均显著改善[(425±74)比(345±109)m、(1.99±0.45)比(1.62±0.35)L·min-1·m-2、(68.1±6.5)%比(61.2±6.3)%](均P<0.05),术后血浆NT-proBNP、mPAP、PVR均显著低于术前[259(93,739)比806(148,2 159)ng/L、(40.6±8.3)比(47.3±10.7)mmHg(1 mmHg=0.133 kPa)、(11.9±4.9)比(17.2±6.5)WU(1 WU=80 dyn·s·cm-5)](均P<0.05)。咯血5例次(7.5%),再灌注肺水肿(RPE)2例次(1.5%);1例因RPE需无创呼吸机治疗,1例围手术期因咯血加重右心衰竭导致死亡。
BPA能显著改善不能行PEA的CTEPH患者的运动耐量和血流动力学参数,手术并发症发生率较低,安全有效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性血栓栓塞性肺动脉高压(CTEPH)是机化的血栓阻塞肺动脉,导致肺血管阻力(PVR)进行性升高,肺动脉高压和右心功能衰竭为特征的疾病,是急性肺血栓栓塞症的严重远期并发症[1],肺动脉血栓内膜剥脱术(PEA)是CTEPH最有效的治疗方法,但约37%的CTEPH患者由于血栓位置偏远、并发症等原因无法行PEA治疗,约16%的CTEPH患者PEA术后有残余肺动脉高压[2],严重影响患者生活质量和生存时间。
球囊肺动脉成形术(BPA)是近年发展的经皮肺动脉介入治疗技术,2001年美国学者Feinstein等[3]首次报道了BPA治疗不能行PEA的CTEPH患者的临床疗效,由于并发症未能广泛应用。日本学者采用改良的小球囊BPA技术结合血管内影像技术明显降低了再灌注肺水肿(RPE)和血管损伤的发生率[4,5,6,7],为不能行PEA的CTEPH患者带来新的治疗希望,近年我国部分中心已开展BPA,提升了CTEPH的临床诊治能力。本研究旨在评价改良小球囊BPA技术治疗CTEPH的效果和安全性。
连续入选2018年2月至2019年9月在中日友好医院呼吸中心住院的CTEPH患者:所有患者经过至少3个月规范抗凝治疗,CT肺动脉造影、肺通气/灌注显像或肺动脉造影证实存在慢性血栓,右心导管检查平均肺动脉压(mPAP)≥25 mmHg(1 mmHg=0.133 kPa),临床除外血管炎、肺动脉肿瘤等疾病。经多学科讨论(包括呼吸与危重症医生、肺动脉高压医生、PEA外科医生、影像和核医学医生、BPA介入医生)无法行PEA,具有BPA手术指征,充分告知患者手术风险和获益并签署手术知情同意书。
首次BPA术前评估包括6 min步行距离(6MWD)、血浆N-末端脑钠肽前体(NT-proBNP)和右心导管检查,测量右心房压、右心室压、肺动脉压和肺动脉楔压,采用Fick法获得心排量,测量肺动脉血气分析获得混合静脉血氧饱和度。
通过股静脉置入70~90 cm 8F COOK血管鞘(美国库克公司)或80 cm 8F Arrow Super Flex血管鞘(美国Arrow公司),给予普通肝素50 U/kg,完成血流动力学测量,通过鞘管送入6F JR4.0、JL3.5、AL1.0或MPA1.0指引导管(美国强生公司)到达靶血管行选择性肺动脉造影,优先治疗环状狭窄、网状病变和次全闭塞病变,送入直径0.014英寸Fielder XTR/XT/XTA、Sion或Sion blue导丝(日本ASAHI公司)通过病变处,送入直径1.5~4.0 mm IKAZUCHI球囊扩张导管(日本钟化株式会社)或Empria球囊扩张导管(美国强生公司),4~14个大气压进行扩张,每次扩张时间6~30 s。当透视时间达到60 min或对比剂达到200 ml时停止手术,2~4周后行下一次BPA。
主要并发症为RPE和肺血管损伤。RPE主要表现为胸片或胸部CT上手术部位新出现的斑片样阴影,伴或不伴血氧饱和度下降或咳大量泡沫样痰;肺血管损伤主要表现为咯血。
采用SPSS 25.0统计软件,正态分布的连续变量采用 ±s表示,均值比较采用独立样本t检验;非正态分布的连续变量采用M(Q1,Q3)表示,采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
±s表示,均值比较采用独立样本t检验;非正态分布的连续变量采用M(Q1,Q3)表示,采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2018年2月至2019年9月共25例不能行PEA的CTEPH患者行BPA治疗,诊断CTEPH到BPA治疗间隔时间20.0(9.0,48.5)个月;患者基本情况见表1。

25例行BPA的CTEPH患者的术前基本情况
25例行BPA的CTEPH患者的术前基本情况
| 项目 | 结果 | |
|---|---|---|
| 性别[例(%),男/女] | 10(40.0)/15(60.0) | |
年龄(岁, ±s) ±s) | 57.8±7.1 | |
体质指数(kg/m2, ±s) ±s) | 23.8±2.8 | |
| 确诊至BPA间隔时间[月,M(Q1,Q3)] | 20.0(9.0,48.5) | |
| 靶向药物治疗情况[例(%)] | ||
| 未使用靶向药物 | 7(28.0) | |
| 利奥西呱 | 7(28.0) | |
| PDE5抑制剂 | 4(16.0) | |
| ERA | 4(16.0) | |
| PDE5抑制剂+ERA | 3(12.0) | |
| 血流动力学参数 | ||
| 右心房压[mmHg,M(Q1,Q3)] | 3.0(1.0,6.0) | |
mPAP(mmHg, ±s) ±s) | 44.0±10.5 | |
PVR(WU, ±s) ±s) | 13.5±6.3 | |
心指数(L·min-1·m-2, ±s) ±s) | 1.86±0.49 | |
注:BPA为球囊肺动脉成形术;CTEPH为慢性血栓栓塞性肺动脉高压;PDE5为磷酸二酯酶5;ERA为内皮素受体拮抗剂;mPAP为平均肺动脉压;PVR为肺血管阻力;1 mmHg=0.133 kPa,1 WU=80 dyn·s·cm-5
67例次BPA共治疗肺动脉302支,平均每次手术治疗肺动脉4.5支,其中18例患者BPA ≥2次,随访时间5.0(3.5,8.3)个月,术后6MWD、心指数、混合静脉血氧饱和度较术前明显改善,血浆NT-proBNP水平、mPAP和PVR较术前明显下降,术后血清肌酐水平与术前比较未见明显差异(表2)。
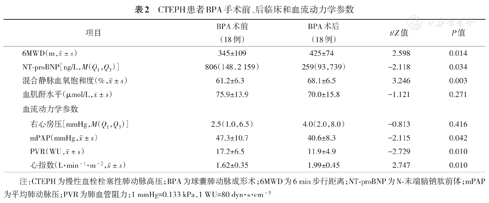
CTEPH患者BPA手术前、后临床和血流动力学参数
CTEPH患者BPA手术前、后临床和血流动力学参数
| 项目 | BPA术前(18例) | BPA术后(18例) | t/Z值 | P值 | |
|---|---|---|---|---|---|
6MWD(m, ±s) ±s) | 345±109 | 425±74 | 2.598 | 0.014 | |
| NT-proBNP[ng/L,M(Q1,Q3)] | 806(148,2 159) | 259(93,739) | -2.118 | 0.034 | |
混合静脉血氧饱和度(%, ±s) ±s) | 61.2±6.3 | 68.1±6.5 | 3.246 | 0.003 | |
血肌酐水平(μmol/L, ±s) ±s) | 75.9±13.9 | 70.0±15.8 | -1.121 | 0.271 | |
| 血流动力学参数 | |||||
| 右心房压[mmHg,M(Q1,Q3)] | 2.5(1.0,6.5) | 4.0(2.0,8.0) | -0.813 | 0.416 | |
mPAP(mmHg, ±s) ±s) | 47.3±10.7 | 40.6±8.3 | -2.115 | 0.042 | |
PVR(WU, ±s) ±s) | 17.2±6.5 | 11.9±4.9 | -2.729 | 0.010 | |
心指数(L·min-1·m-2, ±s) ±s) | 1.62±0.35 | 1.99±0.45 | 2.747 | 0.010 | |
注:CTEPH为慢性血栓栓塞性肺动脉高压;BPA为球囊肺动脉成形术;6MWD为6 min步行距离;NT-proBNP为N-末端脑钠肽前体;mPAP为平均肺动脉压;PVR为肺血管阻力;1 mmHg=0.133 kPa,1 WU=80 dyn·s·cm-5
咯血共5例次(7.5%),RPE共2例次(1.5%);1例因RPE需无创呼吸机治疗,1例因咯血加重右心衰竭死亡,余并发症均可自行缓解或经对症治疗后缓解。
BPA是近年迅速发展的肺动脉介入治疗技术,2001年Feinstein等[3]首次报道BPA治疗CTEPH,由于并发症未能广泛应用,2012年日本学者开始改良BPA,采用小球囊开始对病变肺动脉进行分次逐级扩张方法,显著提高了手术安全性。国外多个中心报道BPA能显著降低CTEPH患者血浆NT-proBNP水平、mPAP和PVR,增加6MWD,改善心指数[8,9,10,11,12],最近一项荟萃分析纳入了全球13项BPA研究,结果也证实了BPA的治疗效果[13]。国内北京阜外医院报道了21例CTEPH患者术后6MWD平均增加46 m,mPAP较术前明显下降[14]。本中心自2018年2月开展BPA治疗,适应证包括:CT肺动脉造影显示血栓位于段或亚段肺动脉的CTEPH患者,PEA术后残余肺动脉高压或高龄(>75岁)不能耐受PEA的CTEPH患者也可行BPA治疗,本中心研究数据显示BPA能显著改善不能行PEA的CETPH患者的运动耐量和血流动力学参数,术后血流动力学改善与德国、早期法国的数据相似,低于欧洲和日本,6MWD增加与日本和欧洲相似,高于德国和法国[8,9,10,11,12]。本中心的CTEPH患者术前平均PVR明显高于国外患者,6MWD较低,提示本中心患者病情较重,从诊断CTEPH到首次BPA治疗间隔时间较德国更长。术后血流动力学参数改善幅度偏低可能与本中心患者病情较重、病史较长和手术经验受限有关。
本中心BPA相关肺血管损伤、RPE发生率以及围手术期病死率与国外报导相似[8,9,10,11,12,13]。BPA相关肺血管损伤包括导丝和球囊损伤,选择头端较软导丝、合理选择球囊大小以及提高手术操作技巧可降低BPA相关肺血管损伤的发生率[15],术中新发咳嗽、心率突然增加>20次/min、肺动脉压增高>10%或突发血氧饱和度下降>5%,即使未出现咯血,提示可能已经出现BPA相关肺血管损伤,需要暂停BPA操作密切观察5~10 min,如果患者未出现咯血并逐渐恢复,可继续治疗其他血管;如果咯血明显,造影明确出血部位后,可采用球囊导管封堵血管近端10~15 min止血,必要时可采用明胶海绵栓塞出血部位。国外研究显示mPAP和PVR越高,RPE发生率越高,也有研究显示RPE与术中肺动脉血流分级改善有关,采用改良小球囊BPA技术可减少RPE发生率[16]。术后心电监护出现血氧饱和度下降,治疗部位新出现湿啰音提示可能发生RPE,常于术后24 h内出现,可予吸氧,静注人血白蛋白、利尿剂对症治疗,血氧饱和度下降明显可应用无创呼吸机治疗。BPA长期预后报道较少,日本一项荟萃分析显示BPA治疗组2年病死率明显低于药物治疗组[17]。本中心临床发现经至少3个月肺动脉高压靶向药物治疗症状改善不明显患者经BPA治疗后临床症状仍可明显改善,提示BPA的潜在治疗优势。
本研究的局限性包括数据来源为单中心,病例数量偏少,早期手术经验受限和缺少长期随访数据。
综上所述,BPA能显著改善不能行PEA的CTEPH患者的运动耐量和血流动力学参数,采用改良BPA技术后围手术期并发症发生率较低,绝大多数并发症可自行缓解或经对症治疗后缓解,因此BPA是治疗不能行PEA的CTEPH患者的安全有效治疗方法。
天津医科大学总医院杨振文教授在BPA治疗中给予帮助
所有作者均声明不存在利益冲突



























