
研究CT引导下肺内注射吲哚菁绿(ICG)用于肺内小结节及磨玻璃影术前定位的有效性和安全性。
收集2018年10月到2019年7月连续入住北京胸科医院34例CT上表现为肺内小结节或磨玻璃结节疑诊为肺癌、行胸腔镜手术治疗的患者(39个结节),结节大小0.3~2.0(0.9±0.3)cm,其中实性结节6个,不纯磨玻璃结节9个,纯磨玻璃结节24个。术前在CT引导下向肺内注射ICG进行定位,记录患者的结节定位、手术及病理等信息。主要评价指标为定位成功率和并发症发生率。
20.6%(7/34)的患者出现轻微并发症,其中6例为少量气胸,1例为肺内出血,均无需特殊处理。无ICG相关不良反应。术中所有患者均可见荧光显影,2例患者ICG在胸腔内弥散,但在荧光最亮处仍然可以找到病灶。一处结节因直径过小(0.3 cm)未能在切除肺叶中找到,定位成功率为97.4%(38/39)。荧光持续时间可超过5 h。
CT引导下肺内注射ICG定位肺内小结节和磨玻璃结节是安全有效的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
如何准确定位肺内小结节和磨玻璃结节是胸腔镜手术的难点,本研究术前CT引导下肺内注射吲哚菁绿(ICG)定位肺内结节,术中在荧光胸腔镜下可以看到定位荧光,帮助术者顺利切除病变。现对34例患者的临床资料进行分析总结如下。
收集2018年10月至2019年7月连续入住北京胸科医院34例CT上表现为肺内小结节或磨玻璃结节疑诊为肺癌、行胸腔镜手术治疗的患者,共39个结节。男9例、女25例,平均年龄(57±12)岁。其中右肺上叶结节15个,右肺下叶7个,右肺中叶5个,左肺上叶8个,左肺下叶4个。实性结节6个,不纯磨玻璃结节9个,纯磨玻璃结节24个。病变直径0.3~2.0(0.9±0.3)cm。病变距最近处胸膜0.2~6.0 cm,中位值为1.2 cm。本研究为前瞻性队列研究,无对照组,研究经医院伦理委员会备案并批准,患者知情同意。
(1)拟行胸腔镜肺手术的患者。(2)薄层CT上,患者病变满足下列条件之一:①纯磨玻璃结节,②实性成分≤50%的非纯磨玻璃结节,③病变的实性成分与脏层胸膜距离≥1 cm,包括实性结节和磨玻璃结节。(3)患者同意参加本研究,并签署知情同意书和临床手术及CT引导下肺穿刺知情同意书。
(1)合并气胸、胸腔积液,无法行CT引导下肺穿刺者。(2)病灶位置被肋骨或肩胛骨遮挡,无穿刺进针路径者。(3)病灶周围有大血管,穿刺有可能损伤者。(4)病灶贴近胸膜,有胸膜牵拉征,术中可能直接看到者。
CT引导下肺穿刺套装为AGRON Medical Device,Inc(美国)生产的外径为17 G的同轴引导活检针(产品型号MCXS1815BP),包括两种长度:6.8和11.8 cm。定位荧光剂为卫材(辽宁)制药生产的注射用ICG(10 ml:25mg)。术中荧光胸腔镜为欧谱曼迪公司生产的荧光摄像系统(OPTO-CAM2000)。
手术当日早晨患者于CT室进行定位,在CT引导下将穿刺针穿入病灶处,通过穿刺针向肺内注射ICG。注射ICG时需注意:(1)抽取ICG需使用1 ml注射器,以免注射量过大,在胸腔内弥散。(2)将ICG尽量注入病灶内或深面,以减少ICG溢出。(3)原装ICG溶液不需稀释。(4)注射量为0.2~0.5 ml。
定位过程中记录开始时间、结束时间(以CT片子时间为准),扫描片子数,注射ICG位置,是否有气胸、肺内出血、疼痛等并发症。定位完毕患者进入手术室,进行胸腔镜手术。探查时将胸腔镜切换到荧光模式,当出现以下情况时认为定位有效:(1)周围型病变者,楔形一次性切除病灶,病灶在荧光范围内。(2)若病灶位置较深,直接行肺叶切除,切除肺叶后荧光未消失,在荧光引导下能很快找到病灶。主要评价指标为ICG定位有效性,即定位有效的结节数/总定位结节数×100%;并发症发生率。次要指标为操作简便性(以定位时长为准)、手术安排灵活性(以穿刺结束到手术开始时间间隔为准)、荧光持续时间等。
使用病理报告表采集每位患者一般资料、定位信息、术中情况、病理结果等信息,将所有信息录入Excel 2010,计算ICG定位的成功率和并发症发生率。
定位完毕行CT扫描时发现6例患者出现少量气胸,但患者无明显呼吸困难症状,有1例患者出现肺内血肿,但无明显咯血表现,因此均无特殊处理。所有患者无明显疼痛,口中无明显异味、无过敏反应,均自行走回病房。因此并发症发生率为20.6%(7/34),无严重并发症病例。
术中所有患者均可见荧光显像,前两例患者ICG注射量为0.5 ml,荧光在胸腔内弥散,但在肺表面荧光最亮处依然准确找到病变,其余32例ICG注射量0.2 ml,术中均表现为局灶荧光(图1)。1例患者因病变过小(0.3 cm),在荧光附近未找到明确病变,但这位患者有两处病变,均在右肺上叶,另一处病变定位满意,病理为腺癌,最终行右肺上叶切除术。定位有效率为97.4%(38/39)。9例患者因病变较深直接行肺叶切除术。25例患者病变位于外周,在荧光引导下首先行楔形切除术。
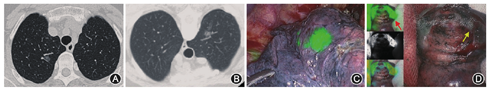

单病灶患者定位耗时17~40 min,平均(26.1±6.8)min。双病灶患者定位耗时33~38 min,平均(35.8±1.7)min。所有荧光在手术结束时均未消失,最短的手术时间为90 min,最长的为300 min。
术中有71.8%(28/39)的结节触诊阴性。术后病理2处结节为肺慢性炎症,3处为淋巴结增生,1处为硬化性肺泡细胞瘤,2处为不典型腺瘤样增生,1处为原位腺癌,9处为微浸润腺癌,20处为浸润性腺癌,术后分期最晚者为T1bN0M0,Ia2期。
胸腔镜术中,直接触诊肺内小结节或磨玻璃结节失败概率较高,因此,对这类病变进行定位很有必要,常用的定位方法有CT引导下在肺内留置定位物,如带钩钢丝,微线圈,亚甲兰,生物胶等。带钩钢丝操作简单,使用最广泛,但患者疼痛明显,气胸、肺内出血等并发症发生率高,表浅的病变容易脱位[1]。微线圈并发症少、定位效果好[2,3],但其操作略复杂、耗材价格较昂贵。生物胶可能淹没病灶、影响病理切片[4]。因此,上述定位方法均有一定局限性。ICG进入人体后与蛋白结合,荧光可以在局部维持较长时间,具有10 mm组织的穿透能力[5],因此比较适合作为定位材料。
本定位方法的关键在于控制好ICG注射剂量,前两例患者注射0.5 ml,结果荧光在胸腔内弥散,后将注射剂量减至0.2 ml后,术中表现为局灶荧光,定位效果最好。本研究中荧光可持续整个手术过程,因此对于接台手术可以提前进行ICG定位,在手术安排上具有一定灵活性。
文献报道CT引导下肺穿刺的总体并发症发生率为9%~54%,平均20%,以气胸、肺内出血等多见,需要外科处理的严重并发症发生率低于5%[6,7]。本研究中气胸和肺出血并发症率虽为20.6%,但均较轻微,无需特殊处理,无严重并发症。患者定位全程体验良好,无明显疼痛感,ICG注射后也无过敏反应。提示CT引导下注射ICG是安全的。
曾有文献报道术前静脉注射ICG,次日术中可见结节显示荧光[8],但这主要用于实性结节,对于磨玻璃结节显像效果并不明确。还有报道术中经气管在磁导航引导下向病灶附近喷射ICG和碘帕米醇混合液进行定位[9]。该方法操作复杂、需要额外设备和人力,临床应用有限。
所有作者均声明不存在利益冲突



























