
探讨应用临床因素预测直肠癌新辅助放化疗后病理完全缓解(pCR)的可行性。
回顾性分析2011年1月至2018年12月在中国人民解放军总医院行新辅助放化疗的162例直肠癌患者的临床资料,根据术后病理结果将患者分为pCR组和非pCR组,寻找对直肠癌新辅助放化疗后pCR具有预测意义的临床因素。
经新辅助放化疗后达到pCR者共28例(17.3%,28/162)。单因素分析显示,分化程度高的直肠癌(P=0.024)、肿瘤占据肠腔比例≤1/2(P=0.006)、较早的临床T分期(P=0.013)、较早的临床N分期(P=0.009)、新辅助放化疗结束至手术的时间间隔>49 d(P=0.006)、肿瘤最大直径≤5 cm(P=0.019)的患者更容易获得pCR,差异均有统计学意义。多因素分析显示,肿瘤占据肠腔比例≤1/2(P=0.01)、肿瘤最大直径≤5 cm(P=0.035)、新辅助放化疗结束至手术的时间间隔>49 d(P=0.009)是预测新辅助治疗后pCR的独立因素。
肿瘤占肠腔比例、肿瘤最大直径、新辅助放化疗结束至手术的时间间隔能预测直肠癌新辅助放化疗后pCR。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
直肠癌是一种常见的致死性疾病,其中40%为局部进展期直肠癌(locally advanced rectal cancer, LARC)。新辅助放化疗(neoadjuvant chemoradiother apy,nCRT)后进行直肠根治性手术已成为目前LARC的标准治疗方法。但是患者对于术前放化疗的敏感程度各不相同,20%左右的患者能达到病理完全缓解(pathologic complete response, pCR),其预后较好,甚至可以免除手术治疗。20%~40%的患者对nCRT不敏感,这部分患者不但无法从中受益,而且可能延误手术时机,增加远处转移的风险。目前还没有有效的方法和指标能准确预测患者对nCRT的敏感性。本研究旨在寻找能够预测直肠癌nCRT后pCR的临床因素。
回顾性分析2011年1月至2018年12月中国人民解放军总医院162例接受nCRT的直肠癌患者的临床资料。纳入标准:(1)经结肠镜活检病理学证实为直肠癌,MRI分期为T3-4bN0M0,或任何T、N1-2M0,所有患者nCRT后行根治性全直肠系膜切除术(total mesorectal excision, TME);(2)年龄18~80岁,性别不限;(3)中低位直肠癌:肠镜检查提示肿瘤下缘距肛门10 cm以内;(4)nCRT前未接受过任何抗肿瘤治疗;(5)无远处转移;(6)无严重内科疾病;(7)卡氏(Karnofsky,KPS)评分≥70分。排除标准:(1)未完成nCRT;(2)未行或外院行TME;(3)nCRT结束到手术的时间间隔>16周;(4)高位直肠癌,肿瘤下缘距肛门>10 cm;(5)因肿瘤出血、穿孔、梗阻等并发症行急诊手术;(6)未接受nCRT或单纯新辅助放疗或单纯新辅助化疗的患者;(7)家族性腺瘤性息肉病(familialadenomatouspo lyposis,FAP)、遗传性非息肉病性结直肠癌(Lynch综合征)等家族遗传性直肠癌病例;(8)放疗与化疗不同步者;(9)术前检查或术中探查发现转移灶。
性别、年龄、体质指数(BMI)、是否吸烟、有无糖尿病、有无高血压、是否贫血、病理类型、临床T分期、临床N分期、肿瘤距肛缘距离、肿瘤所占肠腔比例、肿瘤最大直径、放疗时间、放疗剂量、放化疗结束至手术的时间间隔、手术方式、nCRT前后血清肿瘤标志物水平,包括癌胚抗原(CEA)、甲胎蛋白(AFP)、糖链抗原125(CA125)、糖链抗原199(CA199)。
糖尿病:nCRT前有明确糖尿病病史或空腹血糖超过6.1 mmol/L;高血压:nCRT前有明确高血压病史或收缩压≥140 mmHg(1 mmHg=0.133 kPa),舒张压≥90 mmHg;吸烟史:每天吸烟≥1支,烟龄≥1年;贫血:nCRT前男性血红蛋白<120 g/L,女性血红蛋白<110 g/L;肿瘤距肛缘距离:通过直肠指检及肠镜评估,并选取其中的较小值;临床T、N分期:通过直肠MRI、直肠内镜超声、盆腔CT进行评估;肿瘤所占肠腔比例:以肠镜描述为准;肿瘤最大直径:以MRI检查和结直肠镜为准;nCRT前、后肿瘤标志物水平分别为患者nCRT开始前两周内以及nCRT结束后、手术前两周内的检测结果,患者均为空腹抽血。
研究终点为pCR。由2名经验丰富的病理医师对手术切除标本进行评估,pCR定义为肿瘤完全退缩,无镜下可见的肿瘤细胞。根据术后病理将患者分为pCR组和非pCR组。
所有患者采用常规分割放疗方法。给予CT定位,行三维适形或调强放疗计划,靶区为直肠病变及盆腔淋巴引流区。放疗总剂量为45~58.75 Gy,1.8~2.35 Gy/次,每周照射5次,共25次,同时配合口服卡培他滨片同步化疗。
数据分析使用SPSS 25.0,正态分布计量资料以 ±s表示,组间比较采用t检验进行分析;计数资料以率(%)表示,组间比较采用χ2检验或Fisher精确概率法进行分析。对临床因素先进行单因素分析,单因素分析中P<0.10的变量进行logistic回归分析,评价其与pCR的关系。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验进行分析;计数资料以率(%)表示,组间比较采用χ2检验或Fisher精确概率法进行分析。对临床因素先进行单因素分析,单因素分析中P<0.10的变量进行logistic回归分析,评价其与pCR的关系。P<0.05为差异有统计学意义。
共162例患者纳入本研究,其中男115例,女47例;年龄22~79岁,中位年龄56岁。其中50例患者行腹会阴联合直肠癌根治术,112例患者行直肠前切除术,保肛率69.1%(112/162)。术后pCR率17.3%(28/162),与文献报道一致[1]。
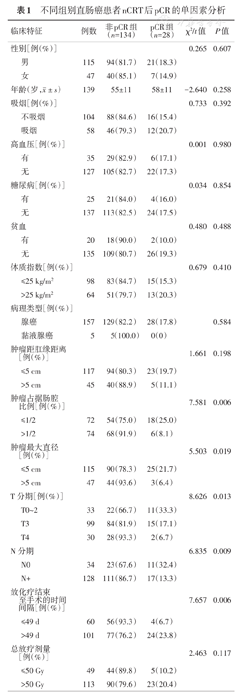
直肠癌患者nCRT后pCR的单因素分析结果如表1。结果显示,临床T分期、临床N分期、肿瘤占据肠腔比例、肿瘤最大直径、放化疗结束至手术的时间间隔与pCR有关(均P<0.05),而年龄、性别、吸烟、高血压、糖尿病、贫血、BMI、病理类型、肿瘤距肛缘距离、放疗时间、放疗剂量、手术方式、nCRT前后血清CEA、AFP、CA125、CA199水平在pCR组和非pCR组间差异均无统计学意义(均P>0.05)。肿瘤占肠腔比例≤1/2、肿瘤最大直径≤5 cm、较早的临床T/N分期、放化疗结束至手术的时间间隔>49 d的患者更容易获得pCR,即对nCRT敏感。
不同组别直肠癌患者nCRT后pCR的单因素分析
不同组别直肠癌患者nCRT后pCR的单因素分析
| 临床特征 | 例数 | 非pCR组(n=134) | pCR组(n=28) | χ2/t值 | P值 | |
|---|---|---|---|---|---|---|
| 性别[例(%)] | 0.265 | 0.607 | ||||
| 男 | 115 | 94(81.7) | 21(18.3) | |||
| 女 | 47 | 40(85.1) | 7(14.9) | |||
年龄(岁, ± s) ± s) | 139 | 55±11 | 58±11 | -2.640 | 0.258 | |
| 吸烟[例(%)] | 0.733 | 0.392 | ||||
| 不吸烟 | 104 | 88(84.6) | 16(15.4) | |||
| 吸烟 | 58 | 46(79.3) | 12(20.7) | |||
| 高血压[例(%)] | 0.001 | 0.980 | ||||
| 有 | 35 | 29(82.9) | 6(17.1) | |||
| 无 | 127 | 105(82.7) | 22(17.3) | |||
| 糖尿病[例(%)] | 0.034 | 0.854 | ||||
| 有 | 25 | 21(84.0) | 4(16.0) | |||
| 无 | 137 | 113(82.5) | 24(17.5) | |||
| 贫血 | 0.480 | 0.488 | ||||
| 有 | 20 | 18(90.0) | 2(10.0) | |||
| 无 | 135 | 109(80.7) | 26(19.3) | |||
| 体质指数[例(%)] | 0.679 | 0.410 | ||||
| ≤25 kg/m2 | 98 | 83(84.7) | 15(15.3) | |||
| >25 kg/m2 | 64 | 51(79.7) | 13(20.3) | |||
| 病理类型[例(%)] | ||||||
| 腺癌 | 157 | 129(82.2) | 28(17.8) | 0.584 | ||
| 黏液腺癌 | 5 | 5(100.0) | 0(0) | |||
| 肿瘤距肛缘距离[例(%)] | 1.661 | 0.198 | ||||
| ≤5 cm | 117 | 94(80.3) | 23(19.7) | |||
| >5 cm | 45 | 40(88.9) | 5(11.1) | |||
| 肿瘤占据肠腔比例[例(%)] | 7.581 | 0.006 | ||||
| ≤1/2 | 72 | 54(75.0) | 18(25.0) | |||
| >1/2 | 74 | 68(91.9) | 6(8.1) | |||
| 肿瘤最大直径[例(%)] | 5.503 | 0.019 | ||||
| ≤5 cm | 115 | 90(78.3) | 25(21.7) | |||
| >5 cm | 47 | 44(93.6) | 3(6.4) | |||
| T分期[例(%)] | 8.626 | 0.013 | ||||
| T0~2 | 33 | 22(66.7) | 11(33.3) | |||
| T3 | 99 | 84(81.9) | 15(17.1) | |||
| T4 | 30 | 28(93.3) | 2(6.7) | |||
| N分期 | 6.835 | 0.009 | ||||
| N0 | 34 | 23(67.6) | 11(32.4) | |||
| N+ | 128 | 111(86.7) | 17(13.3) | |||
| 放化疗结束至手术的时间间隔[例(%)] | 7.657 | 0.006 | ||||
| ≤49 d | 60 | 56(93.3) | 4(6.7) | |||
| >49 d | 101 | 77(76.2) | 24(23.8) | |||
| 总放疗剂量[例(%)] | 2.463 | 0.117 | ||||
| ≤50 Gy | 49 | 44(89.8) | 5(10.2) | |||
| >50 Gy | 113 | 90(79.6) | 23(20.4) | |||
| 手术方式[例(%)] | 0.564 | 0.460 | ||||
| LAR | 112 | 91(81.3) | 21(18.8) | |||
| APR | 50 | 43(86.0) | 7(14.0) | |||
| nCRT前CEA[例(%)] | 0.192 | 0.662 | ||||
| ≤5 μg/L | 79 | 65(82.3) | 14(17.7) | |||
| >5 μg/L | 58 | 46(79.3) | 12(20.7) | |||
| nCRT前AFP[例(%)] | - | 0.803 | ||||
| ≤20 μg/L | 126 | 101(80.2) | 25(19.8) | |||
| >20 μg/L | 1 | 1(100.0) | 0(0) | |||
| nCRT前CA125[例(%)] | - | 0.666 | ||||
| ≤35 U/ml | 118 | 96(81.4) | 22(18.6) | |||
| >35 U/ml | 2 | 2(100.0) | 0(0) | |||
| nCRT前CA199[例(%)] | 0.385 | 0.535 | ||||
| ≤37 U/ml | 117 | 93(79.5) | 24(20.5) | |||
| >37 U/ml | 18 | 16(88.9) | 2(11.1) | |||
| nCRT后CEA[例(%)] | 0.636 | 0.425 | ||||
| ≤5 μg/L | 142 | 119(83.8) | 23(16.2) | |||
| >5 μg/L | 14 | 10(71.4) | 4(28.6) | |||
| nCRT后AFP[例(%)] | - | 1.000 | ||||
| ≤20 μg/L | 153 | 127(83.0) | 26(17.0) | |||
| >20 μg/L | 1 | 1(100.0) | 0(0) | |||
| nCRT后CA125[例(%)] | - | - | ||||
| ≤35 U/ml | 148 | 123(83.1) | 25(16.9) | |||
| >35 U/ml | 0 | 0(0) | 0(0) | |||
| nCRT后CA199[例(%)] | - | 0.588 | ||||
| ≤37 U/ml | 151 | 124(82.1) | 27(17.9) | |||
| >37 U/ml | 5 | 5(100.0) | 0(0) | |||
注:"-"示采用Fisher精确概率法进行分析,或未进行统计分析;nCRT:新辅助放化疗;pCR:病理完全缓解;LAR:直肠癌前切除术;APR:经腹会阴直肠癌根治术;CEA:癌胚抗原;AFP:甲胎蛋白;CA125:糖链抗原125;CA199:糖链抗原199;由于本研究时间跨度大,计算机系统遗失部分数据,以及个别患者未进行某项指标检测,所以只对研究指标的有效数据进行分析,对分析结果存在一定影响
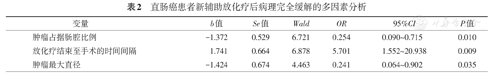
logistic回归分析显示,肿瘤占肠腔比例、放化疗结束至手术的时间间隔、肿瘤最大直径是pCR的独立预测因素(均P<0.05),见表2。而T分期、N分期并不是影响放化疗敏感性的独立相关因素,与直肠癌pCR无明确相关性(均P>0.05)。
直肠癌患者新辅助放化疗后病理完全缓解的多因素分析
直肠癌患者新辅助放化疗后病理完全缓解的多因素分析
| 变量 | b值 | Se值 | Wald | OR | 95%CI | P值 |
|---|---|---|---|---|---|---|
| 肿瘤占据肠腔比例 | -1.372 | 0.529 | 6.721 | 0.254 | 0.090~0.715 | 0.010 |
| 放化疗结束至手术的时间间隔 | 1.741 | 0.664 | 6.878 | 5.701 | 1.552~20.938 | 0.009 |
| 肿瘤最大直径 | -1.424 | 0.674 | 4.463 | 0.241 | 0.064~0.902 | 0.035 |
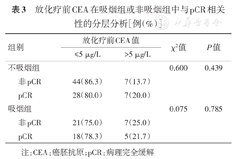
单因素分析中nCRT前血清CEA水平与pCR无关,据报道吸烟会导致CEA水平增高,为了排除吸烟因素的影响,进行分层分析,结果如表3。在分层分析中,发现无论是吸烟组还是非吸烟组,nCRT前血清CEA水平均与pCR无关,提示nCRT前血清CEA水平不是pCR的预测指标。
放化疗前CEA在吸烟组或非吸烟组中与pCR相关性的分层分析[例(%)]
放化疗前CEA在吸烟组或非吸烟组中与pCR相关性的分层分析[例(%)]
| 组别 | 放化疗前CEA值 | χ2值 | P值 | ||
|---|---|---|---|---|---|
| ≤5 μg/L | >5 μg/L | ||||
| 不吸烟组 | 0.600 | 0.439 | |||
| 非pCR | 44(86.3) | 7(13.7) | |||
| pCR | 28(80.0) | 7(20.0) | |||
| 吸烟组 | 0.075 | 0.785 | |||
| 非pCR | 21(75.0) | 7(25.0) | |||
| pCR | 18(78.3) | 5(21.7) | |||
注:CEA:癌胚抗原;pCR:病理完全缓解
近年来,nCRT逐渐引起人们的重视,其与术后放化疗相比具有明显优势。本研究发现,放化疗结束至手术的时间间隔、肿瘤占肠腔比例、肿瘤最大直径与nCRT后pCR有关。
nCRT后手术时机的选择一直存在争议,对于常规分割nCRT的患者,欧洲肿瘤内科学会(ESMO)推荐时间间隔为6~8周[2],美国国家综合癌症网络(NCCN)指南推荐为5~12周[3]。理论上,放化疗后肿瘤细胞坏死、凋亡、纤维化需要一定时间,Dhadda等[4]的研究发现,nCRT开始后体积为54 cm3的肿瘤减小到小于0.1 cm3,需要20周的时间。nCRT后短时间内手术,由于肿瘤消退不充分,可能降低R0切除率及保肛率,增加术中出血、感染等并发症的风险;若时间间隔过长,可能导致局部组织纤维化,增加手术的难度和术后并发症的发生率,同时对nCRT不敏感的患者,可能会延误治疗。研究显示[5],放化疗后间隔7周以上进行手术可以显著提高pCR率,降低局部复发率。Probst等[6]发现随着时间间隔的延长,肿瘤消退率也逐渐增加,间隔时间<6周、6~8周和>8周的pCR率分别为8.7%、11.7%和13.2%。本研究结果显示,放化疗结束至手术的时间间隔≤49 d及>49 d患者的pCR率分别为6.7%和23.8%,与上述文献一致。但也有研究显示并不是间隔时间越长,pCR率越高。一项多中心GRECCAR-6试验研究表明[7],nCRT后11周进行手术并未显著增加术后的pCR率,相反,可能会增加手术难度,并且患者的围术期并发症及术后并发症的风险也随之升高。Kim等[8]的回顾性研究也得出相同的结论。目前我国抗癌协会大肠癌专业委员会达成的共识是nCRT与手术的间隔以6~8周为主,在部分有获得pCR希望或期望肿瘤进一步退缩以提高保肛机会的患者中,至多可以延长至12~14周[9]。
朱向高[10]研究显示,肿瘤所占肠腔比例对于nCRT后pCR具有预测作用,肿瘤占肠腔比例≤1/2的患者更容易达到pCR。本研究发现肿瘤所占肠腔比例与术后pCR相关,肿瘤所占肠腔比例≤1/2组和>1/2组pCR率分别为25%例(18/72)和8.1%(6/74),与文献报道结果相符。De Felice等[11]的研究表明,肿瘤大小是pCR率的独立预测因素,肿瘤最大直径一定程度上反映了肿瘤大小,肿瘤体积越小,pCR率越高。
有研究证实吸烟会导致血液CEA水平增加,从而干扰CEA对pCR预测结果,因此本研究进行了分层分析。结果表明在吸烟组与非吸烟组中,CEA均与pCR无关,这与Kalady等[12]的研究结果一致。我们推测CEA的水平只是在一定程度上反映了肿瘤的负荷,而不是nCRT的疗效。Zhang等[13]发现nCRT前血清CEA水平不能预测pCR,但对患者预后有提示意义,CEA水平高的患者更容易发生复发和转移,可以用于复发监测。此外,有研究表明术前CEA≤5 μg/L是影响总体生存率的独立因素[14]。
LARC患者对nCRT反应性存在较大差异,决定了临床需要采取截然不同的治疗方案,因此早期预测患者对治疗的反应至关重要。MRI、18F-脱氧葡萄糖正电子发射计算机断层显像(18F-FDG PET/CT)、分子生物标志物等都有预测nCRT反应的潜力。然而,几种方法在准确性上存在一定的局限性。因此,需要将多种评估工具,如临床因素、影像学技术、肿瘤标志物、分子标记物(包括基因检测和蛋白检测)相结合,才能更加准确地预测nCRT的疗效,从而实现LARC的个体化治疗。
所有作者均声明不存在利益冲突



























