
比较加速康复外科(ERAS)方案和传统围术期处理方案对胃癌患者术后近期临床结局和远期预后的影响。
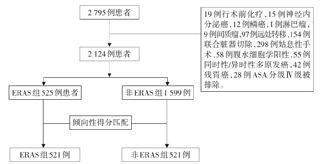
本研究为回顾性队列研究,研究对象为2007—2012年间行标准胃癌根治术(D2淋巴结清扫术)的患者2 124例。根据围术期处理方案的不同分为ERAS组和非ERAS组(传统方案组)。针对两组患者基本临床特征的差异,采用倾向性得分匹配(PSM)的方法,匹配按照1∶1比例进行,每组得到521例。比较两组患者术后的并发症发生率、住院时间、出血量、30 d再入院率等及5年生存率。
两组术后总并发症发生率相似(ERAS组=18.4%,非ERAS组=19.4%,P=0.69),吻合口瘘、腹腔出血等并发症的发生率类似,无统计学差异。手术部位感染(SSI)、肺不张、血栓栓塞性疾病的发生率,ERAS组低于非ERAS组,差异有统计学意义。ERAS组的淋巴结清扫数目、手术时间、术中出血量、住院天数及费用都优于非ERAS组。两组患者的非计划再手术、30 d再入院率及围术期死亡率未见明显差异。非ERAS组和ERAS组的5年总生存率分别为66.2%和72.8%(P=0.007),Ⅰ期胃癌患者,ERAS组和非ERAS组的5年生存率分别为93.4%和92.7%(P=0.73),Ⅱ、Ⅲ期胃癌患者,ERAS组和非ERAS组5年生存率分别为82.2%和75.2%(P=0.007)、47.6%和35.7%(P=0.02),差异有统计学意义。
胃癌患者应用围手术期ERAS路径管理方案安全、可行,不增加并发症的发生率及30 d再入院率,同时可以改善胃癌患者的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
加速康复外科(ERAS)最早由丹麦的Kehlet教授提出,指通过一系列优化的围术期处理方案,最大程度地减少手术患者的应激状态,以减少并发症的发生,达到改善患者临床结局的目的[1]。黎介寿院士于2007年最早引进该理念[2],我中心于同年开始探索胃癌患者ERAS路径管理,并在2010年发表胃癌ERAS围手术期管理的RCT研究论著[3]。当前有关胃癌EARS研究多关注近期临床结局,本研究旨在探究ERAS方案对胃癌患者近期临床结局及预后的影响。
本研究获得青岛大学附属医院伦理委员会批准(QYFYKYLL-2018-29),共收集2007—2012年间胃癌手术患者2 795例。按ERAS路径管理示范病区(采取ERAS方案)和非示范病区(采取传统方案),将患者分为ERAS组和非ERAS组。纳入标准:(1)术前经内镜活检证实为腺癌;(2)肿瘤位于食管胃结合部(Siewert Ⅱ\Ⅲ型)或胃上、中、下1/3;(3)术前无肝、肺、腹腔等远处转移;(4)行标准淋巴结清扫术。排除标准:(1)食管胃结合部鳞癌、胃淋巴瘤、间质瘤等;(2)肿瘤远处转移、腹水阳性、姑息手术;(3)术前接受新辅助、转化化疗者;(4)同时性、异时性多原发癌患者;(5)急诊手术患者;(6)联合脏器切除;(7)ASA分级Ⅳ级;(8)残胃癌。研究流程见图1。术后根据病理学分期,对适合指征的患者采取以替吉奥胶囊联合奥沙利铂(SOX)和卡培他滨联合奥沙利铂(XELOX)为主的方案进行辅助化疗6~8周期。

基于我们以往发表的临床研究[3]。我们对临床路径所涉及的诸多因素进行整合,提出ERAS路径管理的核心条款,即患者及家属宣教、术前评估及预康复处理、多模式镇痛、精准外科、手术小切口、早期活动、经口进食(肠内营养结合肠外营养支持),以期降低及尽早逆转手术、药物、精神心理及饥饿应激,促进康复,改善患者临床结局。ERAS管理示范病区中,65.3%的患者可以执行80%以上的ERAS方案,80.4%的患者可以执行80%以上的"核心条款"。(表1)。
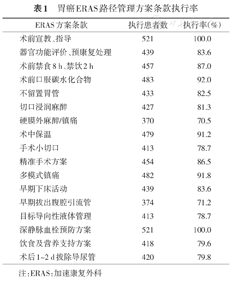
胃癌ERAS路径管理方案条款执行率
胃癌ERAS路径管理方案条款执行率
| ERAS方案条款 | 执行患者数 | 执行率(%) |
|---|---|---|
| 术前宣教、指导 | 521 | 100.0 |
| 器官功能评价、预康复处理 | 439 | 83.6 |
| 术前禁食8 h、禁饮2 h | 457 | 87.0 |
| 术前口服碳水化合物 | 483 | 92.0 |
| 不留置胃管 | 433 | 82.5 |
| 切口浸润麻醉 | 427 | 81.3 |
| 硬膜外麻醉/镇痛 | 370 | 70.5 |
| 术中保温 | 479 | 91.2 |
| 手术小切口 | 413 | 78.7 |
| 精准手术方案 | 454 | 86.5 |
| 多模式镇痛 | 482 | 91.8 |
| 早期下床活动 | 439 | 83.6 |
| 早期拔出腹腔引流管 | 374 | 71.2 |
| 目标导向性液体管理 | 413 | 78.7 |
| 深静脉血栓预防方案 | 521 | 100.0 |
| 饮食及营养支持方案 | 418 | 79.6 |
| 术后1~2 d拔除导尿管 | 420 | 79.8 |
注:ERAS:加速康复外科
按照日本胃癌治疗指南[4]对患者手术后进行随访管理,主要采取门诊随访、核查患者就诊记录等,截止时间为2017年6月,共有807例患者死亡,中位随访时间1 900 d(30~3 797 d)。生存时间(d)自接受胃癌根治术当天开始计算。
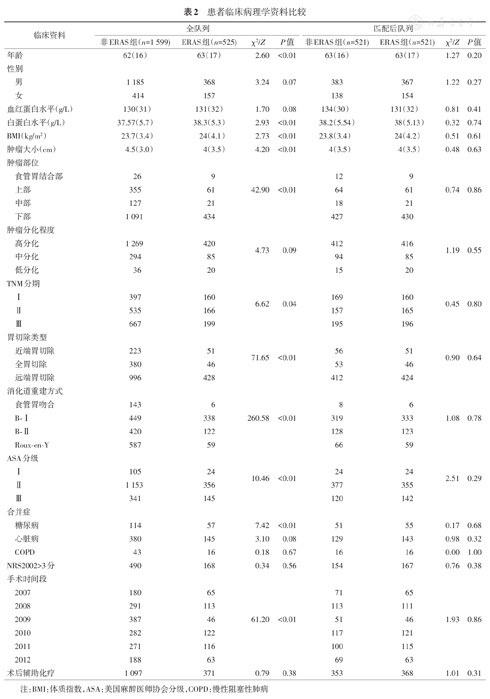
在SPSS软件(24.0版本)中利用倾向性得分匹配的方法(PSM),将两组患者按照1∶1匹配,匹配容差设为0.1(表2)。计量资料采用独立样本t检验或秩和检验进行比较,计量资料采用χ2检验;生存分析采用Kaplan-Meier法。根据TNM分期进行亚组分析。多因素分析采用Cox比例风险模型。检验水准α=0.05。
患者临床病理学资料比较
患者临床病理学资料比较
| 临床资料 | 全队列 | 匹配后队列 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 非ERAS组(n=1 599) | ERAS组(n=525) | χ2/Z | P值 | 非ERAS组(n=521) | ERAS组(n=521) | χ2/Z | P值 | ||
| 年龄 | 62(16) | 63(17) | 2.60 | <0.01 | 63(16) | 63(17) | 1.27 | 0.20 | |
| 性别 | |||||||||
| 男 | 1 185 | 368 | 3.24 | 0.07 | 383 | 367 | 1.22 | 0.27 | |
| 女 | 414 | 157 | 138 | 154 | |||||
| 血红蛋白水平(g/L) | 130(31) | 131(32) | 1.70 | 0.08 | 134(30) | 131(32) | 0.81 | 0.41 | |
| 白蛋白水平(g/L) | 37.57(5.7) | 38.3(5.3) | 2.93 | <0.01 | 38.2(5.54) | 38(5.13) | 0.32 | 0.74 | |
| BMI(kg/m2) | 23.7(3.4) | 24(4.1) | 2.73 | <0.01 | 23.8(3.4) | 24(4.2) | 0.51 | 0.61 | |
| 肿瘤大小(cm) | 4.5(3.0) | 4(3.5) | 4.20 | <0.01 | 4(3.5) | 4(3.5) | 0.48 | 0.63 | |
| 肿瘤部位 | |||||||||
| 食管胃结合部 | 26 | 9 | 12 | 9 | |||||
| 上部 | 355 | 61 | 42.90 | <0.01 | 64 | 61 | 0.74 | 0.86 | |
| 中部 | 127 | 21 | 18 | 21 | |||||
| 下部 | 1 091 | 434 | 427 | 430 | |||||
| 肿瘤分化程度 | |||||||||
| 高分化 | 1 269 | 420 | 4.73 | 0.09 | 412 | 416 | 1.19 | 0.55 | |
| 中分化 | 294 | 85 | 94 | 85 | |||||
| 低分化 | 36 | 20 | 15 | 20 | |||||
| TNM分期 | |||||||||
| Ⅰ | 397 | 160 | 6.62 | 0.04 | 169 | 160 | 0.45 | 0.80 | |
| Ⅱ | 535 | 166 | 157 | 165 | |||||
| Ⅲ | 667 | 199 | 195 | 196 | |||||
| 胃切除类型 | |||||||||
| 近端胃切除 | 223 | 51 | 71.65 | <0.01 | 56 | 51 | 0.90 | 0.64 | |
| 全胃切除 | 380 | 46 | 53 | 46 | |||||
| 远端胃切除 | 996 | 428 | 412 | 424 | |||||
| 消化道重建方式 | |||||||||
| 食管胃吻合 | 143 | 6 | 8 | 6 | |||||
| BⅠ | 449 | 338 | 260.58 | <0.01 | 319 | 333 | 1.08 | 0.78 | |
| BⅡ | 420 | 122 | 128 | 123 | |||||
| RouxenY | 587 | 59 | 66 | 59 | |||||
| ASA分级 | |||||||||
| Ⅰ | 105 | 24 | 10.46 | <0.01 | 24 | 24 | 2.51 | 0.29 | |
| Ⅱ | 1 153 | 356 | 377 | 355 | |||||
| Ⅲ | 341 | 145 | 120 | 142 | |||||
| 合并症 | |||||||||
| 糖尿病 | 114 | 57 | 7.42 | <0.01 | 51 | 55 | 0.17 | 0.68 | |
| 心脏病 | 380 | 145 | 3.10 | 0.08 | 129 | 143 | 0.98 | 0.32 | |
| COPD | 43 | 16 | 0.18 | 0.67 | 16 | 16 | 0.00 | 1.00 | |
| NRS2002>3分 | 490 | 168 | 0.34 | 0.56 | 154 | 167 | 0.76 | 0.38 | |
| 手术时间段 | |||||||||
| 2007 | 180 | 65 | 71 | 65 | |||||
| 2008 | 291 | 113 | 113 | 111 | |||||
| 2009 | 387 | 46 | 61.20 | <0.01 | 51 | 46 | 1.93 | 0.86 | |
| 2010 | 282 | 122 | 117 | 121 | |||||
| 2011 | 271 | 116 | 100 | 115 | |||||
| 2012 | 188 | 63 | 69 | 63 | |||||
| 术后辅助化疗 | 1 097 | 371 | 0.79 | 0.38 | 353 | 368 | 1.01 | 0.31 | |
注:BMI:体质指数,ASA:美国麻醉医师协会分级,COPD:慢性阻塞性肺病
1.非ERAS组和ERAS组临床资料的特征比较(表2)。
2.近期结局:匹配后,非ERAS组和ERAS组并发症发生率分别为19.4%和18.4%(P=0.69)。胃癌根治术后常见并发症,如吻合口瘘、腹腔出血等并发症在两组间比较差异无统计学意义。两组患者的手术部位感染(SSI)、肺不张、血栓栓塞性疾病的发生率,ERAS组低于非ERAS组,差异有统计学意义。ERAS组的淋巴结清扫数目、手术时间、术中出血量、术后肠道功能恢复时间、疼痛评分、住院天数及费用都优于非ERAS组。两组患者的非计划再手术、30 d再入院率及围术期死亡率差异无统计学意义(表3)。
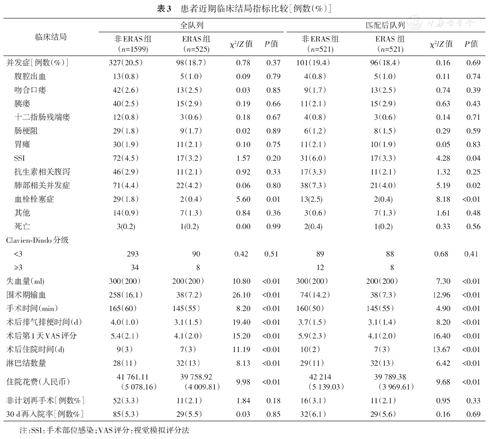
患者近期临床结局指标比较[例数(%)]
患者近期临床结局指标比较[例数(%)]
| 临床结局 | 全队列 | 匹配后队列 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 非ERAS组(n=1599) | ERAS组(n=525) | χ2/Z值 | P值 | 非ERAS组(n=521) | ERAS组(n=521) | χ2/Z值 | P值 | ||
| 并发症[例数(%)] | 327(20.5) | 98(18.7) | 0.78 | 0.37 | 101(19.4) | 96(18.4) | 0.16 | 0.69 | |
| 腹腔出血 | 13(0.8) | 5(1.0) | 0.09 | 0.79 | 4(0.8) | 5(1.0) | 0.11 | 0.74 | |
| 吻合口瘘 | 42(2.6) | 13(2.5) | 0.03 | 0.85 | 9(1.7) | 13(2.5) | 0.74 | 0.39 | |
| 胰瘘 | 40(2.5) | 15(2.9) | 0.19 | 0.66 | 11(2.1) | 15(2.9) | 0.63 | 0.43 | |
| 十二指肠残端瘘 | 12(0.8) | 3(0.6) | 0.18 | 0.67 | 4(0.8) | 3(0.6) | 0.14 | 0.71 | |
| 肠梗阻 | 29(1.8) | 9(1.7) | 0.02 | 0.89 | 6(1.2) | 8(1.5) | 0.29 | 0.59 | |
| 胃瘫 | 30(1.9) | 11(2.1) | 0.10 | 0.75 | 11(2.1) | 10(1.9) | 0.05 | 0.83 | |
| SSI | 72(4.5) | 17(3.2) | 1.57 | 0.20 | 31(6.0) | 17(3.3) | 4.28 | 0.04 | |
| 抗生素相关腹泻 | 46(2.9) | 11(2.1) | 0.92 | 0.33 | 17(3.3) | 11(2.1) | 1.32 | 0.25 | |
| 肺部相关并发症 | 71(4.4) | 22(4.2) | 0.06 | 0.80 | 38(7.3) | 21(4.0) | 5.19 | 0.02 | |
| 血栓栓塞症 | 29(1.8) | 2(0.4) | 5.60 | 0.01 | 13(2.5) | 2(0.4) | 8.18 | <0.01 | |
| 其他 | 14(0.9) | 7(1.3) | 0.84 | 0.36 | 3(0.6) | 7(1.3) | 1.61 | 0.48 | |
| 死亡 | 3(0.2) | 1(0.2) | 0.00 | 0.99 | 2(0.4) | 1(0.2) | 0.33 | 0.56 | |
| ClavienDindo分级 | |||||||||
| <3 | 293 | 90 | 0.42 | 0.51 | 89 | 88 | 0.68 | 0.41 | |
| ≥3 | 34 | 8 | 12 | 8 | |||||
| 失血量(ml) | 300(200) | 200(200) | 10.80 | <0.01 | 300(200) | 200(200) | 7.30 | <0.01 | |
| 围术期输血 | 258(16.1) | 38(7.2) | 26.10 | <0.01 | 74(14.2) | 38(7.3) | 12.96 | <0.01 | |
| 手术时间(min) | 165(60) | 145(55) | 8.20 | <0.01 | 160(50) | 145(55) | 4.90 | <0.01 | |
| 术后排气排便时间(d) | 4.0(1.0) | 3.1(1.5) | 19.40 | <0.01 | 3.7(1.5) | 3.1(1.4) | 8.20 | <0.01 | |
| 术后第1天VAS评分 | 5.4(2.1) | 4.1(2.0) | 15.20 | <0.01 | 5.9(2.3) | 4.1(2.0) | 16.40 | <0.01 | |
| 术后住院时间(d) | 9(3) | 7(3) | 11.19 | <0.01 | 10(2) | 7(3) | 13.67 | <0.01 | |
| 淋巴结数量 | 28(11) | 32(13) | 8.13 | <0.01 | 29(11) | 32(13) | 6.42 | <0.01 | |
| 住院花费(人民币) | 41 761.11(5 078.16) | 39 758.92(4 009.81) | 9.98 | <0.01 | 42 214(5 139.03) | 39 789.38(3 969.61) | 9.68 | <0.01 | |
| 非计划再手术[例数%] | 52(3.3) | 11(2.1) | 1.84 | 0.18 | 16(3.1) | 11(2.1) | 0.95 | 0.33 | |
| 30 d再入院率[例数%] | 85(5.3) | 29(5.5) | 0.03 | 0.85 | 32(6.1) | 29(5.6) | 0.16 | 0.69 | |
注:SSI:手术部位感染;VAS评分:视觉模拟评分法
3.预后分析:非ERAS组和ERAS组的5年总生存率分别为66.2%和72.8%(P=0.007)。按照TNM分期进行亚组分析,结果提示:Ⅰ期胃癌患者,ERAS组和非ERAS组的5年生存率分别为93.4%和92.7%(P=0.73),差异无统计学意义,Ⅱ、Ⅲ期胃癌患者,ERAS组和非ERAS组5年生存率分别为82.2% vs 75.2%(Log Rank=7.08,P=0.007)、47.6% vs 35.7%(Log Rank=5.40,P=0.02),差异有统计学意义(图2、图3)。
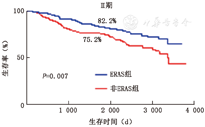

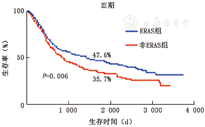

本研究两组患者的总并发症发生率相近,但ERAS组肺部并发症、血栓相关等显著低于非ERAS组,这可能与术前预康复、术中保温、精准手术、多模式镇痛、早期下床活动、抗血栓方案等共同作用有关。随着ERAS理念的不断推广与发展,预康复也被赋予了新的内涵,其目的是提高个体抗重大手术能力,从而增加对手术的耐受能力、降低围手术期并发症及死亡率、加速术后恢复[5]。住院天数、胃肠道恢复时间、住院费用等的改善与既往研究一致。30 d再入院率是评价围手术期管理安全质量的重要指标,本研究未见明显差异。但是文献报道仍存在争议[6,7],这可能与不同研究所纳入的胃癌患者队列临床病理学资料的差异、手术方式、并发症高低等因素有关。
由于患者个体化差异、依从性、某些医疗因素等,完全执行所有的ERAS方案是很难实现的,我们将诸多因素整合,提出ERAS路径管理的核心条款(如前所述)。结合执行率及临床结局改善情况,说明核心条款发挥的作用举足轻重。理论上完整执行ERAS路径能获得更佳的临床结局,实际上只有在严格设计的随机对照研究中筛选出的患者才可能实现,这可以定义为"广义"ERAS;临床实践中绝大多数患者只能执行ERAS路径中的部分条款,而核心条款几乎适合于所有患者,因此核心条款应视为"狭义"ERAS。我们的研究发现,以核心条款为主导的ERAS路径,仍然可以发挥减轻乃至逆转患者应激状态、改善临床结局的作用。
Gustafsson和Curtis等[8,9]报道了ERAS方案能够延长结直肠癌患者的生存期,改善预后。本研究中,两组患者5年总生存率有显著差异,亚组分析提示这一差异更多体现在Ⅱ、Ⅲ期患者,这可能与Ⅰ期胃癌手术治愈率较高有关。对Ⅱ、Ⅲ期胃癌患者,ERAS路径管理方案可能带来肿瘤控制的潜在效果。我们前期的研究[3]及多项Meta[7,10]分析显示,ERAS路径管理的患者,术后CRP、IL-6、TNF-α等反映应激状态的指标显著降低。国内也有研究表明[11]ERAS路径中的结直肠癌患者术后具有更好的体液免疫状态。另外硬膜外麻醉、多模式镇痛也能减少阿片类药物的应用。阿片类药物可以抑制巨噬细胞、NK细胞、B细胞以及T细胞的免疫作用,增加血管生成,促进转移性病灶的生长[12]。因此更加科学合理的围术期管理方案带来的良好免疫状态可能是ERAS路径使肿瘤患者生存获益的主要原因。
另外,快速充分的恢复有助于患者更加及时地接受进一步的辅助治疗,也可能是重要的因素。但是ERAS方案改善胃癌患者预后的确切机制仍然需要进一步研究。
本研究为单中心的回顾性研究,采取了倾向性得分匹配的方法最大程度地减少了偏倚,但随着微创手术的不断发展、麻醉技术的改进、新型药物的问世,ERAS理论和实践也在不断完善。本研究的时间跨度大,胃癌的治疗可能会有部分改进,因此许多结论仍有待于设计良好的前瞻性多中心随机对照研究或通过大数据真实世界研究加以验证,这也是我们下一步的工作方向。
总之,胃癌患者应用围手术期ERAS路径管理方案安全、可行,不增加并发症的发生率及30 d再入院率,同时可以改善胃癌患者的预后。
所有作者均声明不存在利益冲突



























