
探讨体外膈肌起搏器(EDP)联合经鼻高流量氧疗(HFNC)对辅助重症脑出血术后机械通气(MV)患者脱机的临床疗效。
选择火箭军特色医学中心神经重症监护病房(NICU)2016年10月至2019年12月收治的需行MV的神外重症脑出血术后气管切开患者123例,将其按随机数字表法分为HFNC组(n=63)和HFNC+EDP组(n=60)。HFNC组在患者脱离呼吸机后序贯经鼻高流量吸氧;HFNC+EDP组:在HFNC组基础上加用EDP治疗,1次/d,每次30 min。
与HFNC组相比,HFNC+EDP组患者脱机后1、12、24及48 h的氧合指数较高[(209±15)mmHg比(218±18)mmHg,(215±14)mmHg比(222±17)mmHg,(223±13)mmHg比(235±15)mmHg,(236±7)mmHg比(257±12)mmHg;均P<0.05]、脱机时间较短[(13±3)d比(12±3)d,P<0.05]、膈肌移动度增加[(1.94±0.08)cm比(2.91±0.11)cm,P<0.05]、住NICU时间较短[(33±14)d比(28±9)d,P<0.05]、出NICU时格拉斯哥评分(GCS)(5.9±2.1比7.8±0.4,P<0.05)及出院GCS较高(9.9±2.1比11.0±2.0,P<0.05)。
EDP联合HFNC能增加神外重症脑出血术后气管切开患者的膈肌移动度,缩短脱机时间和入住NICU的时间,从而早日康复,改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑出血的发病率为(12~15)/10万人年,发病30 d的病死率高达35%~52%,给社会和家庭都带来了沉重的负担[1]。机械通气(MV)是重症脑出血术后患者常用的生命支持手段,神经重症监护病房(NICU)行MV的患者比例高达50%,其中29.63%的重症脑出血患者需要急诊行气管切开[2],但长期MV可能引起很多并发症,导致脱机困难或脱机延迟使原发疾病恶化,增加死亡率[3]。所以重症脑出血患者一旦原发病出现好转,要尽早脱机。体外膈肌起搏器(EDP)通过低频电脉冲刺激膈神经,引起膈肌持续而有节律地收缩,是一种被动式呼吸肌锻炼方法[4]。经鼻高流量氧疗(HFNC)是指通过鼻导管直接将一定浓度的高流量空氧混合气体经过加温加湿输送给患者的一种新型无创通气氧疗方式[5]。目前,临床上辅助脱机方法主要有低流量普通鼻导管、储氧面罩、文丘里面罩及无创呼吸机等,这些设备主要是氧疗设备,对患者膈肌功能康复关注较少。本项研究通过观察EDP联合HFNC对重症脑出血术后气切患者的脱机效果,探讨EDP治疗是否可以通过改善膈肌功能来缩短撤机时间,以评价EDP联合HFNC对辅助脑出血术后MV患者脱机的临床应用价值。
采用单中心随机对照前瞻研究方法,收集火箭军特色医学中心NICU 2016年10月至2019年12月收治的需行MV的神外重症脑出血术后患者,共123例。(1)纳入标准:入NICU行开颅血肿清除术后患者;需要气管切开维持气道和排痰;气管切开MV后患者有自主呼吸。(2)排除标准:气管切开后无自主呼吸能力,需要长期MV;合并严重肺部疾病[如慢性阻塞性肺疾病(COPD)、肺纤维化、肺栓塞];合并严重心律失常、心力衰竭。(3)伦理学:本研究经火箭军特色医学中心医学伦理委员会批准,所有治疗和检测方法取得患者家属知情同意并签字。
将患者按入院顺序编号,按照随机数字表法,分为两种不同脱机方法组:HFNC组63例,男42例,女21例,年龄(66.10±14.11)岁;HFNC+EDP组60例,男39例,女21例,年龄(68.60±12.11)岁。
(1)自主呼吸试验:所有患者均通过自主呼吸试验(SBT)后脱机[6]。(2)脱机方法:HFNC组:在患者脱离呼吸机后序贯HFNC,氧流量40 L/min,氧浓度40%;HFNC+EDP组联合治疗组:在HFNC组治疗基础上加用EDP治疗,患者平卧位,将2个小电极片贴在两侧颈部胸锁乳突肌外缘下1/3处,将2个大极片贴在两侧对应的锁骨中线第二肋间,大小2个电极片之间的距离>1cm,起搏次数9次/min,刺激频率40 Hz,刺激强度:从低至高调节,一般为10~15 U。1次/d,每次30 min。撤机成功的标准:患者撤机后48 h无需再次进行机械通气治疗即为撤机成功。
(1)记录患者性别、年龄、体质指数、既往史(高血压、糖尿病、冠状动脉粥样硬化性心脏病、脑梗死、心房纤颤)、吸烟史、基础肺部疾病(包括COPD、哮喘、间质性肺疾病等)、入住NICU 24 h内急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分、入住NICU格拉斯哥(GCS)评分、血红蛋白、白细胞、白蛋白;(2)记录脱机0、1、12、24及48 h的氧合指数(OI)、脱机时间、膈肌移动度。(3)记录住NICU时间、出NICU时的GCS及出院GCS。
使用SPSS 19.0统计软件,符合正态分布的计量资料以 ±s表示,采用成组t检验分析;计数资料以例(率)表示,采用χ2检验。以P<0.05为差异有统计学意义。
±s表示,采用成组t检验分析;计数资料以例(率)表示,采用χ2检验。以P<0.05为差异有统计学意义。
HFNC组、HFNC+EDP组的性别、年龄、体质量指数、既往史(高血压、糖尿病、冠状动脉粥样硬化性心脏病、脑梗死及心房纤颤)、吸烟史、基础肺部疾病(包括COPD、哮喘及间质性肺疾病等)、入住NICU 24 h内APACHE Ⅱ评分、入住NICU时的GCS评分、血红蛋白、白细胞及白蛋白差异均无统计学意义(均P>0.05)(表1,表2)。
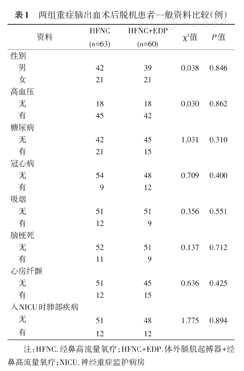
两组重症脑出血术后脱机患者一般资料比较(例)
两组重症脑出血术后脱机患者一般资料比较(例)
| 资料 | HFNC(n=63) | HFNC+EDP(n=60) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 42 | 39 | 0.038 | 0.846 | |
| 女 | 21 | 21 | |||
| 高血压 | |||||
| 无 | 18 | 18 | 0.030 | 0.862 | |
| 有 | 45 | 42 | |||
| 糖尿病 | |||||
| 无 | 42 | 45 | 1.031 | 0.310 | |
| 有 | 21 | 15 | |||
| 冠心病 | |||||
| 无 | 54 | 48 | 0.709 | 0.400 | |
| 有 | 9 | 12 | |||
| 吸烟 | |||||
| 无 | 51 | 51 | 0.356 | 0.551 | |
| 有 | 12 | 9 | |||
| 脑梗死 | |||||
| 无 | 52 | 51 | 0.137 | 0.712 | |
| 有 | 11 | 9 | |||
| 心房纤颤 | |||||
| 无 | 51 | 45 | 0.636 | 0.425 | |
| 有 | 12 | 15 | |||
| 入NICU时肺部疾病 | |||||
| 无 | 51 | 48 | 1.775 | 0.894 | |
| 有 | 12 | 12 | |||
注:HFNC.经鼻高流量氧疗;HFNC+EDP.体外膈肌起搏器+经鼻高流量氧疗;NICU.神经重症监护病房
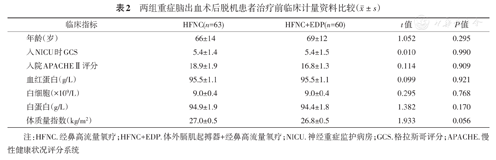
两组重症脑出血术后脱机患者治疗前临床计量资料比较( ±s)
±s)
两组重症脑出血术后脱机患者治疗前临床计量资料比较( ±s)
±s)
| 临床指标 | HFNC(n=63) | HFNC+EDP(n=60) | t值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 66±14 | 69±12 | 1.052 | 0.295 |
| 入NICU时GCS | 5.4±1.4 | 5.4±1.5 | 0.010 | 0.990 |
| 入院APACHEⅡ评分 | 18.9±1.9 | 16.8±1.3 | 0.114 | 0.909 |
| 血红蛋白(g/L) | 95.5±1.1 | 95.5±1.1 | 0.099 | 0.921 |
| 白细胞(×109/L) | 9.0±0.4 | 9.0±0.4 | 0.295 | 0.768 |
| 白蛋白(g/L) | 94.9±1.9 | 94.4±1.8 | 1.382 | 0.170 |
| 体质量指数(kg/m2) | 27.0±0.5 | 26.8±0.5 | 1.933 | 0.056 |
注:HFNC.经鼻高流量氧疗;HFNC+EDP.体外膈肌起搏器+经鼻高流量氧疗;NICU.神经重症监护病房;GCS.格拉斯哥评分;APACHE.慢性健康状况评分系统
与HFNC组相比,HFNC+EDP组患者脱机后1、12、24及48 h的OI较高、脱机时间较短及膈肌移动度增加,均P<0.05,表3。
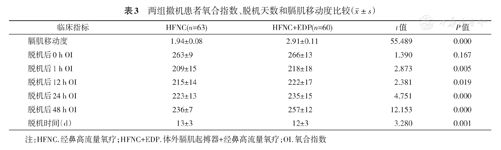
两组撤机患者氧合指数、脱机天数和膈肌移动度比较( ±s)
±s)
两组撤机患者氧合指数、脱机天数和膈肌移动度比较( ±s)
±s)
| 临床指标 | HFNC(n=63) | HFNC+EDP(n=60) | t值 | P值 |
|---|---|---|---|---|
| 膈肌移动度 | 1.94±0.08 | 2.91±0.11 | 55.489 | 0.000 |
| 脱机后0 h OI | 263±9 | 266±13 | 1.390 | 0.167 |
| 脱机后1 h OI | 209±15 | 218±18 | 2.873 | 0.005 |
| 脱机后12 h OI | 215±14 | 222±17 | 2.381 | 0.019 |
| 脱机后24 h OI | 223±13 | 235±15 | 4.751 | 0.000 |
| 脱机后48 h OI | 236±7 | 257±12 | 12.153 | 0.000 |
| 脱机时间(d) | 13±3 | 12±3 | 3.280 | 0.001 |
注:HFNC.经鼻高流量氧疗;HFNC+EDP.体外膈肌起搏器+经鼻高流量氧疗;OI.氧合指数
与HFNC组相比,HFNC+EDP组患者住NICU时间较短,出NICU时的GCS及出院时的GCS较高,均P<0.05,表4。
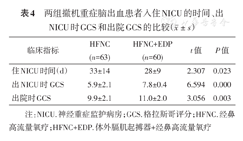
两组撤机重症脑出血患者入住NICU的时间、出NICU时GCS和出院GCS的比较( ±s)
±s)
两组撤机重症脑出血患者入住NICU的时间、出NICU时GCS和出院GCS的比较( ±s)
±s)
| 临床指标 | HFNC(n=63) | HFNC+EDP(n=60) | t值 | P值 |
|---|---|---|---|---|
| 住NICU时间(d) | 33±14 | 28±9 | 2.307 | 0.023 |
| 出NICU时GCS | 5.9±2.1 | 7.8±0.4 | 6.594 | 0.000 |
| 出院时GCS | 9.9±2.1 | 11.0±2.0 | 3.056 | 0.003 |
注:NICU.神经重症监护病房;GCS.格拉斯哥评分;HFNC.经鼻高流量氧疗;HFNC+EDP.体外膈肌起搏器+经鼻高流量氧疗
脑出血后引起的脑肺交互、免疫抑制综合征、膈肌功能障碍和卒中相关性肺炎,是引起卒中后呼吸功能衰竭、MV的主要原因[7]。尽管MV可以挽救患者的生命,但长期应用可能带来许多并发症,如呼吸机相关肺炎、呼吸机相关膈肌功能不全(VIDD),导致脱机困难,影响重症脑出血术后患者的预后和转归[8]。有报道,MV患者膈肌发生废用性萎缩的速率是其他骨骼肌的8倍[9],且长时间MV患者导致膈肌血流供应能力下降,膈肌无力、萎缩和损伤,且通气时间越长,损害越重[10]。
HFNC可提供2~70 L/min的高流量氧气,浓度为21%~100%,恒温37℃,44 mg H2O/L(100%相对湿度),可改善拔管后低氧血症,降低呼吸频率和心率,降低再插管率,使患者更易于接受和耐受,因而近年来HFNC在神经重症气管切开MV患者脱机中得到逐渐应用[11]。研究表明,HFNC能有效增加气管切开患者的肺泡通气量,从而改善氧合,可能的原理是高流量所产生的压力对患者产生一定的呼气末正压[12]。HFNC提供的高流量气体会将二氧化碳(CO2)从上呼吸道中冲洗掉,避免了CO2的再次吸入,从而降低无效腔通气[13]。HFNC给予加温保湿气体,降低气道阻力,减少代谢做功,同时高流量温暖湿润的气流也可以减轻黏膜炎症、减少气道收缩,增加黏膜纤毛清除率,使痰液充分湿化易于咳出,降低呼吸道感染的风险。
膈肌是最主要的呼吸肌,膈肌移动增加1cm,产生约350 ml肺通气量,占静息肺活量的75%~80%[14]。VIDD是脱机困难的重要原因之一,但是HFNC对膈肌功能障碍影响较小,而EDP可以通过预防和治疗膈肌萎缩,预防和逆转膈肌损伤,增加膈肌肌力,提高膈肌耐力,从而对VIDD进行防治[15]。研究发现,EDP对膈神经加以低频电脉冲刺激,影响呼吸中枢传导通路,从而调节膈肌的运动节律和收缩强度,模拟正常生理状态下呼吸运动,改善呼吸功能。EDP刺激能使膈肌肌肉数量发生变化,增加膈肌的血供,从而预防和减少膈肌萎缩和损伤。研究发现,膈肌起搏可明显增强膈肌的自发肌电活动,增加呼吸肌肉锻炼,在MV48 h后即出现膈肌厚度下降,早期应用EDP能减少膈肌功能不全,提高撤机成功率。而且EDP通过刺激膈神经反射性的诱发咳嗽、刺激排痰,也通过增加膈肌移动度,在咳嗽时产生较大的胸腔内正压,从而提高咳嗽能力和气道廓清能力。
本研究使用HFNC+EDP后比HFNC更能使患者的OI稳定,说明HFNC+EDP能有效降低患者呼吸耗能,同时保证患者的氧合。HFNC+EDP组比HFNC组,膈肌移动度增加,脱机时间较短。因此,EDP通过刺激膈肌被动运动,联合HFNC可以促进患者调整呼吸节律、增加膈肌移动度、防止膈肌萎缩及促进痰液排除,有望为气切后拔管困难的重症脑出血患者提供一条新的有效治疗途径。
所有作者均声明不存在利益冲突



























