
探讨类风湿关节炎(RA)患者外周血中CD8+CD25+T细胞的比例变化及其临床意义。
收集2018年5—10月在北京大学人民医院住院的RA患者外周血38例和健康人外周血20名,并记录RA患者的各项临床表现和实验室指标[红细胞沉降率(ESR)、C反应蛋白(CRP)、环瓜氨酸抗体(CCP)],分离提取外周血中的淋巴细胞,利用流式细胞技术检测外周血中CD8+CD25+T细胞亚群的百分比,运用软件SPSS 22.0和GraphPadPrism 6分析其与实验室指标的相关关系及临床意义。
RA患者外周血CD8+CD25+T细胞表达明显高于健康对照组(P<0.05);RA患者外周血CD8+CD25+T细胞与ESR(r=0.352,P=0.030)、CCP(r=0.312,P=0.047)、DAS28(r=0.330,P=0.043)呈现明显正相关(P<0.05),和C3(r=-0.354,P=0.046)、C4(r=-0.440,P=0.010)呈明显负相关(P<0.05),和其他实验室指标无明显相关;在RA患者中CD8+CD25+T细胞在低疾病活动组和高疾病活动组之间差异有统计学意义(P<0.05),在低疾病活动组和中疾病活动组之间、中疾病活动组和高疾病活动组之间差异均无统计学意义。
RA患者外周血中CD8+CD25+T细胞升高,与实验室指标和疾病活动度明显相关,其可能在类风湿关节炎的发病过程中起重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
类风湿关节炎(RA)是一种以滑膜炎症和关节结构破坏为特征的慢性炎症性疾病。绝大多数未规范治疗的RA患者可出现全身多关节骨质破坏及功能丧失,在女性致残者中,关节病是首要的致残疾病,且79.4%为RA致残[1]。因此给我国家庭和社会带来巨大负担[2],提高RA诊疗水平,最大限度降低患者致残率,仍是一个有待解决的重大难题。
一直以来,CD4+T细胞被认为是介导RA发病的主要免疫细胞之一,其中Th1和Th17产生了诸如肿瘤坏死因子(TNF)-α、γ干扰素(IFN-γ)、白细胞介素(IL)-17等细胞因子,引发RA的炎症状态[3]。有研究发现,CD8+T细胞可能参与了类风湿关节炎的免疫病理过程[4],且CD8+CD25+T细胞在幼年型类风湿关节炎患者血液及滑膜液中明显升高[5]。这些数据均表明CD8+CD25+T细胞可能参与了RA的自身免疫调节过程。CD8+PD-1+T细胞和CD8+CXCR5+T细胞是CD8+T细胞的主要亚群,其在感染性疾病和肿瘤免疫机制中的研究颇多[6,7],但其在RA中的作用尚不清楚。本研究运用流式细胞技术测定RA患者外周血中上述CD8+T细胞亚群的百分比,分析CD8+CD25+T细胞与RA实验室指标及疾病活动度之间的关系,并探讨其在RA发病中的临床意义。
收集2018年5至10月北京大学人民医院病房的RA患者38例,入组时均有不同程度的病情活动,均稳定用过传统DMARDS药,如甲氨蝶呤、来氟米特等,且近3个月内未用过生物制剂或激素。入选患者均符合2010年美国风湿病学会(ACR)的"类风湿关节炎"诊断标准[8,9]。其中男10例,女28例,年龄45~73(61.59±10.77)岁。同时纳入20名年龄、性别匹配的健康人作为对照研究。本研究获得北京大学人民医院伦理委员会审查批准,所有参与研究的患者均签署知情同意书。
(1)流式抗体:Alexa Fluor 647Rat-Auti-Human CXCR5(BD Biosciences),PE抗人CD25(BioLegend,SanDiego,CA,美国),抗人PD-1(eBiosience Biotion),Brilliant Violet421抗人CD197(CCR7,BioLegend),PerCp抗人CD8(BioLegend),PE-CF594鼠-抗人CD161(BD,Biosciences,San Diego,CA,美国),Brilliant Violet605抗人CD127(BioLegend),AlexaFluor700抗人CD3(BioLegend),FITC抗人CD4(BioLegend),Brilliant Violet510抗人CD45RA(BioLegend)。(2)仪器:FACS Arial Ⅱ流式细胞仪(美国BD公司FACScan),奥林巴斯倒置显微镜(上海生物科技有限公司),Thermo微量低温离心机(北京医用离心厂),白洋低速大容量离心机(朗博卡科学仪器有限公司),磷酸盐缓冲液PBS(北京中杉金桥生物技术有限公司)等。
(1)分离外周血单个核细胞(PBMC):采集乙二胺四乙酸二钠(EDTA-Na2)抗凝静脉血3 ml,使用淋巴细胞分离液分离外周血淋巴细胞,使用PBS或生理盐水稀释细胞成1×106/ml浓度。(2)细胞染色:先将外周血淋巴细胞用PBS洗涤2次,然后使用荧光素标记的单抗染色,于4℃避光作用30 min,再用PBS洗涤2次去除未结合的抗体,使用0.5 ml 3%多聚甲醛固定细胞,最后使用流式细胞仪(美国BD公司FACScan)检测CD8+PD-1+T细胞、CD8+CD25+T细胞、CD8+CXCR5+T细胞等细胞亚群的表达水平、利用FlowJo软件分析样本中各细胞群的阳性表达。
应用SPSS 22.0进行统计分析,应用GraphPadPrism 6作图。计量资料以均值±标准差的形式表示。两组间比较采用配对t检验,多组间比较采用方差分析;CD8+CD25+T细胞和临床指标的相关性采用Spearman等级相关系数分析;P<0.05被认为差异有统计学意义。
本次试验纳入38例RA患者和20名年龄、性别都与之匹配的健康对照组。以下实验室及临床指标被应用于该研究中。
如表1所示是RA患者和健康对照组的临床和实验室特征。年龄、性别差异无统计学意义。RA患者的平均病程是从1.42至21.05年之间。DAS28评分是从2.59至6.25之间。
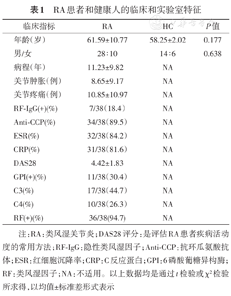
RA患者和健康人的临床和实验室特征
RA患者和健康人的临床和实验室特征
| 临床指标 | RA | HC | P值 |
|---|---|---|---|
| 年龄(岁) | 61.59±10.77 | 58.25±2.02 | 0.177 |
| 男/女 | 28∶10 | 14∶6 | 0.638 |
| 病程(年) | 11.23±9.82 | NA | |
| 关节肿胀(例) | 8.65±9.17 | NA | |
| 关节疼痛(例) | 10.85±10.97 | NA | |
| RF-IgG(+)(%) | 7/38(18.4) | NA | |
| Anti-CCP(%) | 34/38(89.5) | NA | |
| ESR(%) | 32/38(84.2) | NA | |
| CRP(%) | 31/38(81.6) | NA | |
| DAS28 | 4.42±1.83 | NA | |
| GPI(+)(%) | 11/38(30.4) | NA | |
| C3(%) | 17/38(44.7) | NA | |
| C4(%) | 10/38(26.3) | NA | |
| RF(+)(%) | 36/38(94.7) | NA |
注:RA:类风湿关节炎;DAS28评分:是评估RA患者疾病活动度的常用方法;RF-IgG:隐性类风湿因子;Anti-CCP:抗环瓜氨酸抗体;ESR:红细胞沉降率;CRP:C反应蛋白;GPI:6磷酸葡糖异构酶;RF:类风湿因子;NA:不适用。以上数据均是通过t检验或χ2检验所求得,以均值±标准差形式表示
通过对RA患者和健康对照组的CD8+T细胞不同亚群进行了分析比较,结果如图1所示。CD8+CD25+T细胞群在RA患者测定值为(4.06±2.67),在健康对照组测定值为(1.52±0.57),CD8+CD25+T细胞群在RA患者中明显高于健康对照组(图1A),差异有统计学意义(P<0.01)。而CD8+ PD-1+T、CD8+CXCR5+T细胞亚群在RA患者和健康对照中差异无统计学意义(P>0.05)(图1B,图1C)。
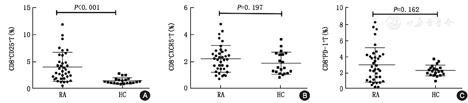

如图1看出,CD8+CD25+T细胞在RA患者中明显升高,为了解CD8+CD25+T细胞的升高与实验室指标有无关系,下面对CD8+CD25+T细胞做实验室指标的相关性分析。
如表2所示ESR(r=0.352,P=0.030)、CCP(r=0.3121,P=0.047)、DAS28(r=0.330,P=0.043)和CD8+CD25+T呈现正相关(P<0.05);C3(r=-0.354,P=0.046)、C4(r=-0.440,P=0.010)和CD8+CD25+T细胞呈现负相关(P<0.05);其他实验室指标和CD8+CD25+T细胞无明显相关。
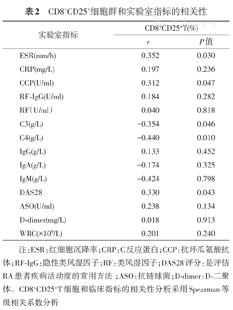
CD8+CD25+细胞群和实验室指标的相关性
CD8+CD25+细胞群和实验室指标的相关性
| 实验室指标 | CD8+CD25+T(%) | |
|---|---|---|
| r | P值 | |
| ESR(mm/h) | 0.352 | 0.030 |
| CRP(mg/L) | 0.197 | 0.236 |
| CCP(U/ml) | 0.312 | 0.047 |
| RF-IgG(U/ml) | 0.184 | 0.282 |
| RF(U/ml) | 0.040 | 0.818 |
| C3(g/L) | -0.354 | 0.046 |
| C4(g/L) | -0.440 | 0.010 |
| IgG(g/L) | 0.133 | 0.452 |
| IgA(g/L) | -0.174 | 0.325 |
| IgM(g/L) | -0.424 | 0.798 |
| DAS28 | 0.330 | 0.043 |
| ASO(U/ml) | 0.238 | 0.134 |
| D-dimer(mg/L) | 0.018 | 0.913 |
| WBC(×109/L) | 0.201 | 0.240 |
注:ESR:红细胞沉降率;CRP:C反应蛋白;CCP:抗环瓜氨酸抗体;RF-IgG:隐性类风湿因子;RF:类风湿因子;DAS28评分:是评估RA患者疾病活动度的常用方法;ASO:抗链球菌;D-dimer:D-二聚体。CD8+CD25+T细胞和临床指标的相关性分析采用Spearman等级相关系数分析
根据DAS28评分将38例RA患者样本分为3组(本研究所纳入的RA患者的DAS28评分的区间是0~9.6,其所表达的临床意义是:DAS28<2.6为疾病临床缓解,2.6≤DAS28<3.2为低疾病活动组,3.2≤DAS28<5.1为中疾病活动组,DAS28>5.1为高疾病活动组,图2)。
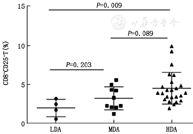

注:LDA,低疾病活动组;MDA,中疾病活动组;HDA,高疾病活动组
图2是分析比较低、中、高3组疾病活动组之间的CD8+CD25+T细胞表达有无差异。可以看出CD8+CD25+T细胞的表达在低疾病活动组和高疾病活动组之间差异有统计学意义(P<0.05),在低疾病活动组和中疾病活动组之间、中疾病活动组和高疾病活动组之间差异无统计学意义。
RA是一种以慢性破坏性关节炎为主要特征的自身免疫疾病,其发病和机体免疫功能紊乱相关。一直以来,T细胞过度活化被认为是RA发病的根本原因,RA患者体内常存在着异常活化的T细胞和(或)T细胞亚群数量的改变[10,11],因此,临床上用于治疗RA的甲氨蝶呤、来氟米特等一线抗风湿药物多基于这一作用机制:抑制T细胞活化,恢复T细胞亚群的比例[12]。研究RA患者体内细胞亚群的比例变化及其临床意义为进一步深入了解RA的发病机制提供线索。
研究发现RA患者外周血中CD8+CD25+T细胞亚群的比例较正常对照组显著升高,而且随着病情活动度的增高,CD8+CD25+T细胞亚群的增高有愈加显著的趋势;且CD8+CD25+T细胞亚群与实验室指标ESR、CCP、DAS28呈现明显正相关(P<0.05),与补体C3、C4呈明显负相关(P<0.05),和其他实验室指标无明显相关,说明CD8+CD25+T细胞很可能参与了RA的发病过程,该研究的发现再次为RA患者体内淋巴细胞活化机制假说[13]提供了证据。有研究发现RA患者滑膜中CD8+T细胞明显升高,且其可能在RA的发病过程中起关键作用[4]。也有研究发现CD8+CD25+T细胞在幼年型RA患者的外周血和滑膜中明显升高,经过一段有效抗风湿治疗后,两者中CD25的表达水平明显下降[5],进一步说明CD8+CD25+T细胞可能是RA发病中的一个重要致病细胞。RA患者外周血CD8+CD25+T细胞升高可能是由于T、B淋巴细胞的大量激活,这些炎细胞表面表达大量的免疫激活物和信号辅助分子,受到抗原的刺激分泌大量细胞因子(Th1、Th17、TNF-α、IFN-γ、IL-17等)及趋化因子(IL-8、CCR5等)[14,15],进而通过不同的信号传导通路,刺激CD8+T细胞CD25的表达,T细胞表面具有非特异性识别关节滑膜组织的Toll样受体,诱导关节组织的免疫反应,造成关节破坏。T细胞还分泌大量致炎因子,进一步促进炎症反应,这些免疫反应很大程度上促进了外周血和关节液中CD25的表达,这和之前报道的外周血和关节液中CD25升高相符合[16]。CD8+T细胞在RA发病过程中的作用也逐渐引起大家的关注,其具体的致病机制还有待进一步研究。我们或许可以通过检测关节液中的CD8+CD25+T细胞亚群来鉴别免疫性关节病。
有关RA的发病机制非常复杂,受多基因、多因子、多因素共同调控的结果。本研究存在局限性,尽管研究得出有意义的结果,但目前的研究仅仅是对CD8+CD25+T细胞和ESR、CRP等实验室及临床指标做了横断面单次检测,并且所采用的实验组和对照组样本例数较少,研究结果可能会出现偏移。在后续的研究中,将增加样本例数,密切观察CD8+CD25+T细胞群在RA的疾病发展及治疗过程中的变化,进一步探索该细胞群在RA的疾病发展中可能的治病机制,以明确CD8+CD25+T细胞群在RA发病中的重要作用,它可以为临床治疗类风湿关节炎提供部分理论依据。
所有作者均声明不存在利益冲突



























