
探讨右心声学造影检测心内或肺内右向左分流的价值。
回顾性分析中日友好医院2015年5月至2018年7月期间行右心声学造影检查的肺动脉高压患者74例临床资料。根据右心声学造影结果分为三组:心内分流组(<4个心动周期左心发现微泡)、肺内分流组(>4个心动周期内发现左心微泡)和声学造影阴性组(左心未测到微泡),比较各组间临床表现、功能分级、氧合及血流动力学特征,同时分析各组间合并神经系统并发症的差异。
74例患者中右心声学造影阳性28例(37.8%),包括心内分流11例(14.9%),肺内分流17例(23.0%)。心内分流阳性患者中有5例(6.8%)经胸心普通超声检查为阴性,2例肺内分流患者证实为遗传性出血性毛细血管扩张症(HHT),1例为不明原因的肺动静脉畸形(PAVM)。三组患者的临床症状、世界卫生组织(WHO)心功能分级、脑钠肽前体(NT-proBNP)水平、动脉血氧分压(PO2)、肺动脉平均压(mPAP)、右房压(RAP)、肺血管阻力(PVR)、心排血量(CO)差异均无统计学意义(均P>0.05)。5例(6.8%)患者存在神经系统合并症,包括4例(5.4%)脑梗死、1例(1.4%)癫痫,其中2例患者临床评估脑梗死为心内分流继发的矛盾性栓塞。三组比较,心内分流组患者存在神经系统合并症比例更高(P<0.05)。
右心声学造影检测右向左分流对肺动脉高压的病因诊断有补充价值,是否存在分流对患者病情严重程度无明显影响,但合并心内分流者发生神经系统并发症的风险增加。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺动脉高压与心内或肺内血液分流常互为因果。一方面,心内分流性疾病如室间隔或房间隔缺损、肺内分流性疾病如遗传性出血性毛细血管扩张症(HHT)可以导致肺动脉高压[1,2];另一方面,肺动脉高压患者由于右心压力增加也可继发卵圆孔重新开放,产生心内右向左分流[3],分流的血液不经氧合直接回流入左心,进一步加重患者的缺氧[4];更重要的是,缺少肺毛细血管的过滤作用后,分流可导致静脉系统的栓子(尤其是微血栓)直接进入体循环系统,发生动脉栓塞,尤其是中枢神经系统并发症如短暂脑缺血发作、脑梗死、偏头痛等显著增加[5,6]。
经胸心脏超声是筛查肺动脉高压最主要的手段,但常规经胸心脏超声检查因声窗问题容易漏诊某些心内分流性疾病,更无法检测肺内动静脉分流[7]。右心声学造影是一项特殊的心脏超声检查方法,通过静脉注射震荡的生理盐水达到心腔显影效果,对于诊断或排除心内或肺内右向左分流性疾病具有重要价值[8]。
本研究总结肺动脉高压患者右心声学造影检查发现右向左分流的情况,探讨心内或肺内右向左分流在肺动脉高压病因诊断与病情评估中的价值。
2015年5月至2018年7月在中日友好医院诊断并完成右心声学造影检查的肺动脉高压患者的临床资料。
经右心导管检查平均肺动脉压≥25 mmHg(1 mmHg=0.133 kPa)[1]且行声学造影检查而诊断。所有患者均完成经胸心脏超声、肺功能、CT肺动脉造影、肺通气灌注扫描及右心导管检查。
本研究符合赫尔辛基宣言原则。
右心声学造影检查采用手振生理盐水法,方法如下:取两支10 ml注射器,一支抽取9 ml生理盐水和1 ml空气,通过三通开关将两支注射器相连,来回快速推注30次,使生理盐水和空气充分混合成含细小微泡的乳白色混合液,经上肢贵要静脉快速推入。经胸右心声学造影选取胸骨旁四腔心切面和心尖四腔心切面,观察造影剂在心脏显影情况,右心显影后4个心动周期内在左心发现微泡作为心脏水平分流阳性,4个以上心动周期发现左心微泡作为肺内分流阳性[7]。右心声学造影发现存在房间隔缺损或卵圆孔未闭者,进一步经食道超声心动图明确诊断。
针对所有入组的患者,收集以下资料:(1)临床基本情况:性别、年龄、发病时间、既往病史、合并症;(2)临床表现:症状、体征、世界卫生组织(WHO)肺动脉高压功能分级;(3)实验室及辅助检查:血气分析、脑钠肽、心脏超声与右心声学造影检查、经食道超声心动图、肺功能、右心导管检查结果,包括肺动脉压、右房压、肺血管阻力及心排血量,心排血量均采用Fick法测得。
统计右心声学造影发现心脏水平或肺内分流的阳性率,并根据右心声学造影结果将患者分为三组:心内分流组、肺内分流组和声学造影阴性组。比较各组患者在人口学资料、临床表现、肺动脉高压功能分级、动脉血氧分压、肺循环血流动力学参数及神经系统并发症的差异。
采用SPSS 19.0统计软件进行分析,正态分布计量资料以 ±s描述,组间比较采用F检验;非正态分布计量资料以M(Q1,Q3)描述,组间比较采用Kruskal-Wallis秩和检验;计数资料以例数(%)描述,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
±s描述,组间比较采用F检验;非正态分布计量资料以M(Q1,Q3)描述,组间比较采用Kruskal-Wallis秩和检验;计数资料以例数(%)描述,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
共74例肺动脉高压患者完成右心声学造影,其中男31例(41.9%),女43例(58.1%),年龄(46.2±16.5)岁。声学造影阴性组46例(62.2%),心内分流组11例(14.9%),肺内分流组17例(23.0%);不同类型肺动脉高压患者右心声学造影发现右向左分流情况见表1。在心内分流11例患者中有5例经胸心普通超声检查为分流阴性;肺内分流17例患者中有2例证实为HHT,1例为不明原因的肺动静脉畸形(PAVM),其余14例肺内分流未能发现明确的解剖结构异常。
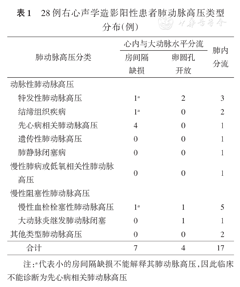
28例右心声学造影阳性患者肺动脉高压类型分布(例)
28例右心声学造影阳性患者肺动脉高压类型分布(例)
| 肺动脉高压分类 | 心内与大动脉水平分流 | 肺内分流 | ||
|---|---|---|---|---|
| 房间隔缺损 | 卵圆孔开放 | |||
| 动脉性肺动脉高压 | ||||
| 特发性肺动脉高压 | 1a | 2 | 3 | |
| 结缔组织疾病 | 1a | 0 | 2 | |
| 先心病相关肺动脉高压 | 4 | 0 | 1 | |
| 遗传性肺动脉高压 | 0 | 0 | 1 | |
| 肺静脉闭塞病 | 0 | 0 | 1 | |
| 慢性肺病或低氧相关性肺动脉高压 | 0 | 0 | 1 | |
| 慢性阻塞性肺动脉高压 | ||||
| 慢性血栓栓塞性肺动脉高压 | 1a | 1 | 5 | |
| 大动脉炎继发肺动脉闭塞 | 0 | 1 | 1 | |
| 其他类型肺动脉高压 | 0 | 0 | 2 | |
| 合计 | 7 | 4 | 17 | |
注:a代表小的房间隔缺损不能解释其肺动脉高压,因此临床不能诊断为先心病相关肺动脉高压
心内分流组、肺内分流组、声学造影阴性组患者的人口学资料、临床表现、功能分级、动脉血氧分压及肺循环血流动力学特征的比较见表2。三组患者的年龄、性别、体表面积、发病时的伴随症状(呼吸困难、胸痛、晕厥、咯血等)、心脏超声估测的肺动脉收缩压水平之间差异均无统计学意义(均P>0.05);不同分流情况患者的肺循环血流动力学参数比较,三组之间在心功能分级、动脉血氧分压、脑钠肽水平、肺动脉平均压、肺血管阻力、右房压及心排血量比较差异均无统计学意义(均P>0.05)(表2)。
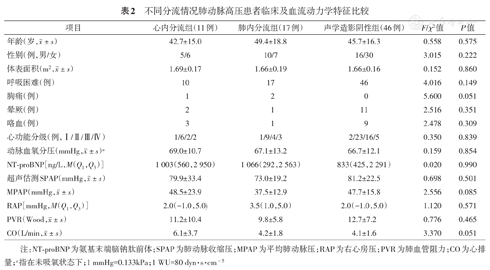
不同分流情况肺动脉高压患者临床及血流动力学特征比较
不同分流情况肺动脉高压患者临床及血流动力学特征比较
| 项目 | 心内分流组(11例) | 肺内分流组(17例) | 声学造影阴性组(46例) | F/χ2值 | P值 |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 42.7±15.0 | 49.4±18.8 | 45.7±16.3 | 0.558 | 0.575 |
| 性别(例,男/女) | 5/6 | 10/7 | 16/30 | 3.015 | 0.222 |
体表面积(m2, ±s) ±s) | 1.69±0.17 | 1.66±0.19 | 1.66±0.16 | 0.152 | 0.860 |
| 呼吸困难(例) | 10 | 17 | 46 | 4.016 | 0.149 |
| 胸痛(例) | 1 | 2 | 0 | 5.600 | 0.051 |
| 晕厥(例) | 2 | 1 | 11 | 2.516 | 0.351 |
| 咯血(例) | 3 | 1 | 9 | 2.478 | 0.309 |
| 心功能分级(例,Ⅰ/Ⅱ/Ⅲ/Ⅳ) | 1/6/2/2 | 1/9/4/3 | 2/23/16/5 | 0.350 | 0.839 |
动脉血氧分压(mmHg, ±s)a ±s)a | 69.0±10.7 | 67.1±13.2 | 66.7±12.1 | 0.159 | 0.854 |
| NT-proBNP[ng/L,M(Q1,Q3)] | 1 003(560,2 950) | 1 066(292,2 563) | 833(425,2 291) | 0.020 | 0.990 |
超声估测SPAP(mmHg, ±s) ±s) | 79.9±33.4 | 73.0±19.2 | 81.2±22.5 | 0.698 | 0.501 |
MPAP(mmHg, ±s) ±s) | 48.5±23.9 | 37.5±12.9 | 47.7±15.8 | 2.556 | 0.085 |
| RAP[mmHg,M(Q1,Q3)] | 2.0(-1.0,5.0) | 3.5(1.0,5.0) | 2.0(-1.0,5.0) | 1.120 | 0.571 |
PVR(Wood, ±s) ±s) | 11.2±10.4 | 9.8±5.8 | 12.7±7.2 | 0.776 | 0.465 |
CO(L/min, ±s) ±s) | 6.1±3.7 | 4.2±1.8 | 4.1±1.6 | 3.370 | 0.051 |
注:NT-proBNP为氨基末端脑钠肽前体;SPAP为肺动脉收缩压;MPAP为平均肺动脉压;RAP为右心房压;PVR为肺血管阻力;CO为心排量;a指在未吸氧状态下;1 mmHg=0.133kPa;1 WU=80 dyn·s·cm-5
74例患者中,5例(6.8%)存在神经系统合并症,包括4例脑梗死、1例癫痫。心内分流组11例患者中有4例存在神经系统合并症,包括2例临床评估为心内分流继发的矛盾性栓塞导致的脑梗死;声学造影阴性组则有1例合并脑梗死;肺内分流组患者中均未发现神经系统合并症。所有患者均无偏头痛、短暂脑缺血发作等合并症。三组比较,心内分流组存在神经系统合并症比例更高(P<0.05)。
肺动脉高压常与分流性疾病互为因果,心内或肺内分流性疾病可引起肺动脉高压[1,2],另一方面,严重肺动脉高压也可继发卵圆孔开放,导致右向左分流[3]。因此,对于常规检查不能明确病因的肺动脉高压、或伴有严重缺氧的肺动脉高压患者,临床上常需检查是否存在心内或肺内分流性疾病[9,10]。
本研究显示,肺动脉高压患者存在右向左分流的比率并不低,多数心内分流为肺动脉高压继发的卵圆孔重新开放,少数分流为肺动脉高压的病因,包括房间隔缺损及HHT,提示右心声学造影对于肺动脉高压的病因具有提示诊断价值。本组资料中,多数肺内分流并未发现任何肺血管解剖异常因素,如PAVM、肝肺综合征等,有关肺内分流的机制尚不清楚。既往有研究发现,健康人群暴露于缺氧环境时肺内潜在的动静脉交通支可重新开放,出现少量肺内分流[11,12],因此可以推测,肺动脉高压患者也可能继发肺内动静脉交通支开放,以代偿性地减轻肺血管阻力。
右向左分流发生后,分流的血液不经氧合直接汇入左心,可加重患者缺氧[4],因此推测,是否合并分流与患者缺氧及疾病严重程度有关。但本研究并未发现不同分流情况患者缺氧情况的差异,可能与本组资料心内分流的比例少有关,而多数肺内分流的分流量小,对氧合的影响小。另外,本研究也未发现不同分流情况患者间心功能分级以及血流动力学参数等的差异,由于分流本身可缓解肺动脉压力,因此推测,分流也可能是肺动脉高压的一种自身调节机制,这可能是研究未发现差异的原因。另外,不同类型肺动脉高压患者预后差别很大[13],本研究中包含不同类型肺动脉高压,混杂因素也可能抵消了分流对疾病严重程度的影响。右向左分流可导致矛盾性栓塞,包括短暂脑缺血发作、脑梗死等[14]。本研究结果显示,心内分流组患者合并中枢神经系统疾病风险增加,而肺内分流组并未显示出相关风险,可能与分流量大小不同有关[15]。
作为回顾性研究,本研究的病例选择可能存在偏倚。研究纳入多种不同类型的肺动脉高压,某些类型患者的病例数偏少,难以完全反映不同类型肺动脉高压患者的实际情况。另外,研究对于分流量并未纳入分析,也无法判断右向左分流对患者远期预后的影响。
综上所述,肺动脉高压患者存在右向左分流的比率并不低,右心声学造影检查可发现普通经胸心脏超声无法发现的心内或肺内分流,对某些不明原因的肺动脉高压具有诊断价值,是否存在右向左分流对于肺动脉高压患者的严重程度无明显影响,但出现心内分流者合并神经系统并发症风险增加。
所有作者均声明不存在利益冲突



























