
观察LRFN4在结直肠癌中的表达及其临床意义。
分别收集2002年1月至2008年12月南通大学附属医院进行结直肠癌手术的210例结直肠癌患者癌组织,228例对应手术切缘(非癌组织),采用免疫组织化学法检测LRFN4蛋白表达情况,并分析其与临床病理特征及预后的关系。
结直肠癌组织中LRFN4的阳性表达率为55.24%(116/210),非癌组织中LRFN4的阳性表达率为37.28%(85/228),差异有统计学意义(χ2=14.196,P<0.001)。结直肠癌组织中LRFN4的表达与肿瘤部位(χ2=4.133,P=0.042)、肿瘤浸润深度(T分期)(χ2=6.494,P=0.039)、区域淋巴结转移(N分期)(χ2=11.715,P=0.008)、TNM分期(χ2=13.398,P=0.004)、癌胚抗原(CEA)(χ2=6.017,P=0.049)显著相关,而与患者性别、年龄、分化程度、远处转移(M分期)无显著相关(P>0.05)。经Kaplan-Meier生存曲线统计分析,LRFN4在结直肠癌中的高表达与患者总生存率升高相关(P<0.05)。此外,我们对其进行Cox比例风险模型统计分析,LRFN4的高表达(HR=0.585,P=0.018)是结直肠癌患者预后良好的独立危险因素。
LRFN4在结直肠癌组织中高表达,且与临床病理特征及预后密切相关,LRFN4高表达显著降低了患者的死亡风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是最常见的消化道恶性肿瘤之一,在过去的几十年中,我国的结直肠癌发病率和死亡率呈上升趋势[1],这种趋势是由饮食结构改变,采用西化生活方式以及癌症早期发现和早期治疗的不足导致的[2]。目前,我国结直肠癌5年生存率远低于美国和日韩,患者的5年生存率仍低于40%[3]。因此,筛选有效且灵敏的结直肠癌分子标志物对其预防、早期诊断和改善预后具有重要的意义。
富含亮氨酸的重复序列和含纤连蛋白Ⅲ型结构域的蛋白质(LRFN)家族蛋白被认为是神经元特异性蛋白质,其在神经突生长和突触形成中发挥重要作用[4,5]。研究发现,LRFN4在多种肿瘤和白血病细胞系中表达[6]。但目前国内外尚未见LRFN4在结直肠癌中的研究报道。本研究采用210例结直肠癌组织及非癌组织(对应手术切缘)制作组织芯片,用免疫组织化学法和统计学方法进行研究观察,分析LRFN4与结直肠癌患者的临床病理特征及预后的关系,探讨LRFN4在结直肠癌发生发展及预后中的作用。
Oncomine数据库(http://www.oncomIne. org/)收集、分析肿瘤样本的基因表达谱芯片数据,提供肿瘤转录组数据。目前,Oncomine已收集了来自715个数据集的86 733个样本,能帮助我们筛选一些值得研究的靶分子或预测表型。在本研究中,从Oncomine数据库提取数据。首先在该数据库中设定检索条件,设定条件具体如下:(1)Gene:LRFN4;(2)Primary Filters-Analysis Type:Cancer vs. NormalAnalysis;(3)Cancer Type:Colorectal Cancer;(4)Sample Type:Clinical Specimen;(5)Data Type:mRNA。在候选的结果中选择呈现形式,显示LRFN4 mRNA在结直肠癌组织与正常组织之间表达的倍数关系、P值等。
TCGA数据库(http://cancergenome.nih.gov/)主要储存关于各类肿瘤的基本信息,它是目前为止可以获得的公开数据库里面数据相对全面的一个。在本次研究中,首先从TCGA数据库提取标本数据信息。该数据库中设定检索条件如下:(1) Cases选项,Primary Site: Colorectal。(2)Files选项,Transcriptome Profiling, Biospecimen, Clinical; Date type: Gene Expression Quantification, BiospecimenSupplement, Clinical Supplement; Experimental Strategy: RNA-Seq。分别下载Manifest、Metadata及Cart文件进行分析。
收集2002年1月至2008年12月期间于南通大学附属医院普外科手术切除后病理证实结直肠癌患者的癌组织210例(男77例,女133例),非癌组织228例。临床信息(包括性别、年龄、肿瘤部位、分化程度、浸润深度、淋巴结转移等)来自病案记录。本研究通过南通大学附属医院伦理委员会审核批准(2018-K020)。所有纳入患者均签署知情同意书。
收集上述病例所对应石蜡组织,光学显微镜下复检,并用记号笔标记取芯位置,用手动组织芯片仪(Quick-Ray,韩国UNITMA公司)取直径为2.0 mm的组织制成组织微阵列(TMA)芯片蜡块。将TMA切片经脱蜡水化和抗原修复后,滴加兔抗人LRFN4多克隆抗体[1∶200稀释,R&D systems(US),Monoclonal ms IgG,Clone#578102,Cat. MAB5445],磷酸盐缓冲液(PBS)冲洗后,滴加Elivison二抗试剂盒(福州迈新公司,中国)。免疫组化染色阳性结果为细胞质内出现棕黄色或棕褐色颗粒,在高倍镜下(×400)观察。免疫染色由两名不了解病例临床背景的训练有素的病理学家独立评估。阳性细胞染色强度分值如下:0分(阴性),1分(弱阳性),2分(中等阳性),3分(强阳性)。每个组织芯片点的阳性细胞百分比记录为0~100%,染色强度和阳性细胞百分比的乘积作为LRFN4染色的最终评分[7]。用X-tile软件(美国耶鲁大学)[8]检测LRFN4染色评分和预后的临界值。
LRFN4蛋白在结直肠癌组织与对照组中的表达差异及其与各临床病理参数之间的关系分析采用χ2检验;单个临床病理参数与结直肠癌患者生存期的分析采用Log-rank单因素生存分析;有统计学意义因素和结直肠癌预后相关特征的多因素分析采用Cox比例风险回归模型;采用Kaplan-Meier方法对LRFN4蛋白表达与结直肠癌患者5年生存率进行评估。分析采用SPSS 20.0统计软件进行,以P<0.05为差异有统计学意义。
1.Oncomine数据库及TCGA数据库含有大量肿瘤样本转录组数据,我们在Oncomine数据库和TCGA数据库中提取LRFN4基因在mRNA水平上均显示LRFN4在癌组织中mRNA的表达显著高于正常组织(P<0.05)(图1)。


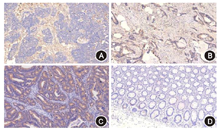
2.LRFN4在结直肠癌组织及非癌组织中的蛋白表达与定位:LRFN4阳性染色主要定位于癌组织的细胞质中,良性组织中没有明显表达(图2)。X-tile软件检测评分以0~150分为低或无表达,>150~300分为高表达时,LRFN4蛋白高表达与患者预后良好明显相关。经χ2分析后结果显示,结直肠癌组织中LRFN4阳性表达率为55.24%(116/210),非癌组织中LRFN4的阳性表达率为37.28%(85/228),差异有统计学意义(χ2=14.196,P<0.001)。

3.结直肠癌组织中LRFN4的蛋白表达与临床病理特征的关系:在结直肠癌患者中,LRFN4蛋白阳性表达与肿瘤部位(χ2=4.133,P=0.042)、肿瘤浸润深度(T分期)(χ2=6.494,P=0.039)、区域淋巴结转移(N分期)(χ2=11.715,P=0.008)、TNM分期(χ2=13.398,P=0.004)、CEA(χ2=6.017,P=0.049)显著相关,而与患者性别、年龄、分化程度、远处转移(M分期)无显著相关(P>0.05)(表1)。
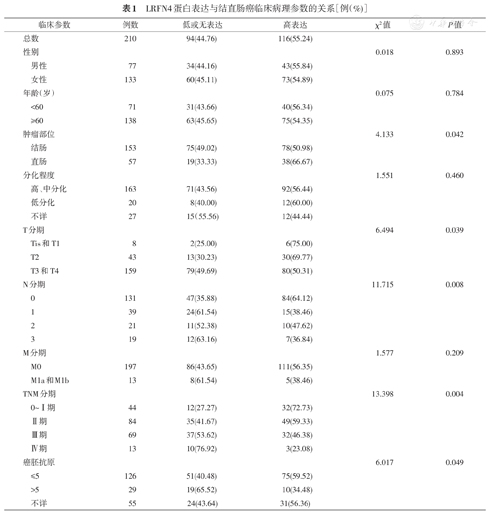
LRFN4蛋白表达与结直肠癌临床病理参数的关系[例(%)]
LRFN4蛋白表达与结直肠癌临床病理参数的关系[例(%)]
| 临床参数 | 例数 | 低或无表达 | 高表达 | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 总数 | 210 | 94(44.76) | 116(55.24) | |||
| 性别 | 0.018 | 0.893 | ||||
| 男性 | 77 | 34(44.16) | 43(55.84) | |||
| 女性 | 133 | 60(45.11) | 73(54.89) | |||
| 年龄(岁) | 0.075 | 0.784 | ||||
| <60 | 71 | 31(43.66) | 40(56.34) | |||
| ≥60 | 138 | 63(45.65) | 75(54.35) | |||
| 肿瘤部位 | 4.133 | 0.042 | ||||
| 结肠 | 153 | 75(49.02) | 78(50.98) | |||
| 直肠 | 57 | 19(33.33) | 38(66.67) | |||
| 分化程度 | 1.551 | 0.460 | ||||
| 高、中分化 | 163 | 71(43.56) | 92(56.44) | |||
| 低分化 | 20 | 8(40.00) | 12(60.00) | |||
| 不详 | 27 | 15(55.56) | 12(44.44) | |||
| T分期 | 6.494 | 0.039 | ||||
| Tis和T1 | 8 | 2(25.00) | 6(75.00) | |||
| T2 | 43 | 13(30.23) | 30(69.77) | |||
| T3和T4 | 159 | 79(49.69) | 80(50.31) | |||
| N分期 | 11.715 | 0.008 | ||||
| 0 | 131 | 47(35.88) | 84(64.12) | |||
| 1 | 39 | 24(61.54) | 15(38.46) | |||
| 2 | 21 | 11(52.38) | 10(47.62) | |||
| 3 | 19 | 12(63.16) | 7(36.84) | |||
| M分期 | 1.577 | 0.209 | ||||
| M0 | 197 | 86(43.65) | 111(56.35) | |||
| M1a和M1b | 13 | 8(61.54) | 5(38.46) | |||
| TNM分期 | 13.398 | 0.004 | ||||
| 0~Ⅰ期 | 44 | 12(27.27) | 32(72.73) | |||
| Ⅱ期 | 84 | 35(41.67) | 49(59.33) | |||
| Ⅲ期 | 69 | 37(53.62) | 32(46.38) | |||
| Ⅳ期 | 13 | 10(76.92) | 3(23.08) | |||
| 癌胚抗原 | 6.017 | 0.049 | ||||
| ≤5 | 126 | 51(40.48) | 75(59.52) | |||
| >5 | 29 | 19(65.52) | 10(34.48) | |||
| 不详 | 55 | 24(43.64) | 31(56.36) | |||
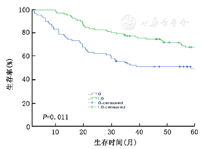
4.影响结直肠癌患者的单因素和多因素生存分析:LRFN4的表达、T分期、N分期、TNM分期与结直肠癌患者的不良预后相关。将上述单因素引入多因素Cox回归模型分析发现LRFN4的表达、TNM分期是结直肠癌患者独立预后的指标。K-M plot生存曲线图显示了高表达的LRFN4结直肠癌患者相比于低表达LRFN4的患者有较长的生存期(图3)。LRFN4高表达显著降低了患者的死亡风险,可作为结直肠癌患者独立的预后因子(表2)。在癌组织中,随着恶性程度提高,其表达降低;并且预后良好的组中LRFN4的表达高于预后差的组,是一个独立的预后因素。
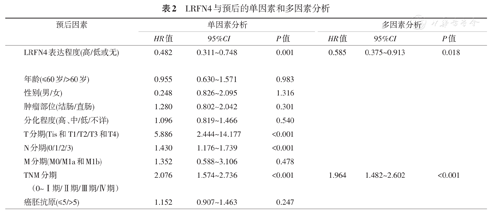
LRFN4与预后的单因素和多因素分析
LRFN4与预后的单因素和多因素分析
| 预后因素 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |
| LRFN4表达程度(高/低或无) | 0.482 | 0.311~0.748 | 0.001 | 0.585 | 0.375~0.913 | 0.018 |
| 年龄(≤60岁/>60岁) | 0.955 | 0.630~1.571 | 0.983 | |||
| 性别(男/女) | 0.248 | 0.826~2.095 | 1.316 | |||
| 肿瘤部位(结肠/直肠) | 1.280 | 0.802~2.042 | 0.301 | |||
| 分化程度(高、中/低/不详) | 1.096 | 0.819~1.466 | 0.540 | |||
| T分期(Tis和T1/T2/T3和T4) | 5.886 | 2.444~14.177 | <0.001 | |||
| N分期(0/1/2/3) | 1.430 | 1.176~1.739 | <0.001 | |||
| M分期(M0/M1a和M1b) | 1.352 | 0.588~3.106 | 0.478 | |||
| TNM分期(0~Ⅰ期/Ⅱ期/Ⅲ期/Ⅳ期) | 2.076 | 1.574~2.736 | <0.001 | 1.964 | 1.482~2.602 | <0.001 |
| 癌胚抗原(≤5/>5) | 1.152 | 0.907~1.463 | 0.247 | |||

LRFN又称为突触黏附样分子(SALM),LRFN家族共有5名已知成员(LRFN 1-5),这些分子拥有相似的结构域,但却有各自不同的功能[9,10]。以前的研究报道LRFN家族成员的表达和功能主要限于神经组织[4,5],而最近Kuuselo等[11]研究发现LRFN1参与了胰腺癌细胞的存活,通过siRNA下调LRFN1导致胰腺癌细胞存活率在统计学上显著降低。Konakahara等[6]发现,在某些癌细胞系中表达LRFN4,例如Panc-1、JURKAT-1和MKN7。在本研究中,我们发现LRFN4蛋白主要定位于结直肠癌细胞的细胞质中,LRFN4在结直肠癌组织中的表达情况与肿瘤部位、肿瘤浸润深度(T分期)、区域淋巴结转移(N分期)、TNM分期、CEA显著相关。Kaplan-Meier生存曲线统计分析及Cox比例风险模型统计显示,LRFN4高表达与患者总生存率升高显著相关,显著降低了患者的死亡风险,这提示LRFN4蛋白的高表达在结直肠癌中可能起着抑制肿瘤进展的作用,并且可用于评估患者预后。同时,Oncomine和TCGA数据分析显示,LRFN4在结直肠癌中上调,这提供了另一层证据,表明LRFN4可能积极参与了结直肠癌的调控和发展。
肿瘤不仅由自主的恶性细胞组成,还由成纤维细胞、内皮细胞、免疫细胞和特异的间充质细胞组成。肿瘤细胞可以募集这些不同类型的基质细胞以促进肿瘤生长并向远处转移[12]。重要的是,肿瘤浸润的免疫细胞,特别是肿瘤边缘处巨噬细胞的存在,通过诱导和维持肿瘤血管生成,可以刺激肿瘤细胞增殖,组织浸润,并向远处转移。据报道LRFN4表达在具有巨噬细胞分化的单核细胞中被上调。此外,LRFN4信号传导在诱导单核细胞/巨噬细胞向炎症区域的迁移中起着至关重要的作用[6]。因此,我们推测LRFN4可能参与了结直肠癌的传播和复发过程,诱导巨噬细胞免疫,肿瘤细胞生长受限制,但随着肿瘤进展,或者蛋白表达降低,该免疫机制难以抵挡,患者预后差。
尽管如此,我们的研究仍存在一些局限性。我们需要对一般人群进行更大的前瞻性研究,以纠正回顾性观察研究的缺陷。此外,需要进一步的试验来确定LRFN4是否在结直肠癌中充当肿瘤抑制因子,以及需要阐明LRFN4在结直肠癌发生、发展、转移过程中的信号传导途径和潜在机制。
总之,LRFN4在结直肠癌中高表达,具有重要的临床意义。本课题组将在结直肠癌细胞系中进一步研究LRFN4表达差异,通过更多的试验来证实LRFN4基因在结直肠癌发生发展中的作用机制,使其能成为结直肠癌的有效预测指标,亦有望成为肿瘤生物治疗的新靶点。
所有作者均声明不存在利益冲突



























