
设计建立泌尿系统结石代谢评估数据库,并利用该数据库对患者进行代谢评估及结石防治指导。
本代谢评估数据库应用JAVA语言开发,使用Oracle11g数据库和浏览器/服务器架构进行构建。本研究从数据库中提取所有临床资料完整患者的相关数据,并对结石危险因素及相关病史、血尿检验及24 h尿检验结果等进行分析。
共纳入360例明确诊断为结石的患者,男女比例为1.9∶1,患者首次诊断结石时的年龄为(35.5±13.5)岁,结石家族史阳性者占39.7%,代谢综合征占35.0%。男性和女性患者超重或肥胖分别占73.2%和50.0%,腹型肥胖分别占62.3%和56.1%。结石患者存在明显尿液异常,其中高钠尿占67.5%,高钙尿占53.6%,低枸橼酸尿占41.1%,高尿酸尿占29.7%,低镁尿占22.5%,高草酸尿占15.8%,高磷尿占11.7%,低尿量者占36.4%。
结石患者超重或肥胖、腹型肥胖、高血压、糖尿病、代谢综合征的患病率均明显高于普通人群。对高尿钠、低尿量、肥胖、代谢综合征等结石危险因素的干预是结石治疗的重要手段。该结石代谢评估数据库有助于高效开展结石代谢评估工作,并为结石治疗和预防提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
泌尿系统结石是泌尿外科的常见疾病,患病率达1.7%~14.8%,而且在全球范围内逐渐增加[1]。代谢评估是结石诊治的重要部分,可以为发现成石危险因素、个体化治疗和预防等提供重要依据。但由于结石患者病情复杂、数据量庞大及随访过程繁琐等原因,代谢评估在临床工作中开展十分困难。相关研究常通过从政府调查或其他大型临床研究中提取与结石相关的代谢数据来探索结石的危险因素[2]。因此常缺乏对结石危险因素、结石相关病史、24 h尿检、结石影像数据等的详细描述。虽然章璟等[3]建立了结石全程管理的数据库,但其主要针对住院患者。为了对所有结石患者进行系统的代谢评估,本研究建立了专业的泌尿系统结石代谢评估数据库,应用该数据库对患者进行代谢评估,以指导结石的治疗和预防,并探索可干预的结石危险因素。
回顾性病例分析。病例选自2016年6月1日至2019年6月1日就诊于北京协和医院泌尿系统结石专病门诊并被收入泌尿系统结石代谢评估数据库的患者。
(1)在既往或此次就诊中明确诊断泌尿系统结石;(2)已签署患者知情同意书。
(1)未完成数据库中所有代谢评估项目;(2)年龄<18岁;(3)感染性结石;(4)正在服用可能影响检查结果的药物;(5)近1个月内出现过以下情况之一者:肾绞痛急性发作,体内存在明确需要外科能处理的结石,进行外科治疗(手术、体外碎石、肾造瘘),严重泌尿系统感染,存在结石造成的明确梗阻,上泌尿系统内有支架或引流管。
该系统以JAVA语言开发,使用Oracle11g数据库,浏览器/服务器架构构建。在数据库设计初期,引用国际疾病与相关健康问题统计分类(ICD)第九版、ICD-10和卫生部相关元数据标准作为字典库,形成结构化问卷采集数据,支持在数据分析阶段根据不同的问卷自动生成支持SAS等分析软件使用的数据源。在数据采集阶段根据临床数据采集标准范围设置数据采集校验规则,数据采集的同时即完成数据的校验,能够采用字典数据进行标准化录入。在数据分析阶段采用临床、科研镜像分离的方式,在保证业务系统正常的情况下提高数据分析的效率。该数据库所包含的临床资料包括6部分:基本信息、结石危险因素、结石相关病史、血尿检验、影像学数据和24 h尿检验结果。其中基本信息、结石危险因素、结石相关病史由门诊医生直接对患者进行询问采集;血尿检验、24 h尿检验结果由我院检验科提供;影像学数据中的CT由影像科提供。
(1)24 h尿液收集完全的标准:男24 h尿肌酐13~18 mmol,女24 h尿肌酐7~13 mmol。(2)尿液成分异常的诊断标准:依据2018年欧洲泌尿外科协会制定的泌尿系统结石指南中24 h尿检验结果的参考范围:24 h尿草酸>0.5 mmol/d为高草酸尿;24 h尿尿酸,男>5 mmol/d,女>4 mmol/d为高尿酸尿;24 h尿枸橼酸,男<1.7 mmol/d,女<1.9 mmol/d为低枸橼酸尿;24 h尿镁<3.0 mmol/d为低镁尿;24 h尿磷>35 mmol/d为高磷尿;24 h尿钙<5 mmol/d为高钙尿[4];24 h尿钠>150 mmol/d为高钠尿,24 h总尿量<2 000 ml为低尿量[5]。(3)代谢综合征(MetS)的诊断依据2005年国际糖尿病联盟标准[6]。(4)血脂异常诊断标准:满足以下4条中任意1条:①血总胆固醇≥5.17 mmol/L,②血总三酰甘油>1.7 mmol/L,③低密度脂蛋白胆固醇≥3.36 mmol/L,④男性高密度脂蛋白胆固醇<1.03 mmol/L,或女性高密度脂蛋白胆固醇<1.29 mmol/L[7]。(5)以血尿酸>380 μmol/L作为高尿酸血症诊断标准。超重:体质量指数(BMI)24.0~27.9 kg/m2,肥胖:BMI≥28.0 kg/m2。(6)估算的肾小球滤过率(eGFR)的计算根据MDRD公式。
采用SPSS 23.0统计软件进行统计分析,计量资料采用 ±s表示。独立样本t检验用于组间比较。χ2检验用于两个率或两个构成比的比较。本研究样本中患病率与全部人群中患病率的比较采用大样本率的Z检验。计数资料用百分比(%)表示。P<0.05为差异有统计学意义。
±s表示。独立样本t检验用于组间比较。χ2检验用于两个率或两个构成比的比较。本研究样本中患病率与全部人群中患病率的比较采用大样本率的Z检验。计数资料用百分比(%)表示。P<0.05为差异有统计学意义。
共360例患者完成了代谢评估并被纳入该统计。男234例,女126例。所有患者的性别、首次诊断结石时的年龄、纳入数据库时的年龄、结石家族史、肾脏功能、MetS的情况以及合并全身代谢性疾病的情况如表1所示。eGFR>90 ml/min者占53.5%,60<eGFR≤90 ml/min者占34.0%,30<eGFR≤60 ml/min占11.3%,eGFR≤30 ml/min占1.1%。男性结石患者BMI、eGFR、超重或肥胖患病率、痛风和高尿酸血症患病率均与女性患者差异有统计学意义,其余基本资料在男性和女性中差异无统计学意义。与基于全部人群的统计数据相比[8,9,10,11,12],本组结石患者中超重或肥胖、腹型肥胖、高血压、糖尿病、MetS的患病率均明显升高。
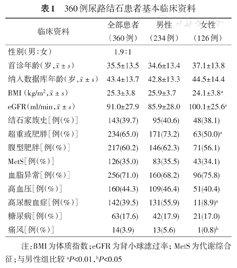
360例尿路结石患者基本临床资料
360例尿路结石患者基本临床资料
| 临床资料 | 全部患者(360例) | 男性(234例) | 女性(126例) |
|---|---|---|---|
| 性别(男∶女) | 1.9∶1 | ||
首诊年龄(岁, ±s) ±s) | 35.5±13.5 | 34.6±13.4 | 37.1±13.8 |
纳入数据库年龄(岁, ±s) ±s) | 43.4±13.7 | 42.8±13.3 | 44.5±14.4 |
BMI(kg/m2, ±s) ±s) | 25.3±3.8 | 25.9±3.7 | 24.1±3.8a |
eGFR(ml/min, ±s) ±s) | 91.0±27.9 | 85.9±28.0 | 100.1±25.6a |
| 结石家族史[例(%)] | 143(39.7) | 95(40.6) | 48(38.1) |
| 超重或肥胖[例(%)] | 234(65.0) | 171(73.2) | 63(50.0)a |
| 腹型肥胖[例(%)] | 217(60.2) | 146(62.3) | 71(56.1) |
| MetS[例(%)] | 126(35.0) | 83(35.5) | 43(34.1) |
| 血脂异常[例(%)] | 256(71.0) | 160(68.2) | 96(75.8) |
| 高血压[例(%)] | 160(44.3) | 109(46.4) | 51(40.4) |
| 高尿酸血症[例(%)] | 142(39.5) | 131(55.9) | 11(8.9)a |
| 糖尿病[例(%)] | 63(17.6) | 42(17.9) | 21(17.0) |
| 痛风[例(%)] | 14(3.9) | 13(5.6) | 1(0.8)b |
注:BMI为体质指数;eGFR为肾小球滤过率;MetS为代谢综合征;与男性组比较aP<0.01,bP<0.05
男性患者中24 h尿pH显著低于女性,高钠尿、高钙尿、低镁尿和高磷尿的患病率显著高于女性。其中高钠尿、高钙尿和低枸橼酸尿是所有尿液成分异常中最为常见的类型(表2)。
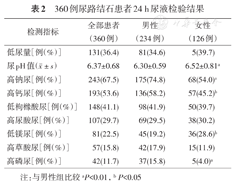
360例尿路结石患者24 h尿液检验结果
360例尿路结石患者24 h尿液检验结果
| 检测指标 | 全部患者(360例) | 男性(234例) | 女性(126例) |
|---|---|---|---|
| 低尿量[例(%)] | 131(36.4) | 81(34.6) | 5(39.7) |
尿pH值( ±s) ±s) | 6.37±0.68 | 6.30±0.59 | 6.52±0.81a |
| 高钠尿[例(%)] | 243(67.5) | 175(74.8) | 68(54.0)a |
| 高钙尿[例(%)] | 193(53.6) | 136(58.2) | 57(45.2)b |
| 低枸橼酸尿[例(%)] | 148(41.1) | 98(41.9) | 50(39.7) |
| 高尿酸尿[例(%)] | 107(29.7) | 69(29.5) | 38(30.2) |
| 低镁尿[例(%)] | 81(22.5) | 45(19.2) | 36(28.6)b |
| 高草酸尿[例(%)] | 57(15.8) | 42(17.9) | 15(11.9) |
| 高磷尿[例(%)] | 42(11.7) | 37(15.8) | 5(4.0)a |
注:与男性组比较aP<0.01,bP<0.05
按照尿液成分异常的严重程度对所有结石患者进行分类,共有高钠尿、高钙尿、低枸橼酸尿、高尿酸尿、低镁尿、高草酸尿、高磷尿7种尿液成分异常被纳入统计。合并0至7种尿液成分异常的患者数量分别为18、63、107、110、47、14、1和0例,结石患者平均BMI随着尿液成分异常数量的增加而增加,当未合并尿液异常时平均BMI为22.6 kg/m2,合并6种尿液异常时BMI为27.3 kg/m2,说明BMI越大其尿液成份异常的就越多。
代谢评估是结石诊治的重要组成部分,但由于过程繁琐所以开展很困难。为更有效地进行代谢评估,我们建立了代谢评估数据库,并在实际应用中取得良好效果。泌尿系统结石患者常合并全身代谢异常。本研究结石患者中腹型肥胖、高血压、糖尿病、MetS的患病率均显著高于普通人群,提示泌尿系统结石可能与全身代谢异常相关。本研究显示,结石患者平均BMI随尿液成分异常的增多而增高,说明结石风险与肥胖呈正相关。大规模流行病学研究的结果显示,肾结石和代谢性疾病的患病率同步升高[13,14]。Taylor等[15]的研究在校正了种族、饮食中液体、蛋白、钙、磷摄入等混杂因素后发现肥胖与结石形成相关。Sorensen等[16]的前瞻性研究在校正了种族、地区、饮食、收入等混杂因素后也发现肥胖和结石相关。基于国人的研究也发现MetS与结石复发相关[17]。肥胖既是结石形成的危险因素,也可加重高血压、糖尿病、高脂血症等结石形成危险因素,但通过锻炼、改善生活方式等简单的方法即可有效改善肥胖。因此对于合并超重或肥胖的结石患者,减重是我们首先给予患者的健康指导建议。
含钙结石约占结石总数的80%,因此通过减少尿钙排泄可以降低含钙结石形成的风险。但对国人来说,单纯通过减少饮食中钙的摄入来降低尿钙可增加骨质疏松等其他疾病的风险,也会增加肠道对草酸的吸收,增加尿液中草酸排泄,反而增加结石发生的风险[18]。本组研究中高尿钠和高尿钙是最常见的尿液成分异常,这为结石的防治提供了新的线索。既往研究显示,高尿钠可以通过降低尿枸橼酸的含量使尿钙升高,限制钠摄入可以有效降低尿液中钙和草酸的含量从而减少结石复发[19]。因此通过减少饮食中钠的摄入既可减少尿钠,也可在不减少钙摄入的同时减少尿钙,是对结石患者进行干预的有效且可行手段,在患者教育中应特别强调低盐饮食的重要性。
本研究中39.7%的结石患者存在家族史,既往研究亦显示17%~37%的结石患者存在家族史[20]。Curhan等[21]在排除生活习惯等方面的混杂因素后得出家族史可使结石发生的风险增加2.57倍。瑞典的一项研究显示当两名同胞均存在结石时,发病风险可增加至25倍,而生活环境对结石的影响有限[22]。由于阳性家族史可明显增加结石风险且易于评估,因此是评估正常个体未来发生结石风险的良好指标,在问诊时应仔细询问,避免遗漏。
本数据库的建立和研究也存在一定的局限性。第一,本研究为回顾性研究,未包含正常对照人群,未来需进行前瞻性、对照研究进一步验证所得结论。第二,本研究样本量较小,需要有更大的样本量和多种族、多地区来源患者的资料。第三,该数据库目前主要纳入门诊患者,仅包含少量的结石成分数据。
总之,结石患者超重或肥胖、腹型肥胖、高血压、糖尿病、MetS的患病率均明显高于普通人群。尿液成分异常与BMI呈正相关。泌尿系统结石代谢评估数据库对高效开展结石代谢评估工作有重要作用,将为结石治疗和预防提供依据,为探索结石危险因素奠定基础。
所有作者均声明不存在利益冲突



























