
探讨宏基因二代测序技术检测尿路感染患者尿液中多瘤病毒的临床价值。
2018年9月至2020年4月复旦大学附属中山医院收治的送检尿液宏基因二代测序的尿路感染患者共33例。采用随机扩增法、脱氧核糖核酸纳米球、华大基因公司BGI-500测序平台及BWA算法为基础的比对法等技术对尿液标本的核酸提取物进行二代测序分析,以尿标本中多瘤病毒核酸序列数>100为入选标准,分析检出多瘤病毒的类型、深度、覆盖度、丰度及序列数等参数。采用Taq Man探针实时定量聚合酶链反应(PCR)法验证并检测多瘤病毒DNA载量。
30.3%(10/33)的患者尿标本中检出JC多瘤病毒,其中1例合并检出BK多瘤病毒。所有患者在检测前均使用抗菌药物治疗,但仅一例尿培养阳性。JC多瘤病毒检出的深度均值为35.9,覆盖度均值96.8%,相对丰度均值92.6%,唯一比对序列数均值为3 154。实时定量PCR法检测10例患者尿中JC多瘤病毒DNA载量在5.84×103~6.55×108拷贝/ml,均值为6.82×107拷贝/ml,其中9例患者(均为免疫受损者)的病毒载量超过5×104拷贝/ml,与宏基因二代测序结果基本相符。每1 M数据中的严格比对序列数(RPM)与CD4+T细胞计数存在线性负相关(R2=0.84,P=0.004)。其中1例患者经西多福韦治疗后症状及尿检指标好转,随访尿液宏基因二代测序检查JC多瘤病毒的序列数及RPM值明显下降,实时定量PCR法证实尿中病毒DNA载量亦下降。
宏基因二代测序技术在病毒性尿路感染的诊断中有着重要意义。西多福韦可能是治疗多瘤病毒尿路感染的一个选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尿路感染约占医院获得性感染的三分之一[1],在我国其发病率仅次于上呼吸道感染。引起尿路感染最常见的病原体为大肠杆菌等革兰阴性菌[2],而免疫抑制人群的病原谱可能更为复杂,由病毒引起的尿路感染比例升高[3],但因缺乏特效诊断技术而常被漏诊[4]。这部分患者可能尿细菌负荷量不高、反复尿培养阴性、抗菌药物治疗效果差,更易发展为复杂性尿路感染,如不及时干预可导致肾功能严重受损[5]。
多瘤病毒是一种小的环状DNA病毒,人类是其自然宿主。JC多瘤病毒(JCV)最早发现于进行性多灶性白质脑病患者的脑组织中,高危人群为艾滋病病毒(HIV)感染者和免疫抑制剂治疗患者[6]。多瘤病毒对肾脏上皮细胞具有亲和力,早期感染后可长久潜伏于泌尿系统,20%~60%的健康成人尿中可有JCV排出,而免疫抑制人群其排泄率及拷贝数均较高,可能导致感染,但致病机制尚不十分明确[7]。
宏基因二代测序(mNGS)技术可鉴定的病原体范围较传统方法提高[8],我们发现尿路感染中除细菌以外的多种病原体,包括难以培养的病毒。目前尚无应用mNGS技术定量检测尿路感染者尿中多瘤病毒的报道,关于其致病性及临床意义的研究较少。JCV感染目前无特效治疗方法,本研究中的1例JCV阳性复杂性尿路感染者经西多福韦治疗后短期内症状及尿检指标好转,随访发现JCV的病毒载量亦下降,临床考虑治疗有效。因此,本研究旨在评价mNGS技术检出尿路感染者尿液中多瘤病毒的临床意义,并提出了一种可能有效的治疗药物。
2018年9月—2020年4月复旦大学附属中山医院收治的临床诊断为尿路感染并送检尿液行mNGS检测的患者共33例。入选标准:临床诊断泌尿系感染;送检尿液标本合格,标本检测过程质控合格,测序及分析结果可靠;多瘤病毒严格比对序列数(SMRN)>100。最终共纳入10例患者(编号分别为PT1-PT10),其中1例患者(PT1)经西多福韦治疗后进行了尿液mNGS和实时定量聚合酶链反应(RT-PCR)随访。本研究获得复旦大学附属中山医院伦理委员会批准和患者的知情同意。本研究为临床病例干预性研究。
样本处理和DNA提取:取0.6~1.0 ml患者的尿液,经玻璃珠混合震荡破壁,随后采用TIANamp Micro DNA Kit(DP316,TIANGEN BIOTECH)试剂盒提取DNA。文库构建和测序:使用Agilent 2100 Bioanalyzer和定量PCR法进行DNA文库构建及质控,文库经环化形成单链环形结构,随后经滚环复制(RCA)生成DNB纳米球。制备好的DNB纳米球加载到测序芯片,使用BGISEQ-500进行测序。数据分析:测序数据下机后去除低质量和长度<35 bp的数据。通过BWA(BWA:http://bio-bwa.sourceforge.net/)比对,将高质量的数据中人源性基因组序列数据去除。剩余数据去除低复杂度序列数后与专用微生物大数据库(ftp://ftp.ncbi.nlm.nih.gov/genomes/)比对,并将比对后的数据按照细菌、真菌、病毒、分枝杆菌和寄生虫等进行分类和排列。
常规处理收集的尿液样本,采用QIAamp MinElute Virus Spin试剂盒(Qiagen,德国)提取尿标本中的病毒总核酸。JCV等多瘤病毒发现较早,RT-PCR技术已成熟,所以直接引用文献的引物和探针[9]。JCV上游引物为CCACAGCCAGAGCTCTTCCT,下游引物为GAATGGGAATCCTGGTGGAA,荧光探针为FAM-CCACTTCTCATTAAATG-MGBNFQ;BKV上游引物为CTTTCTTTTTTTTTTGGGTGGTGTT,下游引物为TTGCCAGTGATGAAGAAGCAA,荧光探针为FAM-AGTGTTGAGAATCTGCT-MGBNFQ。采用TaqMan Gene Expression试剂盒(ABI,美国)进行扩增,20 μl反应体系包括2×TaqMan Gene Expression Master Mix 10 μl,上、下游引物各1.8 μl,探针0.2 μl,模板2 μl,双蒸水4.2 μl。反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。
统计各样本检出多瘤病毒的种类、深度、覆盖度、相对丰度、SMRN和每1M数据中的比对序列数(RPM)等参数。采用SPSS 19.0统计软件进行测序参数与临床数据的Pearson相关性分析,进行双侧检验。检验水准α=0.05。
10例患者中男4例,女6例,年龄45~82岁,均临床诊断尿路感染。8例患者有尿路刺激征,1例仅表现为肉眼血尿(编号PT1),1例为上尿路感染(PT10,左肾感染)。9例患者合并免疫受损因素,包括风湿免疫系统疾病(PT1、PT3、PT4)、尿路结核(PT2)或播散性结核(PT8)、心脏瓣膜置换术后(PT3)、肝移植术后(PT4)、T淋巴细胞肿瘤性增生(PT5)、控制欠佳的2型糖尿病(PT6、PT7)、高龄且反复脑出血长期卧床(PT9);1例女性患者为神经源性膀胱并有导尿管留置(PT7);4例男性患者均有前列腺肥大,其中2例(PT2、PT6)已行前列腺切除术且均伴有尿道狭窄。7例患者在采样前后1周内进行了细胞免疫功能检查并记录CD4+T细胞计数(表1)。10例患者在进行mNGS检测前均使用过抗菌药物,但仅1例患者(PT4)尿培养阳性(奇异变形杆菌和大肠埃希菌)。
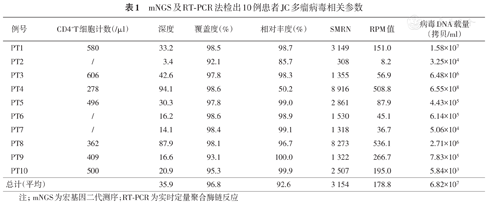
mNGS及RT-PCR法检出10例患者JC多瘤病毒相关参数
mNGS及RT-PCR法检出10例患者JC多瘤病毒相关参数
| 例号 | CD4+T细胞计数(/μl) | 深度 | 覆盖度(%) | 相对丰度(%) | SMRN | RPM值 | 病毒DNA载量(拷贝/ml) |
|---|---|---|---|---|---|---|---|
| PT1 | 580 | 33.2 | 98.5 | 98.7 | 3 149 | 151.0 | 1.58×107 |
| PT2 | / | 3.4 | 92.1 | 85.7 | 308 | 8.2 | 3.25×104 |
| PT3 | 606 | 42.6 | 97.8 | 98.3 | 1 355 | 56.9 | 6.48×106 |
| PT4 | 278 | 94.1 | 98.6 | 50.2 | 8 916 | 508.8 | 6.55×108 |
| PT5 | 496 | 30.3 | 97.8 | 99.0 | 2 861 | 87.9 | 4.43×105 |
| PT6 | / | 16.2 | 98.6 | 98.9 | 1 530 | 45.1 | 6.14×105 |
| PT7 | / | 14.1 | 98.4 | 99.1 | 1 318 | 36.7 | 5.06×104 |
| PT8 | 362 | 87.9 | 98.1 | 96.7 | 8 273 | 536.1 | 2.71×106 |
| PT9 | 409 | 16.6 | 93.1 | 100.0 | 1 322 | 266.7 | 7.83×105 |
| PT10 | 500 | 20.9 | 95.3 | 99.9 | 2 507 | 195.0 | 5.84×103 |
| 总计(平均) | 35.9 | 96.8 | 92.6 | 3 154 | 178.8 | 6.82×107 |
注;mNGS为宏基因二代测序;RT-PCR为实时定量聚合酶链反应
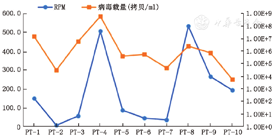
血标本中病毒SMRN>10较有意义,提示病毒感染可能[10],而尿标本中病毒序列数的界值尚不清楚,我们根据本地化测序平台积累的经验,考虑尿标本中病毒SMRN>100感染可能大。本研究中的10例患者,检出JCV的SMRN在100~1 000之间的仅1例,>1000的有9例。检测深度在3.4~94.1之间,均值为35.9;覆盖度在92.1%~98.6%之间,均值为96.8%;相对丰度在50.2%~100.0%之间,均值为92.6%;SMRN在308~8 916之间,均值为3 154。其中1例肝移植后患者(PT4)合并检出BK多瘤病毒(BKV),深度、覆盖度、相对丰度、SMRN分别为70.77,97.9%,37.67%和5 120。进一步通过RT-PCR法进行验证,10例患者JCV DNA载量在5.84×103~6.55×108拷贝/ml,均值为6.82×107拷贝/ml,其中9例患者(均合并免疫受损因素)尿中JCV载量均在5×104拷贝/ml以上,考虑感染可能;而1位患者(PT10)除左肾感染外无其他免疫受损因素,其尿中JCV DNA载量最低为5.84×103拷贝/ml(表1)。另PT4患者的BKV DNA载量为3.04×108拷贝/ml。RT-PCR法检出JCV DNA定量与mNGS的RPM值的趋势基本相符(图1)。

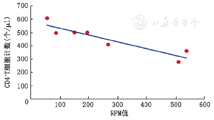
为比较不同样本间JCV的检出差异,本研究采用RPM比值,即标准化为1M序列数中所包含的病毒SMRN,RPM值不受实验批次影响。JCV的RPM值与CD4+T细胞计数进行Pearson相关性分析。研究发现,CD4+T细胞计数越低,RPM值越高,表明宿主细胞免疫功能越低,尿液中JCV的载量可能越大。CD4+T细胞的绝对计数与病毒RPM呈线性负相关(R2=0.84,P=0.004)(图2)。

应用西多福韦成功治疗1例,患者PT1为54岁女性,患类风湿性关节炎史7年余,平素规律服用艾拉莫德、雷公藤多苷治疗。2019年4月初出现肉眼血尿,尿常规示:白细胞镜检8~10个/HP,红细胞镜检120+/HP;两次尿培养均阴性;彩超示:右侧输尿管管壁增厚,右侧输尿管扩张,双侧肾盂轻度积水;CT尿路造影(CTU):双侧输尿管中上段管壁增厚伴强化,伴双侧肾盂稍积水扩张。先后予磷霉素、法罗培南治疗效果不佳。2019年5月15日尿液mNGS结果提示大量检出JCV核酸序列(SMRN 3 149条,RPM 151.0),合并检出惰性乳杆菌(考虑阴道定植菌群可能);RT-PCR示JCV病毒载量为1.58×107拷贝/ml。2019年5月下旬至6月中旬静脉应用西多福韦治疗(5 mg/kg)3次,250 mg,每周1次×2次;250 mg,每两周1次,共1次。患者血尿症状好转,多次复查尿常规均正常;2019年6月25日随访尿液mNGS检查示:JCV检出序列数及RPM值均下降(SMRN由3 149下降为914,RPM由151.0下降为45.3),病毒载量亦下降(为1.40×106拷贝/ml)。临床考虑治疗有效。
复杂性尿路感染是目前临床诊治的难点[5],本研究纳入的10例患者均有复杂性尿路感染的易感因素[11]。我们采用mNGS技术揭示了这部分患者泌尿系感染的复杂病原构成,并发现这些患者尿液中均有多瘤病毒核酸序列的检出,且深度、覆盖度及丰度均较高,RT-PCR法也进一步验证了检出结果。
JCV属于多瘤病毒科,呈世界性分布,不易变异,机会性致病[7]。初次感染发生在婴幼儿时期,可长久潜伏于泌尿道上皮细胞[12]。免疫抑制状态下JCV可被激活并大量复制,可超过5×104拷贝/ml,并可能致病[7,13]。本研究中1例实体器官(肝)移植术后患者尿中同时检出大量BKV核酸序列,其与JCV DNA有70%~75%的同源性,为肾移植术后尿中常规监测的病毒,与免疫抑制治疗有关,不及时干预可导致移植器官功能丧失[14,15]。此外,JCV可编码数种致癌蛋白,已被WHO归类为"可能对人类致癌" (2B组)致癌物[16]。因此,尿中多瘤病毒的检出具有一定的意义。本研究借助mNGS技术还发现非移植相关尿路感染者多瘤病毒致病的可能,且mNGS与RT-PCR验证结果基本一致,所以对于反复尿路感染且培养阴性的患者应考虑多瘤病毒感染的可能,并可采用更为经济的RT-PCR法进行尿多瘤病毒的检测。
多瘤病毒主要通过改善免疫抑制状态来治疗,目前最有希望的抗病毒药是一种胞嘧啶类似物西多福韦,但临床获益尚不确切[7],本研究中的1例女性患者西多福韦治疗JCV尿路感染有效,但属于个例,疗效仍需长期随访。CD4+T细胞的减少可能导致进行性多灶性白质脑病患者JCV的激活和大量复制,严重者可致死,提示JCV感染与细胞免疫状态有关[17,18];本研究也发现尿液中JCV的RPM值与CD4+T细胞计数存在线性负相关。因此改善T细胞免疫可能是治疗JCV感染的关键因素,目前已有特异性T细胞移植治疗多瘤病毒感染的报道[17]。
目前国内对于多瘤病毒及其相关疾病的研究较少,本研究首次揭露了mNGS技术对尿路感染者尿中多瘤病毒的检出情况,对于存在免疫受损因素尤其是CD4+T细胞计数明显降低的患者,需考虑多瘤病毒感染可能。但本研究样本量较少,尚不足以分析mNGS检测多瘤病毒感染及致病的临界值,需大样本量的深入研究。
所有作者均声明不存在利益冲突



























