
自1968年IgA肾病首次报道,至今已超过50年,由于其发病机制尚未完全阐明,临床病理存在很大的异质性,疾病进展相对缓慢,IgA肾病治疗的高质量临床研究相对少见。本文回顾了近年IgA肾病治疗的研究进展,提出IgA肾病治疗不应拘泥于现有的临床指南,而需要整合临床病理信息,制定个体化治疗策略的观点。随着对IgA肾病发病机制的深入研究,靶向治疗已成为近年来IgA肾病治疗研究的热点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
IgA肾病自1968年首次报道,至今已超过半个世纪。因其临床病理表现异质性大,疾病进展相对缓慢,IgA肾病治疗的高质量临床研究相对少见,目前关于IgA肾病的免疫抑制治疗存在较大争议。本文回顾了近年IgA肾病治疗的研究进展,强调临床病理信息的整合对于IgA肾病个体化治疗的重要性。随着发病机制研究的不断深入,靶向治疗方兴未艾,为IgA肾病的治疗开拓了全新的领域。
多项研究结果表明[1],血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体拮抗剂(ARB)应用于血压正常和高血压IgA肾病患者均可显著降低尿蛋白,并且存在剂量效应关系。目前指南推荐当IgA肾病患者尿蛋白>0.5 g/d时使用ACEI或ARB。尽管短期研究及荟萃分析结果显示ACEI联合ARB能进一步降低尿蛋白[2],但因缺乏对远期肾脏结局影响的高质量循证证据,也有研究提示二者联合治疗还可能增加肾脏不良事件[3],故指南并未推荐ACEI联合ARB治疗。因此当接受最大耐受剂量的ACEI或ARB单药治疗后,尿蛋白仍未降至靶目标水平(<0.5 g/d),是否需要ACEI联合ARB治疗,应个体化评估获益及风险后决策。
IgA肾病的强化支持治疗联合免疫抑制治疗(STOP-IgAN)研究[4]是2008至2011年在德国开展的一项多中心随机对照临床试验(RCT),纳入309例IgA肾病患者,经过6个月强化支持治疗[包括滴定至最大耐受剂量的ACEI/ARB,目标血压<125/75 mmHg(1 mmHg=0.133 kPa),饮食及生活方式管理,他汀类药物降脂治疗]的导入期后,最终162例患者符合条件[估算肾小球滤过率(eGFR)>30 ml·min-1·(1.73 m2)-1,蛋白尿0.75~3.5 g/d],分配到维持强化治疗组和在强化治疗基础上联合免疫抑制治疗组:(1)eGFR≥60 ml·min-1·(1.73 m2)-1,糖皮质激素单药治疗,甲泼尼龙1 g静脉滴注,d1,d3,d5,其后泼尼松龙0.5 mg/kg,隔日口服,疗程6个月;(2)eGFR在30~59 ml·min-1·(1.73 m2)-1,糖皮质激素(口服泼尼松龙40 mg/次,1次/d,1个月后开始减量,减至10 mg/次,1次/d维持)联合免疫抑制剂(第1~3个月口服环磷酰胺1.5 mg·kg-1·d-1,第4~36个月口服硫唑嘌呤1.5 mg·kg-1·d-1维持)。结果显示,强化支持治疗后蛋白尿仍>0.75 g/d的IgA肾病患者接受免疫抑制治疗可提高尿蛋白缓解率,但对延缓eGFR下降无明显效果,并且增加感染风险[4]。
评估糖皮质激素治疗IgA肾病全球研究(TESTING)是由北京大学第一医院肾内科发起的一项糖皮质激素治疗IgA肾病的国际多中心研究[5],入选标准为经过至少3个月的强化支持治疗后,尿蛋白仍>1 g/d且eGFR>20 ml·min-1·(1.73 m2)-1的IgA肾病患者,随机分配至甲泼尼龙组(0.6~0.8 mg·kg-1·d-1)或安慰剂组。原计划招募750例患者,但中期结果发现,与对照组相比,尽管糖皮质激素治疗组更有效控制尿蛋白,主要复合肾脏终点的发生率更低(5.9%比15.9%),但感染等严重不良事件发生率明显升高(14.7%比3.2%),因此TESTING研究在纳入262例患者后提前中止[5]。
尽管STOP-IgAN和TESTING研究均因糖皮质激素治疗后严重不良事件发生风险显著升高的结果抵消了潜在获益,但不能因此全盘否定糖皮质激素在IgA肾病中的治疗价值。这两项研究的局限性在于入选标准均未纳入肾脏病理。即使尿蛋白和肾功能受损程度相同的IgA肾病患者,如果肾脏病理活动性病变和慢性化程度不同,对免疫抑制治疗的反应可能会截然相反。因此,仅凭临床指标而不结合肾脏病理信息就决定是否启动免疫抑制治疗的决策具有盲目性,在未来IgA肾病治疗的RCT研究中,入选标准中应当纳入关键的组织病理学指标。此外,由于大多数IgA肾病患者进展到终末期肾脏病(ESRD)的过程缓慢,这两项研究的随访时间相对较短。研究结束后继续对受试者,尤其是对研究中使用糖皮质激素后尿蛋白缓解的患者观察随访,可能有助于获得长期治疗效果的信息。
IgA肾病牛津分类欧洲验证(VALIGA)研究[6]是一项欧洲多中心回顾性研究,旨在不同临床病理表现和治疗方案的欧洲IgA肾病患者中验证牛津分类。该研究没有严格的入选标准,只需要肾活检证实为IgA肾病并且肾活检标本包含肾小球数量≥8个,随访时间>1年或在1年内进展至ESRD。VALIGA研究对象包括了被RCT研究和牛津分类队列排除的eGFR<30 ml·min-1·(1.73 m2)-1和肾活检时尿蛋白<0.5 g/d的患者。结果显示,在未接受免疫抑制治疗的患者中,牛津分类M、S、T指标对肾脏预后具有预测作用,E指标则在尿蛋白<0.5 g/d的亚组中对肾脏预后有预测作用。而牛津分类与肾脏预后的相关性在使用糖皮质激素的患者中被削弱,其他研究也得出类似的结果。这说明免疫抑制治疗具有延缓IgA肾病进展的作用。
IgA肾病牛津分类自2009年发布后,在全球临床实践中被广泛应用。多项研究对牛津分类病理指标的疾病进展预测效能进行了验证和再评价。尽管多数研究证实牛津分类的M1、S1和T1/2与肾脏不良预后相关,但最初版本的IgA肾病牛津分类未能阐述病理指标分类和评分对治疗的指导作用。
既往的牛津分类研究未发现新月体是IgA肾病肾脏预后的独立预测因素,这可能与其队列未纳入eGFR<30 ml·min-1·(1.73 m2)-1的患者有关。纳入包括牛津队列、VALIGA队列以及中国患者队列的IgA肾病新月体回顾性研究结果发现,在未接受免疫抑制治疗的情况下,出现新月体的IgA肾病患者的肾脏预后不良风险,显著高于无新月体患者,在免疫抑制治疗后则无显著差异[7]。而当新月体数量≥25%时,即使进行免疫抑制治疗,肾脏预后不良风险依旧显著增高。因此,2016年更新的IgA肾病牛津分类,在原有的系膜细胞增多(M)、毛细血管内细胞增多(E)、节段性硬化(S)以及肾小管萎缩/间质纤维化(T)评分即MEST评分基础上,推荐增加新月体(C)评分项:有无新月体、新月体类型以及严重程度的描述。
局灶节段性肾小球硬化(FSGS)样改变是IgA肾病常见的病理表现,但不同类型的FSGS样改变背后的肾小球损伤机制不尽相同。英国学者对137例牛津分类出现节段性硬化(S1)的IgA肾病患者的临床病理分析发现,节段性硬化可出现类似原发FSGS不同亚型的病理学特点[8],如出现于顶端型的足细胞肥大,门部型的玻璃样变。相较于S0以及出现S1但不伴有顶端型特征的IgA肾病患者,出现S1伴有顶端型特征者肾活检时的尿蛋白更高,如未接受免疫抑制治疗,其肾功能下降速度更快,但对免疫抑制治疗敏感,治疗后肾脏预后显著改善[8]。上述结果提示IgA肾病中出现的伴有顶端型特征的FSGS样改变,很可能是足细胞病变的结果。尽管2016年IgA肾病牛津分类更新中,尚未对节段性硬化(S)进行亚型分类,但推荐在出现S1时描述是否伴有足细胞肥大/顶端型病变。
更新版的IgA肾病牛津分类仍存在部分单项指标(M、E、C)评分一致性差的问题,但瑕不掩瑜,它为临床医师确定哪些IgA肾病患者接受免疫抑制治疗可带来潜在获益提供了更多的依据,也为更加准确判断肾脏预后提供了有价值的信息。国际最新的IgA肾病风险预测工具[9],纳入了肾活检时的牛津分类MEST评分、年龄、种族、临床指标(eGFR、蛋白尿、血压)以及肾活检时是否使用RASI及免疫抑制治疗,用于预测肾活检后长达7年内的肾脏预后(eGFR下降50%或进入ESRD)。
综上所述,在现有改善全球肾脏病预后组织(KDIGO)指南对糖皮质激素治疗IgA肾病的推荐级别较低的情况下,临床实践中需要综合临床和病理指标判断是否启动免疫抑制治疗。我们认为IgA肾病出现以下情况需考虑使用糖皮质激素:(1)尿蛋白>3 g/d或肾病综合征;(2)牛津分类出现新月体(C1/C2);(3)伴有顶端型特征的节段性硬化;(4)RASI优化治疗后尿蛋白在1~3 g/d,同时牛津分类出现M1/E1。制定治疗决策时还需充分考虑患者的年龄、既往免疫抑制治疗情况(药物种类、疗效、有无严重不良反应)以及合并其他基础疾病(如糖尿病、肥胖、骨质疏松、呼吸系统疾病)等因素。
IgA肾病肠道-肾脏轴的相关研究提示肠道相关淋巴组织(GALT)在IgA肾病发病机制中发挥重要作用。全基因组关联研究(GWAS)结果提示[10],IgA肾病发病风险出现频率最多的位点,也是炎症性肠病、肠黏膜屏障以及对肠道病原应答调节的关键基因位点。由于黏膜免疫系统失调,饮食抗原、黏膜感染可能促使黏膜GALT中的纯真B细胞转化为分泌IgA抗体的细胞,因此GALT可作为IgA肾病的治疗靶点。新型口服布地奈德靶向释放制剂(商品名Nefecon),可控制药物抵达回肠末端后再释放,在派氏集合淋巴结(Peyer′s patches)局部形成较高的药物浓度。该制剂仅不足10%的布地奈德吸收入血,因此不良反应明显轻于全身性糖皮质激素。NEFIGAN是一项欧洲多中心Ⅱ期RCT研究[11],旨在评价不同剂量Nefecon治疗IgA肾病的安全性及有效性。研究结果显示,与安慰剂组相比,Nefecon组在治疗9个月时可显著降低蛋白尿,并且这种效应在治疗结束后的随访观察过程中持续存在。在治疗9个月时,Nefecon可稳定患者eGFR水平,而安慰剂组患者肾功能下降。目前Nefecon治疗IgA肾病的Ⅲ期临床试验正在进行(表1)。
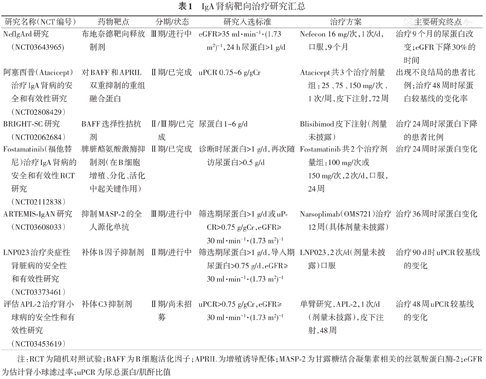
IgA肾病靶向治疗研究汇总
IgA肾病靶向治疗研究汇总
| 研究名称(NCT编号) | 药物靶点 | 分期/状态 | 研究入选标准 | 治疗方案 | 主要研究终点 |
|---|---|---|---|---|---|
| NeflgArd研究(NCT03643965) | 布地奈德靶向释放制剂 | Ⅲ期/进行中 | eGFR≥35 ml·min-1·(1.73 m2)-1,24 h尿蛋白>1 g/d | Nefecon 16 mg/次,1次/d,口服,9个月 | 治疗9个月的尿蛋白改变;eGFR下降30%的时间 |
| 阿塞西普(Atacicept)治疗IgA肾病的安全和有效性研究(NCT02808429) | 对BAFF和APRIL双重抑制的重组融合蛋白 | Ⅱ期/已完成 | uPCR 0.75~6 g/gCr | Atacicept共3个治疗剂量组:25、75、150 mg/次,1次/周,皮下注射,72周 | 出现不良结局的患者比例;治疗48周时尿蛋白较基线的变化率 |
| BRIGHT-SC研究(NCT02062684) | BAFF选择性拮抗剂 | Ⅱ/Ⅲ期/已完成 | 尿蛋白1~6 g/d | Blisibimod皮下注射(剂量未披露) | 治疗24周时尿蛋白下降的患者比例 |
| Fostamatinib(福他替尼)治疗IgA肾病的安全和有效性RCT研究(NCT02112838) | 脾脏酪氨酸激酶抑制剂(在B细胞增殖、分化、活化中起关键作用) | Ⅱ期/已完成 | 诊断时尿蛋白>1 g/d,再次随访尿蛋白>0.5 g/d | Fostamatinib共2个治疗剂量组:100 mg/次或150 mg/次,2次/d,口服,24周 | 治疗24周时尿蛋白变化 |
| ARTEMIS-IgAN研究(NCT03608033) | 抑制MASP-2的全人源化单抗 | Ⅲ期/进行中 | 筛选期尿蛋白>1 g/d或uPCR>0.75 g/gCr,eGFR≥30 ml·min-1·(1.73 m2)-1 | Narsoplimab(OMS721)治疗12周(具体剂量未披露) | 治疗36周时尿蛋白变化 |
| LNP023治疗炎症性肾脏病的安全性和有效性研究(NCT03373461) | 补体B因子抑制剂 | Ⅱ期/进行中 | 筛选期尿蛋白>1 g/d,导入期尿蛋白>0.75 g/d,eGFR≥30 ml·min-1·(1.73 m2)-1 | LNP023,2次/d(剂量未披露)口服 | 治疗90 d时uPCR较基线的变化 |
| 评估APL-2治疗肾小球病的安全性和有效性研究(NCT03453619) | 补体C3抑制剂 | Ⅱ期/尚未招募 | uPCR>0.75 g/gCr,eGFR≥30 ml·min-1·(1.73 m2)-1 | 单臂研究,APL-2,1次/d(剂量未披露),皮下注射,48周 | 治疗48周uPCR较基线的变化 |
注:RCT为随机对照试验;BAFF为B细胞活化因子;APRIL为增殖诱导配体;MASP-2为甘露糖结合凝集素相关的丝氨酸蛋白酶-2;eGFR为估计肾小球滤过率;uPCR为尿总蛋白/肌酐比值
IgA肾病发病机制相关基础研究表明,在抗原驱动的固有免疫应答中,Toll样受体(TLR)与配体结合,以及B细胞活化因子(BAFF)-增殖诱导配体(APRIL)启动的信号通路至关重要,这也成为IgA肾病关键的治疗靶点。羟氯喹主要抑制TLR-9、TLR-7和TLR-8,还可抑制抗原加工和呈递。在RASI治疗后尿蛋白仍控制不佳的中国IgA肾病患者,联合使用羟氯喹的RCT研究结果显示,羟氯喹联合RASI可进一步降低蛋白尿,但由于研究随访时间相对短,羟氯喹对远期肾功能保护作用尚不确定[12]。尽管多项研究证实利妥昔单抗在膜性肾病、抗中性粒细胞胞质抗体(ANCA)相关血管炎肾损害具有治疗作用,但纳入34例尿蛋白>1 g/d的IgA肾病患者的RCT研究结果[13]显示,利妥昔单抗治疗在B细胞清除后,既不能降低尿蛋白、改善肾功能,血清半乳糖缺陷的IgA1(Gd-IgA1)及其抗体水平也没有下降,这提示IgA肾病独特的肠黏膜免疫异常有别于其他免疫性肾小球疾病的发病机制。目前还有其他抗B细胞生物制剂治疗IgA肾病的临床研究正在进行(表1)。此外,蛋白酶体抑制剂硼替佐米治疗IgA肾病的小样本队列研究结果显示,在牛津分类T0、肾功能正常的IgA肾病患者中可显著降低尿蛋白。多项基础研究结果表明,补体系统的异常活化在IgA肾病发病及疾病进展中发挥重要作用[14],目前干预补体的治疗策略正应用于IgA肾病治疗的临床研究[15](表1)。
STOP-IgAN、TESTING研究提示糖皮质激素可有效降低IgA肾病尿蛋白,但治疗相关严重不良事件发生风险的增加以及对长期肾脏预后影响的不确定性,提示未来的临床研究需要探索如何整合临床和病理信息,个体化评估糖皮质激素的治疗获益及风险。更新版的IgA肾病牛津分类为制定免疫抑制治疗决策、准确判断肾脏预后提供了更有价值的信息。IgA肾病肠道-肾脏轴理论以及多重打击发病机制的提出,为靶向治疗指明了方向。期待这些研究结果能为IgA肾病的治疗开启新的篇章。
所有作者均声明不存在利益冲突



























