
分析射波刀对70岁及以上原发性大肝癌患者的临床疗效及安全性。
回顾性收集解放军总医院第五医学中心肿瘤放疗中心2014年3月至2018年12月经病理或影像学诊断的70岁及以上大肝癌患者82例,男58例,女24例,年龄70~85(75±4)岁,中位肿瘤直径6.7 cm(5.0~10.0 cm),均接受射波刀立体定向放射治疗。观察1、2、3年肿瘤的无疾病进展生存率(PFS)、局部控制率(LC)和总生存率(OS)及不良反应。采用Kaplan-Meier进行生存分析,Cox比例风险模型分析生存相关的影响因素。
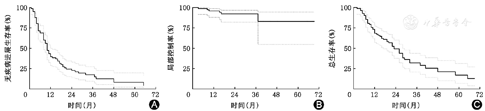
82例患者均顺利完成放射治疗,中位生存期为20个月,中位PFS为10个月,客观缓解率为64.63%(53/82),疾病控制率为85.37%(70/82),治疗后1、2和3年的PFS分别为39.0%(32/82)、22.1%(18/82)和17.1%(14/82),1、2和3年LC分别为95.1%(78/82)、92.3%(76/82)和92.3%(76/82),1、2和3年的OS分别为68.3%(56/82)、48.8%(40/82)和31.7%(26/82)。9例患者出现放射性肝损伤,无因放射性肝损伤死亡病例。Cox回归分析显示甲胎蛋白水平是影响OS的独立风险因素(HR=2.304,95%CI 1.118~4.747,P<0.05)。
射波刀治疗70岁及以上原发性大肝癌患者的LC和OS高,疗效较好,治疗相关不良反应发生少。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肝细胞肝癌(HCC)是严重威胁人类健康的疾病之一。随着我国人口老龄化进程的加速,老年人患原发性肝癌的风险增高。由于许多老年癌症患者都同时伴有一种或多种慢性疾病或重要器官功能衰退,尤其70岁及以上大肝癌(直径5.0~10.0 cm)患者,大多在确诊时已无法承受手术、肝移植等根治性治疗。射频消融治疗常用于<5 cm的肿瘤,且受肿瘤位置限制,如不适用于治疗的靠近大血管、胆管和(或)膈肌等部位的肿瘤。2020年美国国立综合癌症网络(NCCN)指南指出[1],对于不可切除或无法耐受手术的>5 cm的肿瘤,可以选择肝动脉栓塞、系统治疗和体外照射放射治疗。随着放疗技术及设备的不断发展,射波刀作为一种新型的立体定向放射治疗(SBRT)设备,由于可以将金标追踪和Synchrony同步呼吸追踪方式联合起来,从而在治疗过程中实时追踪肿瘤运动、实时监测和修正肿瘤位置偏差,最大限度地治疗肿瘤和最大限度地保护周围正常组织,真正实现了精确定位、精确计划、精确治疗,故成为老年肝癌患者可选择的治疗手段之一。本研究旨在回顾性分析射波刀治疗70岁及以上大肝癌患者的临床疗效及安全性。
鉴于年龄的选择方面并没有一个统一的标准,本研究选择70岁及以上患者一方面满足了研究所需的人群数量,另一方面体现了接近高龄的特点;另外对于这类特定人群的研究,其放射治疗疗效和不良反应的情况也需要有所了解。
本研究为病例系列研究,回顾性收集2014年3月至2018年12月在解放军总医院第五医学中心接受射波刀治疗的70岁及以上大肝癌患者资料,共82例,男58例,女24例,年龄70~85(75±4)岁。其中初治患者53例,既往接受过手术、消融、介入等治疗者29例。治疗前均行血常规、肝肾功能、凝血功能、甲胎蛋白(AFP)、乙型肝炎血清标志物、丙型肝炎抗体、梅毒、艾滋病相关抗体、肺部CT、腹部增强CT或磁共振成像(MRI)检查等。所有患者均签署知情同意书,并经医院医学伦理委员会批准(2018118D)。
在《原发性肝癌诊疗规范(2019版)》[2]中有关放射治疗适应证和禁忌证的基础上,参考国内外相关研究的标准,制定了本研究的入组标准与排除标准。
(1)符合《原发性肝癌诊疗规范(2019版)》诊断标准,根据患者临床症状、肝脏增强CT或MRI检查、血AFP水平确诊为HCC;(2)肿瘤单发,直径5.0~10.0 cm;(3)一般状况良好,年龄≥70岁,体力状况评分(ECOG)评分0~1分;(4)肝功能Child-pugh分级为A/B级;(5)无手术指征或拒绝手术者;(6)既往治疗(如手术、消融、介入)后肝内病灶复发者。
(1)有肝外淋巴结或其他脏器转移;(2)影像学上无法区别肿瘤边界;(3)根据肝脏放射治疗行业标准TG101报告要求,正常有效肝体积≤700 cm3[3];(4)既往有肝脏放射治疗史或其他腹部病灶放射治疗史;(5)合并其他脏器严重疾病不能耐受治疗。
治疗前于CT引导下行金标植入术,植入3~5颗金标,术后1周于CT模拟机下定位(德国Siemens公司的Somatom40排CT),予CT平扫为基准图像,CT增强为辅助图像,将图像传至治疗计划系统(CyberKnife,MultiPlan4.0)。按常规勾画肿瘤靶体积(GTV),在GTV的基础上均匀外扩5 mm为计划靶体积(PTV)。根据正常器官限量设计治疗计划,给予处方剂量40~56 Gy/5~10次,1次/d,连续照射,周末不休,无高剂量热点,危及器官限量参考AAPM TG-101报告[3]。放射治疗期间每3~5天复查血常规、肝功能及凝血指标等。
本研究采用肝癌放射治疗常用的整体疗效判定标准[客观缓解率(ORR)、疾病控制率(DCR)、无疾病进展生存率(PFS)和总生存率(OS)]和局部疗效判定标准[局部控制率(LC)]来进行疗效评价。近期疗效:自肿瘤治疗后3个月复查腹部增强CT或MRI以评估肿瘤情况。依据实体肿瘤疗效评价标准(RECIST):(1)完全缓解(CR):影像学检查提示肿瘤消失;(2)部分缓解(PR):影像学检查提示肿瘤缩小>30%;(3)病灶稳定(SD):肿瘤缩小<30%或增大<20%;(4)病灶进展(PD):肿瘤增大20%以上。以CR+PR计算ORR,以CR+PR+SD计算DCR,即经治疗后获得缓解和病变稳定的病例数占整个可评价例数的百分比。远期疗效包括1、2、3年PFS、LC(即影像学上肿瘤未增大)、OS。
不良反应评价依据国际癌症协会颁布的常见不良反应事件评价标准(CTCAE)4.0版本[4]。肝毒性反应的评价基于放射性肝损伤(RILD)的定义,其中有2种类型:典型的RILD和非典型的RILD。典型的RILD通常表现为1~3个月后出现疲劳症状、肝肿大、无黄疸的腹水、血清碱性磷酸酶(ALP)水平升高2倍或以上。非典型的RILD发生于潜在的慢性肝脏疾病患者,胆红素和(或)血清转氨酶水平较正常水平增加5倍以上,Child-pugh分级评分增加2分或更多[5,6]。
治疗后2年内每3个月复查1次,2年后每6个月复查1次。复查项目包括血常规、肝肾功能、凝血功能、AFP、腹部增强CT或MRI、胸部CT以评估肿瘤复发或转移情况及可能的不良反应。
所有统计分析均采用SPSS 26.0软件进行:采用Fisher精确检验和χ2检验对性别、AFP水平、是否初治、乙型肝炎病毒(HBV)感染和Child-pugh分级等分类变量进行评定;采用Kaplan-Meier法进行生存分析,评价OS、PFS和LC;采用单因素和多因素Cox比例风险模型评估可能危险因素的相关性,包括性别、治疗类型、肝炎类型、Child-pugh分级、腹水情况、肝功能分级、有无门静脉癌栓、AFP水平、肿瘤大小、有无RILD、白细胞、血小板、治疗总剂量、单次治疗剂量、生物有效剂量(BED)值等因素对患者OS的影响。双侧检验,检验水准α=0.05。
治疗后3个月复查腹部增强CT或MRI进行疗效评价,CR 17例,PR 36例,SD 17例,PD 12例。ORR为64.6%(53/82),DCR为85.4%(70/82)。
截至2020年1月,随访时间2~69个月,中位随访时间20个月。因为1例患者治疗后2个月死亡,达到随访终点,因此最短随访时间只有2个月,但不影响远期疗效的结果判定。随访期内,共54例患者死亡,放疗后1、2、3年累积死亡人数分别为26、40、49例。死亡原因包括:39例为肿瘤进展或复发致肝功能衰竭,9例为肝硬化门静脉高压造成的胃底静脉曲张破裂出血、肝性脑病、腹水,3例为肺部感染,另有3例死因不详。中位生存期为20个月,中位肿瘤无进展生存时间为10个月。治疗后1、2和3年PFS分别为39.0%(32/82)、22.1%(18/82)和17.1%(14/82)(图1A),1、2和3年LC分别为95.1%(78/82)、92.3%(76/82)和92.3%(76/82)(图1B),1、2和3年的OS分别为68.3%(56/82)、48.8%(40/82)和31.7%(26/82)(图1C)。

Cox回归分析显示性别、治疗类型、肝炎类型、Child-pugh分级、腹水情况、肝功能分级、有无门静脉癌栓、AFP水平、肿瘤大小、有无RILD、白细胞、血小板、治疗总剂量、单次治疗剂量、BED值等因素对患者OS无明显影响(P>0.05),AFP水平是影响OS的独立风险因素(HR=2.304,95%CI:1.118~4.747,P<0.05)。
所有患者均完成射波刀治疗计划。治疗期间,5例患者出现轻度恶心症状,6例出现乏力症状,6例出现食欲减退、纳差症状,予护胃、止吐等对症治疗后症状均缓解。共有9例诊断为RILD(其中6例为典型RILD,3例为非典型RILD),经保肝治疗后肝功能恢复正常,无RILD死亡患者。无放射治疗相关放射性肺炎、胃溃疡、肠炎等发生。随访期内未见明显迟发型不良反应。
2011年版中国《原发性肝癌诊疗规范》中提到,对于肝癌的分型,可以参考1977年中国肝癌病理研究协作组制定的五大型六亚型分类,把直径5~10 cm的肝癌定义为大肝癌[7]。手术切除是肝癌的首选治疗方式。对于老年大肝癌患者,如果符合手术适应证,手术切除仍是可以选择的治疗方式。而对于无手术切除或局部消融治疗的适应证或拒绝接受手术治疗者,根据我国2019年版《原发性肝癌诊疗规范》[1],可考虑给予SBRT或肝动脉栓塞治疗(TACE)作为替代治疗手段。2009年国内《原发性肝癌规范化诊治专家共识》[8]已经将放射治疗列入可选择的治疗方法,2011年国内《原发性肝癌诊疗规范》再次明确肝癌的放疗指征[7]。
SBRT虽然应用广泛,但对于大肝癌的治疗效果,无论是LC还是OS方面均不能令人满意。一项对不可切除中等大小(3~8 cm)肝癌患者利用TACE和SBRT治疗的对比性研究表明,经匹配评分后3年LC分别为77.5%和55.6%,OS分别为55%和13%,差异具有统计学意义[9],说明TACE具有更好的疗效。
随着放疗技术和设备的发展,TACE在肝癌领域的应用越来越多。对于不同肝癌分期、不同肿瘤大小及是否合并门脉癌栓的患者均适合进行治疗。目前关于老年肝癌患者接受TACE的文献并不多见,尤其是高龄患者,80岁以上肝癌患者少见,大肝癌则更少,而接受治疗者寥寥无几。
国外的研究表明,对于年龄超过70岁的患者,以射波刀为代表的TACE具有良好的安全性和LC,1年LC为77%~88%,2年为43%,中位生存期为9个月[10,11,12,13]。我国台湾学者早在2004年就报道了44例肿瘤直径6~25 cm大肝癌患者采用三维适形TACE,接受40~60 Gy剂量照射,总有效率为61%,未见3度及以上不良反应[14]。本研究中DCR为85.37%(70/82),1和2年的LC分别为95.1%(78/82)和92.3%(76/82),中位生存期为20个月,且治疗过程中未见明显不可耐受的不良反应,均高于上述报道,说明射波刀治疗较其他的TACE具有更好的治疗效果。本研究的LC较好,但PFS和OS较个别研究[15]低,主要考虑可能与本组患者年龄较大有关。此外,本组患者随访至2020年1月总死亡人数共54例,其中在LC较好的情况下有39例死于靶区外肿瘤复发转移致肝功能衰竭,9例死因为肝硬化严重并发症,占死亡总数的88.9%(48/54),提示肿瘤治疗后的定期复查和辅以分子靶向药物和(或)免疫治疗药物为主的系统治疗对于延长生存期可能具有一定作用,同时也要重视肝硬化相关并发症的防治。
从不良反应来看,本研究中的患者仅有轻微的放射治疗反应,患者均可耐受,没有影响治疗计划的完成。虽然有9例患者出现了RILD,但无因肝损伤死亡病例。因射波刀的治疗精确度很高可以达到亚毫米级别,所以本组研究中没有常规放射治疗常见的放射治疗相关放射性肺炎、胃溃疡、肠炎等发生。因肝癌患者绝大多数具有肝硬化门静脉高压背景,基础白细胞、血小板数值偏低,在治疗前后及治疗中经常会使用重组人粒细胞刺激因子和重组人血小板生成素等药物,有些患者会出现治疗后比治疗前数值还明显升高的情况,所以无法准确判定骨髓抑制的情况,故本研究对此问题没有进行统计分析。
肝癌的预后预测因素较复杂,文献报道不一。Lo等[16]研究表明,Child-pugh分级、是否有门静脉癌栓及是否有肝外转移是OS的独立预测因素。另一项有关射波刀治疗的研究表明,除了Child-pugh分级和门静脉癌栓外,肿瘤大小和治疗应答情况也是OS的独立预测因素[17]。近年来血清白蛋白-胆红素(ALBI)基线评分系统[18,19]成为预测肝癌预后的一个重要评分系统。本研究Cox比例风险模型多因素分析显示AFP水平与OS预后显著相关,AFP水平升高的患者预后较差,这与Robbins等和Wong等[20,21]的报道一致,而Jung等[22]报道,AFP水平在治疗后3个月恢复正常意味着预后良好。这提示我们在进行放射治疗前后,对AFP进行定期监测非常重要。
综上所述,射波刀治疗老年原发性大肝癌具有较好的安全性,患者的耐受性好。本研究观察的是70岁及以上年龄组的疗效,对于60~70岁患者,我们也正在数据统计中,并拟与70岁及以上人群进行对比研究。下一步应创造条件积极开展前瞻性、随机对照、多中心临床研究,包括射波刀联合SBRT对比射波刀单独治疗、射波刀治疗结束后辅助全身系统治疗的获益情况等,以获取高级别的循证医学证据,为临床治疗提供有力的理论依据。
所有作者均声明不存在利益冲突



























