
探索轻度认知障碍(MCI)患者脑白质病变与空间导航能力之间的关系。
选取2015年1月至2018年2月在南京大学医学院附属鼓楼医院就诊的32例MCI患者[年龄(66±11)岁,男16例,女16例]以及年龄、性别、受教育程度匹配的28位健康对照组(NC)[年龄(70±11)岁,男19名,女9名]进行空间导航能力测试和神经行为心理学量表评价;采用横断面研究,所有被试同时均进行3.0T磁共振三维液体反转恢复序列及高分辨T1加权成像扫描,采用白质高信号分割工具包(W2MHS)自动标记并提取白质高信号的体积。
MCI患者自我参照导航(P=0.002)、环境参照导航(P=0.039)的平均误差距离均大于对照组,混合(环境参照和自我参照)导航的平均误差距离与正常对照组无差异(P=0.070),而全脑白质高信号体积、侧脑室旁白质高信号体积、深部白质高信号体积组间差异无统计学意义(均P>0.05)。偏相关分析显示控制年龄、性别、教育程度及全脑容积后,MCI患者混合(环境参照和自我参照)导航的平均误差距离与全脑白质高信号体积、深部白质高信号体积及侧脑室旁白质高信号体积呈正相关(r=0.469、0.434、0.512,均P<0.05),环境参照导航的平均误差距离与侧脑室旁白质高信号体积(r=0.403,P=0.033)正相关,自我参照导航平均误差距离与脑白质高信号体积无关联性。
MCI患者空间导航能力与脑白质病变有关,对进一步研究影响人类空间导航能力的潜在生物学机制具有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
空间导航是指人们在不同地点移动时,运用自身及环境线索选择、确定并执行导航路线的一种能力,包括执行功能、计划、注意、空间记忆、路线学习、方位等[1],其中最为重要的是自我参照和环境参照导航[2]。阿尔茨海默症(AD)患者,甚至是其临床前期状态即轻度认知障碍(MCI)时,空间导航能力就出现明显受损。50%~89%的AD患者出现在熟悉环境中迷路,25%的MCI患者也表现出在陌生环境中失去方向感[3]。目前的研究认为右侧海马、尾状核和楔前叶体积与路径整合导航能力和空间记忆力有关[4,5],但白质相关病变对空间导航影响的研究较少。脑白质高信号是脑小血管病的一种表现,与认知障碍密切相关[6],主要表现为执行功能下降。空间导航能力是一种复杂的认知功能,与皮层下功能有关,研究表明执行功能与空间导航能力表现有关[7],然而关于空间导航损害的脑白质微结构基础研究较少,因此探究空间导航能力减退相关的脑白质病变从而指导临床进行痴呆的早期诊疗尤为重要。
MCI的诊断参照Petersen[8]的标准:(1)主诉记忆障碍且有知情者证实;(2)有记忆损害的客观证据;(3)总体认知功能呈轻度异常:简易智能状态检查量表(MMSE)评分25~26分,蒙特利尔认知评价量表(MoCA)19~25分;(4)日常生活活动能力(ADL)正常。
严重抑郁症、精神分裂症等精神疾病患者;既往有脑肿瘤、脑血管病史、癫痫患者;有磁共振成像(MRI)禁忌的患者。
采用横断面研究,收集2015年1月至2018年2月南京大学医学院附属鼓楼医院神经内科和老年科就诊的MCI患者32例(其中男16例,女16例)。28名认知正常的健康对照者(NC)来自同期门诊(其中男19名,女9名),性别、年龄、受教育程度与MCI组匹配,无认知功能障碍,无痴呆家族史。入组的所有被试MRI检查除脑萎缩和三维液体反转恢复序列(3D FLAIR)显示不同程度脑白质高信号外,无其他异常改变。本研究经南京大学医学院附属鼓楼医院道德伦理委员会审核批准(2016-065-01),所有受试者或其家属均知情同意并签署知情同意书。
采用计算机空间导航障碍测试系统(AMUNET,奥地利NeuroScios GmbH公司)进行空间导航能力测试。该测试系统基于人类水迷宫试验,使用计算机模拟空间导航评价空间导航能力。测试内容包括自我按照导航、环境参照导航。测试方法为隐藏目标测验,如图1所示[9],要求受试者在计算机虚拟环境中寻找到隐藏的目标(通过鼠标在计算机屏幕上定位),分为3项子任务,即混合(自我和环境)参考系、自我参考系、环境参考系,每项子任务包括8项试验以评价受试者学习能力,计算机自动生成学习曲线,记录每项试验中鼠标停留位置与真实目标位置之间的误差距离,每项子任务取8次试验的平均值作为空间导航能力评分。误差距离越大,提示受试者偏离真实目标位置的距离较大,表明空间导航能力越差。


使用荷兰Philips Achieva 3.0T TX MR扫描仪,8通道头线圈采集数据。所有受试者均先行常规MRI检查[三维T1加权成像(3D T1WI),T2加权成像(T2WI),弥散加权成像(DWI)]以除外神经系统疾病。3D T1WI扫描参数:重复时间(TR)9.80 ms、回波时间(TE)4.60 ms,体素大小(voxel)1 mm×1 mm×1 mm,视野(FOV)256 mm×256 mm,层厚1 mm、扫描时间7 min18 s,共扫描192层。3D FLAIR扫描参数如下:重复时间(TR)/回波时间(TE)=4 500/339 ms;视野(FOV)为247 mm2×190 mm2,体素大小为0.95 mm×0.95 mm×0.95 mm,扫描时间5 min15 s,共扫描200层。
W2MHS(http://www.nitrc.org/projects/w2mhs)软件是由威斯康辛州阿尔茨海默研究中心开发的白质高信号分割工具包[10],是一款基于MATLAB与SPM的开源工具包,包含3个模块:(1)预处理模块:首先将3D TIWI与3D FLAIR数据配准到标准空间,并基于SPM12提取白质、灰质、脑脊液的部分容积估计值;(2)分割模块:采用基于随机森林和支持向量机构件的分类器来检测白质病变的分布;(3)定量模块:计算白质病变所占有的体素数量,然后乘以FLAIR图像的体素分辨率即可得到白质高信号体积(mm3),最终得到侧脑室旁白质高信号体积、深部脑白质高信号体积和全脑白质高信号体积。
应用SPSS 21.0软件进行数据处理与分析。年龄、教育程度、MMSE评分、MoCA评分、空间导航平均误差距离和脑白质高信号体积符合正态分布,以 ±s表示;采用独立样本t检验进行两组间比较;采用率和频数描述性别等定性资料。空间导航能力与脑白质高信号体积的相关性采用Pearson相关分析。双侧检验,检验水准α=0.05。
±s表示;采用独立样本t检验进行两组间比较;采用率和频数描述性别等定性资料。空间导航能力与脑白质高信号体积的相关性采用Pearson相关分析。双侧检验,检验水准α=0.05。
MCI组32例,年龄(66±11)岁,健康对照组28名,年龄(70±11)岁。年龄、性别及教育程度组间差异无统计学意义(均P>0.05)。MCI组及正常对照组间的MMSE评分和MoCA评分差异均有统计学意义(均P<0.05)。两组被试的基本信息详见表1。
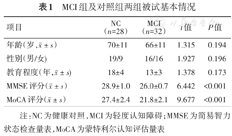
MCI组及对照组两组被试基本情况
MCI组及对照组两组被试基本情况
| 项目 | NC(n=28) | MCI(n=32) | t值 | P值 |
|---|---|---|---|---|
年龄(岁, ± s) ± s) | 70±11 | 66±11 | 1.315 | 0.194 |
| 性别(男/女) | 19/9 | 16/16 | 1.927 | 0.196 |
教育程度(年, ± s) ± s) | 18±4 | 13±3 | 1.378 | 0.173 |
MMSE评分( ± s) ± s) | 28.9±1.0 | 26.0±0.7 | 6.442 | <0.001 |
MoCA评分( ± s) ± s) | 27.4±2.4 | 21.8±2.1 | 9.677 | <0.001 |
注:NC为健康对照,MCI为轻度认知障碍;MMSE为简易智力状态检查量表,MoCA为蒙特利尔认知评估量表
MCI患者自我参照导航、环境参照导航的平均误差距离均大于对照组(均P<0.05),表明MCI患者存在空间导航能力障碍,而混合(环境参照和自我参照)导航的平均误差距离与正常对照组差异无统计学意义(P=0.070)。两组被试的全脑白质高信号体积、侧脑室旁白质高信号体积、深部白质高信号体积以及全脑体积差异均无统计学意义(均P>0.05)(表2)。
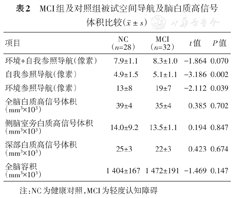
MCI组及对照组被试空间导航及脑白质高信号体积比较( ±s)
±s)
MCI组及对照组被试空间导航及脑白质高信号体积比较( ±s)
±s)
| 项目 | NC(n=28) | MCI(n=32) | t值 | P值 |
|---|---|---|---|---|
| 环境+自我参照导航(像素) | 7.9±1.1 | 8.3±1.0 | -1.864 | 0.070 |
| 自我参照导航(像素) | 4.9±1.5 | 5.1±1.1 | -3.186 | 0.002 |
| 环境参照导航(像素) | 13±8 | 19±7 | -2.112 | 0.039 |
| 全脑白质高信号体积(mm3×103) | 39±4 | 35±4 | 0.385 | 0.702 |
| 侧脑室旁白质高信号体积(mm3×103) | 14.0±9.2 | 13.5±1.1 | 0.194 | 0.847 |
| 深部白质高信号体积(mm3×103) | 25±3 | 22±3 | 0.423 | 0.674 |
| 全脑容积(mm3×103) | 1 404±167 | 1 472±191 | -1.469 | 0.147 |
注:NC为健康对照,MCI为轻度认知障碍
偏相关分析显示控制年龄、性别、教育程度以及全脑容积后,MCI患者混合(环境参照和自我参照)导航的平均误差距离与全脑白质高信号体积、深部白质高信号体积及侧脑室旁白质高信号体积正相关(r值分别为0.469、0.434、0.512,均P<0.05),环境参照导航的平均误差距离与侧脑室旁白质高信号体积正相关(r=0.403,P=0.033),自我参照导航平均误差距离与脑白质高信号体积无相关性(表3及图2)。正常对照组中,脑白质高信号体积与空间导航能力的相关性无统计学意义(表4)。
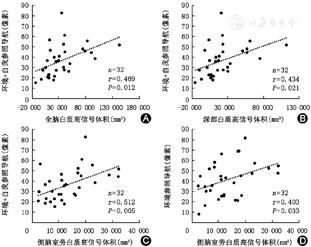

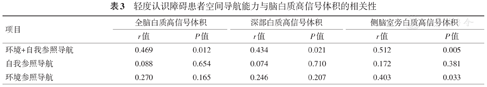
轻度认识障碍患者空间导航能力与脑白质高信号体积的相关性
轻度认识障碍患者空间导航能力与脑白质高信号体积的相关性
| 项目 | 全脑白质高信号体积 | 深部白质高信号体积 | 侧脑室旁白质高信号体积 | |||
|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | |
| 环境+自我参照导航 | 0.469 | 0.012 | 0.434 | 0.021 | 0.512 | 0.005 |
| 自我参照导航 | 0.088 | 0.654 | 0.074 | 0.710 | 0.172 | 0.381 |
| 环境参照导航 | 0.270 | 0.165 | 0.246 | 0.207 | 0.403 | 0.033 |
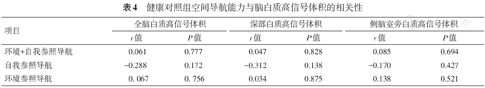
健康对照组空间导航能力与脑白质高信号体积的相关性
健康对照组空间导航能力与脑白质高信号体积的相关性
| 项目 | 全脑白质高信号体积 | 深部白质高信号体积 | 侧脑室旁白质高信号体积 | |||
|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | |
| 环境+自我参照导航 | 0.061 | 0.777 | 0.047 | 0.828 | 0.085 | 0.694 |
| 自我参照导航 | -0.288 | 0.172 | -0.312 | 0.138 | -0.170 | 0.427 |
| 环境参照导航 | 0. 067 | 0. 756 | 0.034 | 0.875 | 0.138 | 0.521 |
本研究发现MCI患者自我参照导航、环境参照导航均出现不同程度受损。自我参考系导航是以自身位置信息解码空间信息来保持移动时的方向感,其结构基础主要位于顶叶皮层、纹状体和尾状核[5],而环境参考系导航则依赖于认知地图,要求人以探索性的视角记忆并分析环境信息,包括地标的位置、起点与目标的距离与方向等,海马、海马旁回和内嗅皮层等主要负责其功能[11]。而在AD的病理进程中,内嗅皮层和海马是首先出现Aβ沉积与tau蛋白表达的位置[12],这些脑区的病变可能造成边缘系统与大脑高级皮层的失连接,从而出现空间导航受损的表现。
有研究认为脑白质病变与认知功能障碍有关,而且随着病变严重程度的增加,认知功能下降越严重[13]。同时脑白质病变导致的认知障碍主要表现为执行功能下降、信息处理速度减慢[14]。执行功能障碍可能是由于额叶-皮层下环路破坏所致,同时海马背侧区有少数特定的神经元直接投射到内侧前额叶皮层的边缘下区和前区[15],脑白质病变可能引起这些神经环路的破坏,从而引起混合(环境参照和自我参照)导航能力的减退。人类空间导航网络是涉及枕叶-顶叶-额叶-颞叶等广泛的脑区活动。与深部脑白质病变相比较,Kim等[16]认为侧脑室旁的脑白质病变对患者信息处理速度、执行功能等影响更大,而且一般脑室周围脑白质病变范围以及病灶的体积比深部白质病变范围更广,可以引起更广的认知域损害。本研究也发现了侧脑室旁白质高信号病变越严重,环境参照导航能力损害越大。
本研究也存在不足之处,首先,研究的样本量偏小,后续将会进一步收集被试,对研究结果的稳定性进行验证;其次,本研究针对脑白质病变分别进行了侧脑室旁和深部白质病变的体积测量,后续计划进一步对病变进行精细化分割,如对额叶、顶叶、颞叶等部位的脑白质病变分别进行测量,后续研究将会进一步完善。综上所述,本研究探索了MCI患者空间导航能力与脑白质病变的相关性,发现全脑白质病变越严重,混合导航能力越差,侧脑室旁白质病变越重,环境导航能力越差,这对进一步理解空间导航障碍的神经机制具有重要意义。
所有作者均声明不存在利益冲突



























