
探讨前列腺成像报告和数据系统(PI-RADS)评分与前列腺癌(PCa)国际泌尿病理协会(ISUP)分级之间的相关性以及PI-RADS评分在预测临床有意义PCa(csPCa)、切缘阳性、病理升级等病理特征方面的作用。
将2013年5月至2019年12月间在苏北人民医院泌尿外科行多参数磁共振(mpMRI)病理为阳性患者纳入研究,根据病理检查方式分为活检组(523例)和根治性前列腺切除术(RP)组(215例),评估两组PI-RADS评分与ISUP分级之间的相关性以及预测csPCa的准确性,对RP组进一步探讨PI-RADS评分与术后病理升级或降级情况和切缘阳性之间的相关性,以及受试者工作特征(ROC)曲线下与坐标轴围成的面积(AUC)。
活检组和RP组的年龄分别为(72±8)岁和(68±7)岁,前列腺体积分别为48.3(32~57)cm3和47.2(32~54)cm3,前列腺特异抗原(PSA)水平分别为26.3(10.2~34.2)μg/L和21.7(9.24~23.95)μg/L;活检组PI-RADS评分≤3、4、5分别为109例、97例、317例,RP组为61例、55例、99例;活检组和RP组不同PI-RADS评分的ISUP分级组成存在差异,且差异有统计学意义(P均<0.001),两者之间呈正相关(活检组r=0.493,RP组r=0.671,P均<0.001);利用PI-RADS评分预测csPCa,活检组(AUC=0.764,P<0.001,95%CI:0.710~0.819)和RP组(AUC=0.807,P<0.001,95%CI:0.735~0.879)均有一定的准确性,结合PSA,可以提高活检组(AUC=0.795,P<0.001,95%CI:0.746~0.843)和RP组(AUC=0.852,P<0.001,95%CI:0.789~0.915)对csPCa预测的准确性。RP组术后病理结果与穿刺病理结果相比,52.6%的患者出现了ISUP分级的变化,在升级和降级的患者中PI-RADS评分组成差异无统计学意义(P>0.05),但是在活检为ISUP 1级的患者中41.7%(27/65)出现了病理升级,PI-RADS≤3分占33.3%,而PI-RADS>3分占66.7%,两组之间差异有统计学意义(P<0.05)。术后43.3%的患者切缘阳性,PI-RADS评分≤3、4、5分的患者分别为13例(14%)、24例(25.8%)、56例(60.2%),而切缘阴性患者的PI-RADS评分≤3、4、5分分别为48例(39.3%)、31例(25.4%)、43例(35.2%),两者差异有统计学意义(P<0.001),PI-RADS评分越高,切缘阳性可能性越大。
PI-RADS评分与PCa的ISUP分级存在相关性,联合PSA可较为准确地预测csPCa;同时PI-RADS评分越高,RP后切缘阳性和穿刺时Gleason评分3+3=6分的患者病理升级的可能性越大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多参数磁共振(mpMRI)作为诊断前列腺癌(PCa)最佳的影像学方法,为简化和标准化mpMRI报告,提升诊断效能,欧洲泌尿生殖放射学学会(ESUR)于2012年提出并制定了前列腺成像报告和数据系统(PI-RADS)诊断标准[1],2015年更新第2版[2],目前在PCa检测、指导活检、局部分期、术前评估、术后随访检测方面发挥着重要的作用,但是PI-RADS在PCa的侵袭性、预后和死亡风险方面的作用未完全明确。PCa病理的Gleason评分(GS)仍然是预测PCa的侵袭性、预后和死亡风险的最有用标记之一[3]。因此本研究通过回顾性分析探讨PI-RADS评分与病理结果之间的相关性,以及PI-RADS评分在预测病理特征方面的作用。
回顾性分析2013年5月至2019年12月间在苏北人民医院泌尿外科经会阴模板引导下前列腺活检阳性患者。(1)纳入标准:①活检前行3.0T mpMRI并由影像科医师按照PI-RADSV2标准评分;②患者行mpMRI检查后2个月内行根治性前列腺癌切除术(RP)。(2)排除标准:①在活检或RP前行PCa辅助治疗;②前列腺特异性抗原(PSA)不详;③其他病理类型肿瘤。
纳入患者的PSA数据均为前列腺活检前2周内检查所得,对于>2周的患者活检前重新检测PSA水平。PSA发现异常后再进一步行前列腺MRI检查;对于首先发现直肠指诊异常患者,PSA和MRI检查同期进行。所有患者MRI的PI-RADS评分均由同一名有经验的泌尿影像科医师按照PI-RADS第2版标准给出;2015年以前患者的PI-RADS评分由同一名泌尿影像科医师在不知晓活检结果的情况下按照标准回顾性给出。
根据PSA水平和MRI结果决定行前列腺活检,根据前列腺大小和体积,按照11区分区穿刺活检(图1),每区1~4针,标本分区送检。
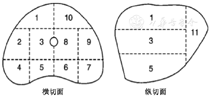

注:1:右前区;2:右中外区;3:右中区;4:右后外侧角区;5:右后区;6:左后区;7:左后外侧角区;8:左中区;9:左中外区;10:左前区;11:前列腺尖部
所有病理切片均由同一名有经验的泌尿外科病理医师评估并报告,按照Gleason评分和国际泌尿病理协会(ISUP)分级分组系统进行评分,对Gleason评分≤2分不予以报告,根据PI-RADS第2版[4]和Epstein标准[5,6]中的定义,将临床上有意义前列腺癌(csPCa)定义如下:(1)Gleason评分≥7分;(2)肿瘤体积为≥0.5 cm3;(3)包膜侵犯或精囊浸润。若可疑区域涉及多个活检区域,则以最高级病理为准。RP标本部分行前列腺大组织切片(28例),其余标本在取材时,病理医师按照活检的病理结果、标本的大体表现和MRI对可疑病灶位置描述,单独对该区域取材并报告,并以此结果纳入研究,剩余的标本常规取材报告。根据病理检查方式分为活检组(523例)和RP组(215例),评估两组PI-RADS评分与ISUP分级之间的相关性以及预测csPCa的准确性。计算活检组和RP组不同指标预测csPCa的受试者工作特征(ROC)曲线下面积(AUC)。本研究为诊断性试验研究,获得医院伦理委员会的批准和患者的知情同意。
在研究中发现PSA>100 μg/L的患者,PI-RADS评分几乎均为5分,同时Gleason评分>8分占比大,且样本量多(活检组171例、RP组6例),若在研究中纳入此部分患者容易导致数据分布严重不均,进而影响结论的有效性,因此对于PSA>100 μg/L的患者不纳入统计分析中,只简单描述结果。
数据采用SPSS 20.0统计学软件分析,计数资料以例(%)表示;计量资料先行正态性检验,对于正态分布的计量资料以 ±s表示,非正态分布的计量资料以M(Q1,Q3)表示;对计数资料采用χ2检验比较构成比例差异是否存在统计学意义,采用Spearman相关分析计算PI-RADS评分与ISUP分级之间的相关性;计算AUC评估PI-RADS评分预测csPCa的能力。双侧检验,检验水准α=0.05。
±s表示,非正态分布的计量资料以M(Q1,Q3)表示;对计数资料采用χ2检验比较构成比例差异是否存在统计学意义,采用Spearman相关分析计算PI-RADS评分与ISUP分级之间的相关性;计算AUC评估PI-RADS评分预测csPCa的能力。双侧检验,检验水准α=0.05。
PSA<100 μg/L活检组纳入样本523例,RP组纳入215例;正态性检验发现两组年龄服从正态分布,而PSA和前列腺体积则为非正态分布;活检组和RP组的年龄分别为(72±8)岁和(68±7)岁,前列腺体积分别为48.3(32~57)cm3和47.2(32~54)cm3,PSA水平分别为26.3(10.2~34.2)μg/L和21.7(9.24~23.95)μg/L(图2)。


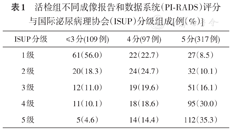
活检组不同成像报告和数据系统(PI-RADS)评分与国际泌尿病理协会(ISUP)分级组成[例(%)]
活检组不同成像报告和数据系统(PI-RADS)评分与国际泌尿病理协会(ISUP)分级组成[例(%)]
| ISUP分级 | ≤3分(109例) | 4分(97例) | 5分(317例) |
|---|---|---|---|
| 1级 | 61(56.0) | 22(22.7) | 27(8.5) |
| 2级 | 20(18.3) | 24(24.7) | 32(10.1) |
| 3级 | 12(11.0) | 19(19.6) | 51(16.1) |
| 4级 | 11(10.1) | 18(18.6) | 95(30.0) |
| 5级 | 5(4.6) | 14(14.4) | 112(35.3) |
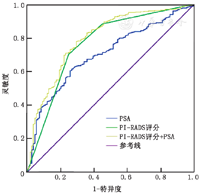
其构成比例差异有统计学意义(P<0.001),PI-RADS评分与ISUP分级呈正相关(r=0.493,P<0.001),PSA与ISUP分级之间也存在正相关(r=0.419,P<0.001);不同指标预测csPCa的ROC曲线分析(图4),发现PI-RADS评分(AUC=0.764,P<0.001,95%CI:0.710~0.819)和PSA(AUC=0.700,P<0.001,95%CI:0.649~0.752)对csPCa的预测有较高的准确性,两者联合可提高预测的准确性(AUC=0.795,P<0.001,95%CI:0.746~0.843)。



根治性前列腺切除术组不同成像报告和数据系统(PI-RADS)评分与国际泌尿病理协会(ISUP)分级组成[例(%)]
根治性前列腺切除术组不同成像报告和数据系统(PI-RADS)评分与国际泌尿病理协会(ISUP)分级组成[例(%)]
| ISUP分级 | ≤3分(61例) | 4分(55例) | 5分(99例) |
|---|---|---|---|
| 1级 | 30(49.2) | 8(14.5) | 4(4.0) |
| 2级 | 26(42.6) | 25(45.5) | 11(11.1) |
| 3级 | 4(6.6) | 11(20.0) | 21(21.2) |
| 4级 | 0 | 5(9.1) | 22(22.2) |
| 5级 | 1(1.6) | 6(10.9) | 41(41.4) |
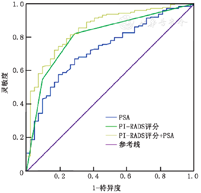
其构成比例差异有统计学意义,PI-RADS评分与ISUP分级存在正相关(r=0.671,P<0.001),PSA与ISUP分级之间也有正相关性(r=0.417,P<0.001);不同指标预测csPCa的ROC曲线分析(图6),发现PI-RADS评分(AUC=0.807,P<0.001,95%CI:0.735~0.879)和PSA(AUC=0.731,P<0.001,95%CI:0.652~0.810)对csPCa的预测有较高的准确性,两者联合可提高预测的准确性(AUC=0.852,P<0.001,95%CI:0.789~0.915)。RP组术后病理结果与穿刺病理结果相比,113例(52.6%)患者出现ISUP分级的变化,其中升级63例(29.3%),PI-RADS评分≤3、4、5分的患者分别为10例(15.9%)、20例(31.8%)、33例(52.4%);降级50例(23.3%),PI-RADS评分≤3、4、5分的患者分别为13例(26%)、14例(28%)、23例(46%);两者的构成比差异无统计学意义(P=0.312);但在65例活检病理为Gleason评分3+3=6的患者中27例(41.7%)在RP病理中出现了病理升级,其中PI-RADS≤3分的37例患者中9例(24.3%)出现了升级,在升级患者占33.3%(9/27),而28例PI-RADS>3分患者中有18例(64.3%),在升级患者占66.7%(18/27),差异有统计学意义(P=0.001)。RP术后93例(43.26%)患者切缘阳性,PI-RADS评分≤3、4、5分的患者分别为13例(14%)、24例(25.8%)、56例(60.2%),而切缘阴性患者的PI-RADS评分≤3、4、5分分别为48例(39.3%)、31例(25.4%)、43例(35.2%),差异有统计学意义(P<0.001),PI-RADS评分越高,切缘阳性可能性越大。

活检组171例,RP组6例。统计结果见表3。在活检组中PI-RADS评分5分的占比高达98.8%(169/171),病理结果均为csPCa,其中85.4%(146/171)的活检结果ISUP分级≥4级;其中6例在本院行RP,病理结果:5例ISUP分级≥4级,切缘全部阳性,5例有精囊腺侵犯,3例包膜受侵,3例出现盆腔淋巴结阳性。
活检组与根治性前列腺切除术(RP)组前列腺特异抗原>100 μg/L患者病理结果统计表[例(%)]
活检组与根治性前列腺切除术(RP)组前列腺特异抗原>100 μg/L患者病理结果统计表[例(%)]
| ISUP分级 | 活检组 | RP组 | ||
|---|---|---|---|---|
| ≤3分(1例) | 4分(1例) | 5分(169例) | 5分(6例) | |
| 1级 | 0 | 0 | 0 | 0 |
| 2级 | 1 | 0 | 4(2.4) | 1 |
| 3级 | 0 | 0 | 20(11.8) | 0 |
| 4级 | 0 | 0 | 38(22.5) | 1 |
| 5级 | 0 | 1 | 107(63.3) | 4 |
本研究发现活检组和RP组的PI-RADS评分越高,ISUP分级也越高,差异有统计学意义(P均<0.001)。相关性分析也发现PI-RADS评分与ISUP分级存在正相关性(活检组r=0.493,RP组r=0.671,P均<0.001);在PSA>100 μg/L时,PI-RADS评分几乎均为5分,活检组和RP组共有85.3%(151/177)的患者ISUP分级≥4级。因此我们认为PI-RADS评分越高,PCa的ISUP分级也越高。之前的研究发现肿瘤的Gleason评分与较高的PI-RADS评分的特征相关(病灶体积大、T2均匀低信号,低ADC值、DCE早期强化等)[7,8,9]。因此在前列腺活检时,针对高PI-RADS评分病灶行靶向活检可以提高诊断的准确性[10],有助于准确高效地诊断csPCa[11,12,13],减少过度诊治[14]。对于PSA<100 μg/L的患者,我们的研究结果也发现活检时PSA水平与病理分级也存在正相关(活检组r=0.419,RP组r=0.417,P均<0.001);同时在PSA>100 μg/L、活检及RP病理结果均为csPCa,且ISUP分级≥4级的占比大,Ang等[15]研究中发现在PSA>100 μg/L时,70.9%(134/189)的患者ISUP分级≥4级。PCa在分泌PSA的同时也破坏前列腺屏障导致血PSA明显升高,肿瘤的恶行程度越高、体积越大,血PSA也越高,所以PSA水平与PCa的Gleason评分也存在相关性,但是PSA水平还与前列腺体积、肿瘤体积、侵犯程度、检测的时间相关,因此相关程度不高。
在临床上对于无临床意义前列腺癌(ncsPCa)可考虑积极主动监测(AS),期望在不影响患者健康的情况下尽量减少手术风险和并发症,因此在临床上如何区分ncsPCa和csPCa则显得尤为重要。在本研究中发现PI-RADS评分和PSA对活检和RP后病理为csPCa的预测均存在一定的准确性,既往文献也有类似报道[16],通过比较发现PI-RADS评分的预测能力高于PSA;联合PI-RADS评分和PSA预测csPCa的准确性,无论活检组还是RP组均较单一指标高。有作者对12个国家21个研究中心的10 296例AS的PCa患者进行了5年的随访,发现有43.6%的患者退出AS,其中27.5%的患者出现了疾病进展[17]。同时本研究中也发现活检病理为ISUP 1级的患者中有41.5%在RP后病理出现了升级,在其他研究中也得到了类似的结论[18],而且PI-RADS>3分患者RP术后病理出现升级的比例明显高于≤3分(P<0.05),因此PI-RADS评分可以较准确地预测csPCa,联合PSA可以提高预测的准确性。PI-RADS>3分活检病理为Gleason评分3+3=6的患者RP术后病理升级的可能性较大,因此在对此类患者行主动检测时,只考虑活检的病理结果容易出现延误患者最佳治疗的时间。
前列腺活检时的病理组织较少,而且是细小的组织条,因此只能在一定程度上反映PCa的病理结果,存在取材位置不准或标本不够而引起漏诊或诊断不准确的可能性;而RP术后病理可进行充分取材,可以几乎真实地反映PCa的病理情况,因而RP术后病理较活检病理更为准确,因此RP组的统计分析结果可能更为准确地反映PI-RADS评分与Gleason评分的相关性。与活检病理相比,RP病理会出现一定的升级与降级情况,本研究中有52.6%出现ISUP分级的变化,但是出现变化与不同PI-RADS评分无明显关系(P>0.05),但是在对于活检病理为Gleason评分3+3=6的患者,PI-RADS>3分的患者更容易出现升级的情况。RP术后病理检查有93例(43.3%)切缘阳性的患者,统计发现PI-RADS评分越高,切缘阳性可能性越大。这可能因为PI-RADS评分越高,肿瘤的Gleason评分也越高,肿瘤生长速度以及向周围侵犯能力也越强,因此导致了切缘阳性的发生,当然与患者前列腺形态、手术操作空间以及术者的手术技巧也存在一定的相关性。Ang等[15]对241例PSA>100 μg/L的PCa患者随访研究,发现这部分患者的5年和10年总体生存率较差,与肿瘤的Gleason评分和转移相关。在本研究中发现在PSA>100 μg/L的RP患者中,术后病理也发现出现较差的病理特征(切缘阳性、精囊侵犯、局部外侵、淋巴结转移)可能性大,导致这部分患者的预后较差[15,16,17,18,19]。
本研究存在一些不足之处,首先,本研究为回顾性研究,容易产生选择偏倚;其次,在研究中发现mpMRI上多灶性病例较少,只将每位患者的主要明显病灶纳入研究,可能会产生一定的误差。本研究只对PI-RADS评分与Gleason评分之间的相关性进行了研究,对引起mpMRI信号改变的组织结构原因需要更进一步地进行研究进行探讨。
总之,PI-RADS评分与PCa的Gleason评分呈正相关性,PI-RADS评分可以较为准确地预测csPCa,联合PSA可提高准确性;同时PI-RADS评分越高,RP后切缘阳性和活检病理为Gleason评分3+3=6升级的可能性越大,可以给临床诊断和治疗决策提供依据。
所有作者均声明不存在利益冲突



























