
分析经皮冠状动脉介入(PCI)治疗对不同左室射血分数的低危SYNTAX评分缺血性心肌病患者左室重塑及主要不良心血管事件(MACE)的影响。
观察2017年5月至2018年10月在福建医科大学附属协和医院行成功PCI的191例缺血性心肌病患者,根据术前左室射血分数(LVEF)分为≥50%组、36%~49%组和≤35%组,主要终点为1年内再发急性左心衰、再发心绞痛、支架内再狭窄、靶血管再次血运重建、再次非致死性心肌梗死、心源性死亡、非心源性死亡,同时分析1年时左室舒张末期容积、LVEF。通过方差分析比较不同LVEF组间MACE以及左室重塑的差别,Logistic回归分析MACE的影响因素。
≥50%组MACE发生率32.6%(15例),36%~49%组MACE发生率32.0%(31例),≤35%组MACE发生率45.8%(22例),三组比较差异无统计学意义(P=0.231);三组1年内发生急性左心衰的比例为(2.2%比12.4%比22.9%),三组间差异有统计学意义(P=0.01);多因素分析结果显示,术前左室射血分数≤35%是患者发生急性左心衰的独立预测因素(OR=2.696,95%CI:1.099~6.612,P=0.030)。再通1年前后患者左室舒张末期容积[(62±4)mm比(56±5)mm,P<0.001]、左房[(42±6)mm比(40±6)mm,P<0.001]水平明显低于基线水平,其差异均具有统计学意义;LVEF[(43±10)%比(51±13)%,P<0.001]水平明显高于基线水平,其差异具有统计学意义。1年时复查三组心肌重构相关指标,左室舒张末期容积[(53.1±0.6)mm比(55.1±0.5)mm比(59.1±0.7)mm,P<0.001]、LVEF[(62.1±1.1)%比(51.4±1.0)%比(37.0±1.5)%,P<0.001],差异均有统计学意义。
PCI开通低危SYNTAX评分缺血性心肌病患者的冠状动脉病变,可以明显改善术前LVEF>35%患者的预后,但对术前LVEF≤35%患者效果欠佳;术前LVEF可能是低危SYNTAX评分缺血性心肌病再发急性左心衰的独立预测因素,术后左室重构程度以及左室收缩功能与术前LVEF存在相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
缺血性心肌病(ischemic cardiomyopathy, ICM)是指由于冠状动脉严重狭窄或是冠状动脉慢性完全闭塞引起的心肌功能失常以及心肌代谢障碍性疾病,是我国心力衰竭的主要病因之一[1,2]。目前临床多采用药物及血运重建联合治疗ICM。研究表明,ICM患者的预后与血运重建策略的选择、SYNTAX评分、术前左室射血分数(left ventricular ejection fraction,LVEF)等因素有关[3,4]。在血运重建策略方面,目前主要有经皮冠状动脉介入(percutaneous coronary intervention,PCI)、冠状动脉搭桥(coronary artery bypass grafting,CABG)和血管再生三种疗法。由于缺乏有力的证据,国际指南并未就PCI在管理ICM中的作用提供坚定的建议。Serruys等[5]的研究表明,SYNTAX评分较低(0~22分)的冠状动脉3支病变患者中,PCI与CABG的12个月主要不良心脑血管事件(main adverse cardiovascular and cerebrovascular events,MACCE)发生率相当。除了预后,两种血运重建策略对远期生活质量的影响以及患者的个人选择偏好也是治疗ICM患者时需要考虑的。因此,本研究选择SYNTAX评分低危(0~22分)的ICM患者为研究对象,分析PCI在该类患者治疗中的应用价值,并探讨不同LVEF的ICM患者行PCI术后预后的差异性,以期为其治疗策略的选择提供临床依据。
采用横断面研究方法,回顾性观察2017年5月至2018年10月福建省协和医院收治的ICM并成功完成PCI的患者191例。根据患者术前心脏彩超LVEF结果进行分组,分为≤35%组(48例)、36%~49%组(97例)和≥50%组(46例)三组。本研究符合《赫尔辛基宣言》中伦理要求,所有患者住院时已签署知情同意书,研究过程中未侵犯患者隐私权。
纳入标准:(1)所有患者均符合《内科学》中关于缺血性心肌病的相关诊断标准;(2)心电图伴有病理性或心肌缺血Q波表现;(3)心脏彩超出现心脏扩张:(4)心脏彩超出现节段性室壁运动异常。(5)顺利完成PCI术。
排除标准:(1)合并其他原因所致的心力衰竭和心脏增大(如先天性心脏病、风湿性心脏病、原发性扩张型心肌病、非缺血性的继发性心肌病);(2)心源性休克;(3)合并严重基础疾病(如恶性肿瘤、严重血液系统疾病等)。
基线资料(采自医院标准病历):年龄、性别、生命体征、临床症状、合并疾病、血红蛋白、血生化、D-二聚体、心电图、超声心动图指标、冠状动脉造影和SYNTAX评分。出院后以专科门诊、住院或电话方式进行随访,术后1、3、6、9、12个月各随访1次,观察内容包括心绞痛、心肌梗死、再发心力衰竭或支架内再狭窄、靶血管再次血运重建(包括PCI和CABG)、心血管死亡以及其他原因导致的死亡,术后12个月时复查心脏彩超,若到随访时间结束未发生终点事件者,在术后12个月时复查冠状动脉造影。主要心血管事件终点(major adverse cardiac events,MACE)为1年内再发心绞痛、急性左心衰、再次心肌梗死、支架内再狭窄或再次血运重建(包括PCI和CABG),以及心源性死亡或者其他非心源性死亡。
SYNTAX评分:采用冠状动脉树16分段法,结合冠状动脉的优势分布、病变部位、狭窄程度与病变特征,对直径≥1.5 mm、狭窄程度≥50%的病变进行评分。0~22分为SYNTAX评分低危(SYNTAX评分标准的相关网站http://www.syntaxscore.com/)。
采用SPSS 16.0软件进行统计分析。符合正态分布的计量资料用 ±s表示,若方差齐性,组间比较采用方差分析,进一步两两比较采用LSD-t检验;非正态分布计量资料用M(Q1,Q3)表示,组间比较采用非参数检验。计数资料用例(%)表示,组间的比较采用χ2检验,当组间比较有统计学意义时,进一步两两比较,以P<0.017(0.05/比较次数)为差异具有统计学意义,并做趋势χ2检验以探究组间观察终点的发生率是否存在线性递增或递减关系。自身前后对比采用配对t检验。应用二元Logistic回归分析模型探究MACE事件的独立预测危险因素。以P<0.05为差异具有统计学意义。
±s表示,若方差齐性,组间比较采用方差分析,进一步两两比较采用LSD-t检验;非正态分布计量资料用M(Q1,Q3)表示,组间比较采用非参数检验。计数资料用例(%)表示,组间的比较采用χ2检验,当组间比较有统计学意义时,进一步两两比较,以P<0.017(0.05/比较次数)为差异具有统计学意义,并做趋势χ2检验以探究组间观察终点的发生率是否存在线性递增或递减关系。自身前后对比采用配对t检验。应用二元Logistic回归分析模型探究MACE事件的独立预测危险因素。以P<0.05为差异具有统计学意义。
三组患者在入院时的基线情况如年龄、性别、临床症状(外周水肿、夜间气促、胸闷痛)、高血压、糖尿病、慢性肾功能不全、房室传导阻滞、血红蛋白、D-二聚体、完全血运重建、起搏器、埋藏式心脏复律除颤器、使用血管紧张素转化酶抑制剂、β受体阻滞剂、地高辛、静脉血管活性药方面差异均无统计学意义(均P>0.05);但随着心功能恶化,患者入院时SYNTAX评分、恶性心律失常、肺部感染的比例更高(均P<0.05,表1)。
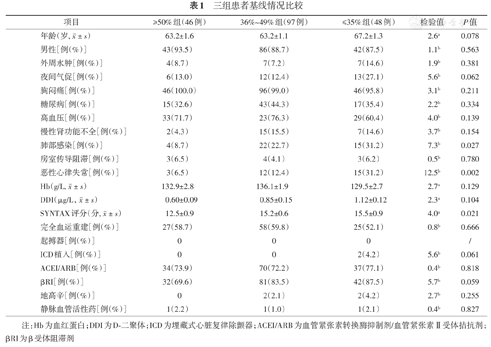
三组患者基线情况比较
三组患者基线情况比较
| 项目 | ≥50%组(46例) | 36%~49%组(97例) | ≤35%组(48例) | 检验值 | P值 |
|---|---|---|---|---|---|
年龄(岁,  ±s) ±s) | 63.2±1.6 | 63.2±1.1 | 67.2±1.3 | 2.6a | 0.078 |
| 男性[例(%)] | 43(93.5) | 86(88.7) | 42(87.5) | 1.1b | 0.563 |
| 外周水肿[例(%)] | 4(8.7) | 7(7.2) | 7(14.6) | 1.9b | 0.381 |
| 夜间气促[例(%)] | 6(13.0) | 12(12.4) | 13(27.1) | 5.6b | 0.062 |
| 胸闷痛[例(%)] | 46(100.0) | 96(99.0) | 46(95.8) | 3.1b | 0.211 |
| 糖尿病[例(%)] | 15(32.6) | 43(44.3) | 17(35.4) | 2.2b | 0.334 |
| 高血压[例(%)] | 33(71.7) | 23(76.3) | 29(60.4) | 4.0b | 0.139 |
| 慢性肾功能不全[例(%)] | 2(4.3) | 15(15.5) | 7(14.6) | 3.7b | 0.154 |
| 肺部感染[例(%)] | 4(8.7) | 22(22.7) | 15(31.2) | 7.3b | 0.027 |
| 房室传导阻滞[例(%)] | 3(6.5) | 4(4.1) | 3(6.2) | 0.5b | 0.780 |
| 恶性心律失常[例(%)] | 3(6.5) | 12(12.4) | 15(31.2) | 12.5b | 0.002 |
Hb(g/L,  ±s) ±s) | 132.9±2.8 | 136.1±1.9 | 129.5±2.7 | 2.7a | 0.129 |
DDI(μg/L, ±s) ±s) | 0.60±0.09 | 0.85±0.15 | 1.12±0.12 | 2.3a | 0.104 |
SYNTAX评分(分,  ±s) ±s) | 12.5±0.9 | 15.2±0.6 | 15.5±0.9 | 4.0a | 0.021 |
| 完全血运重建[例(%)] | 27(58.7) | 58(59.8) | 25(52.1) | 0.8b | 0.666 |
| 起搏器[例(%)] | 0 | 0 | 0 | / | |
| ICD植入[例(%)] | 0 | 0 | 2(4.2) | 5.6b | 0.061 |
| ACEI/ARB[例(%)] | 34(73.9) | 70(72.2) | 37(77.1) | 0.4b | 0.818 |
| βRI[例(%)] | 32(69.6) | 81(83.5) | 42(87.5) | 5.7b | 0.059 |
| 地高辛[例(%)] | 0 | 2(2.1) | 2(4.2) | 2.7b | 0.255 |
| 静脉血管活性药[例(%)] | 1(2.2) | 1(1.0) | 1(2.1) | 0.4b | 0.827 |
注:Hb为血红蛋白;DDI为D-二聚体;ICD为埋藏式心脏复律除颤器;ACEI/ARB为血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂;βRI为β受体阻滞剂
随着基线LVEF越低,出院后1年内患者再发急性左心衰越多,差异有统计学意义(P<0.05),而总体MACE发生率以及非致死性心梗、再次血运重建、支架内再狭窄、心梗相关性死亡、非心梗相关性死亡无明显差异(均P>0.05,表2)。
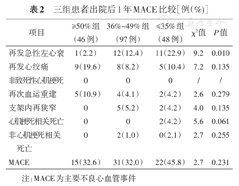
三组患者出院后1年MACE比较[例(%)]
三组患者出院后1年MACE比较[例(%)]
| 项目 | ≥50%组(46例) | 36%~49%组(97例) | ≤35%组(48例) | χ2值 | P值 |
|---|---|---|---|---|---|
| 再发急性左心衰 | 1(2.2) | 12(12.4) | 11(22.9) | 9.2 | 0.010 |
| 再发心绞痛 | 9(19.6) | 8(8.2) | 5(10.4) | 7.2 | 0.135 |
| 非致死性心肌梗死 | 0 | 0 | 0 | / | / |
| 再次血运重建 | 5(10.9) | 4(4.1) | 2(4.2) | 2.6 | 0.279 |
| 支架内再狭窄 | 0 | 5(5.2) | 2(4.2) | 4.0 | 0.135 |
| 心肌梗死相关死亡 | 0 | 0 | 2(4.2) | 5.6 | 0.061 |
| 非心肌梗死相关死亡 | 0 | 2(1.0) | 0(2.1) | 2.7 | 0.255 |
| MACE | 15(32.6) | 31(32.0) | 22(45.8) | 2.7 | 0.231 |
注:MACE为主要不良心血管事件
多因素Logistic回归分析术后再发急性左心衰的独立危险预测因素显示,当校正肺部感染、恶性心律失常、SYNTAX评分等因素后,术前LVEF≤35%仍为ICM患者PCI术后发生急性左心衰的独立预测危险因素(OR=2.696,95%CI:1.099~6.612,P=0.030)。
与PCI前相比,1年后复查,LVEF较前明显提高,舒张末期左心房内径(LA)、左心室舒张末期内径(LVED)较前明显缩小,其差异均有统计学意义(均P<0.05,表3)。
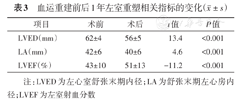
血运重建前后1年左室重塑相关指标的变化( ±s)
±s)
血运重建前后1年左室重塑相关指标的变化( ±s)
±s)
| 项目 | ≥50%组(46例) | 36%~49%组(96例) | ≤35%组(46例) | F值 | P值 |
|---|---|---|---|---|---|
| LVED(mm) | 61.7±0.5 | 62.4±0.4 | 63.0±0.6 | 22.7 | 0.227 |
| LA(mm) | 41.7±0.9 | 40.6±0.6 | 43.6±0.9 | 2.8 | 0.018 |
| LVEF(%) | 56.9±0.5 | 42.4±0.3 | 29.2±0.6 | 565.8 | 0.000 |
注:LVED为左心室舒张末期内径;LA为舒张末期左心房内径;LVEF为左室射血分数
由于有3例患者死亡时间在1年之内,无法观察1年时心脏彩超的指标,故予以剔除。
通过分析发现,再通前LA大小在三组间有差别,进一步两两比较提示,在LVEF≥50%组和LVEF 36%~49%组比较,差异无统计学意义,而≤35%组,LA大于以上两组,而术后三组间LA大小无明显差别。再通前三组LVED大小无明显差别,而再通后三组LVED大小,差异有统计学意义,进一步两两比较发现,随着术前LVEF越大,术后LVED越小,差异均有统计学意义。同时,随着术前LVEF越高,术后LVEF恢复也越好,差异有统计学意义(表4,表5)。
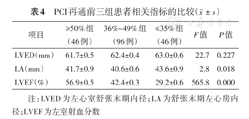
PCI再通前三组患者相关指标的比较( ±s)
±s)
PCI再通前三组患者相关指标的比较( ±s)
±s)
| 项目 | ≥50%组(46例) | 36%~49%组(96例) | ≤35%组(46例) | F值 | P值 |
|---|---|---|---|---|---|
| LVED(mm) | 53.1±0.6 | 55.1±0.5 | 59.1±0.7 | 26.2 | 0.000 |
| LA(mm) | 39.4±0.7 | 39.6±0.6 | 41.8±1.1 | 2.4 | 0.086 |
| LVEF(%) | 62.1±1.1 | 51.4±1.0 | 37.0±1.5 | 95.6 | 0.000 |
注:LVED为左心室舒张末期内径;LA为舒张末期左心房内径;LVEF为左室射血分数
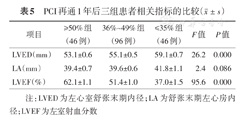
PCI再通1年后三组患者相关指标的比较( ±s)
±s)
PCI再通1年后三组患者相关指标的比较( ±s)
±s)
| 项目 | 术前 | 术后 | t值 | P值 |
|---|---|---|---|---|
| LVED(mm) | 62±4 | 56±5 | 13.4 | <0.001 |
| LA(mm) | 42±6 | 40±6 | 4.6 | <0.001 |
| LVEF(%) | 43±10 | 51±13 | -11.2 | <0.001 |
注:LVED为左心室舒张末期内径;LA为舒张末期左心房内径;LVEF为左室射血分数
ICM是因冠状动脉狭窄或者闭塞导致心肌供血不足,心肌细胞萎缩、营养障碍而发生坏死、凋亡以及纤维组织增生的继发性心肌病。成功的血运重建可以改善心肌细胞供血,改善患者的左室收缩功能,减少心律失常的发生,提高患者的生活质量[6,7]。对于SYNTAX评分低危的患者,PCI与冠状动脉搭桥对患者预后无明显差别[8,9]。
本研究对成功PCI的低危SYNTAX评分的ICM患者进行随访发现,PCI术后1年其LVEF较术前明显提高,LVED、LA较术前明显缩小,差异有统计学意义(均P<0.05),进一步证明了PCI可改善该类患者的左室心肌重塑、提高心功能。其总体MACE发生率为35.6%,与胡锋和陈婷[10]的结果相似,后者PCI+药物治疗后患者总体MACE发生率28.6%,均明显低于单纯药物治疗后的MACE发生率(67.6%)[11]。
相关研究表明,术前患者的LVEF是影响缺血性心肌病患者血运重建后预后的重要因素[12],Djfm等[13]和Caughey等[14]研究发现,入院时LVEF越低的ICM患者终点事件发生率越高。随着心功能恶化,患者发生肺部感染和肾功能受损以及长期低心排血量使患者组织器官灌注不足和功能下降进一步导致预后不良。因此,为了初步筛选出适宜接受介入治疗的目标人群及适当的治疗策略重点,我们对随访对象进行了不同LVEF分组,研究不同LVEF分组对PCI术后MACE以及心肌重塑的影响。本研究结果提示,再通术后1年时间内,LVEF≤35%组患者1年内发生MACE的比例尽管高于其他两组(45.8%比32.6%比32.0%),但差异未达统计学意义(P>0.05)。多因素分析结果也显示,对不同术前LVEF分组的ICM患者,PCI成功开通1年总体MACE以及心绞痛、再发血运重建等未见有显著影响(P>0.05)。我们的研究未得出不同术前LVEF分组患者PCI开通后整体MACE有差别的结论,可能与以下因素有关:首先,这体现了ICM患者病情的复杂性,单一开通冠状动脉狭窄病变对患者可能尚不足以改善远期预后,其他因素如对冠状动脉痉挛、炎症、血管功能异常也是影响预后的重要因素[15];其次,ICM发生恶性心律失常等合并症与患者预后直接相关[16];第三,本研究未对心肌行缺血范围和存活心肌的评价,而存活心肌的存在与否与患者PCI后的不同预后有关[17]。
心肌缺血导致心肌收缩功能降低及LVEF下降,左室重塑,并继发功能性二尖瓣反流,后者又加重左室重塑和心肌收缩功能、LVEF下降,形成一个恶性循环。Bazylev等[18]的研究也表明,术前LVEF是ICM患者预后的独立预测因素。在严重左心室收缩功能不全的ICM患者中,PCI可以改善术后LVEF[4,19],但效果不如LVEF>35%的患者,可能这部分患者行CABG效果更好[12]。尤其在多支血管病变的患者,CABG可以在短时间尽早恢复血供,有效逆转心肌缺血缺氧,改善LVEF[20,21]。我们的研究结果也显示,LVEF≤35%组更容易发生再发急性左心衰(P<0.05);Logistic回归分析显示,校正多项危险因素后,术前LVEF≤35%仍是ICM患者PCI术后发生急性左心衰的独立预测危险因素(OR=2.696,95%CI:1.099~6.612,P=0.030)。随着入院时LVEF水平越低,患者入院时LA越大(P<0.05),LVED大小无明显差别(P>0.05)。而术后1年复查相关指标提示,入院时LVEF≤35%的患者LVED、LVEF大小明显高于LVEF≥50%组和LVEF 36%~49%组(P<0.05),而术后LA大小无明显差别(P>0.05)。提示即使进行充分的血运重建,对于LVEF水平≤35%的患者,心肌重塑的逆转以及心功能的恢复远远不如LVEF>35%的患者。因此,我们认为对于低危SYNTAX评分且LVEF≤35%的患者,CABG在改善左室重塑以及预防急性左心衰发生方面仍然是更好的选择,但是对于LVEF>35%的ICM患者,PCI可以有效改善心脏收缩功能,减轻左室重塑。
综上所述,本研究通过对低危SYNTAX评分的ICM患者的PCI术前后相关指标进行分析发现,PCI可明显改善患者左室重塑、提高心脏收缩功能,降低MACE发生率;而且,术前LVEF越高的患者可从PCI治疗中取得更好的临床获益,但是对于LVEF≤35%的患者,PCI在改善左室重塑以及预防急性左心衰的效果欠佳。然而,本研究纳入样本量较少、未对患者根据术前LVEF进行前瞻性配对研究、在进行冠状动脉血管重建时还存在其他可能影响左心功能的一些病理情况如严重的房室传导阻滞未能校正、随访时间较短、单中心研究等是本研究的不足之处。因此,本研究尚需纳入更多样本、进行前瞻性研究、长期进一步的随访及多中心支持等多方面手段对ICM患者进行更细致有力的分析,从而为该类患者的个体化治疗方案的选择提供更多的建议。
所有作者均声明不存在利益冲突



























