
新型冠状病毒肺炎大流行以来,虽然各国或地区采取了非药物性干预措施,但是从全球的角度评估,新型冠状病毒肺炎疫情未得到遏制,即使有些疫情已初步控制的国家,也出现了疫情的局部反弹。人们把控制疫情的希望寄托于新型冠状病毒肺炎疫苗的研发与应用。本研究从灭活疫苗、减毒活疫苗、病毒载体疫苗(复制型和非复制型)、病毒样颗粒疫苗、亚单位疫苗、DNA疫苗和RNA疫苗7种不同的疫苗研发路线出发,从疫苗研发机制、同类疫苗情况、生产速度、技术成熟度等优点和局限性等方面进行介绍,对不同技术研发的疫苗特性进行系统地梳理、汇总,以期为疫苗的研发和使用提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019新型冠状病毒(简称新冠病毒)在全球范围大流行,根据约翰霍普金斯大学统计数据,截至北京时间2020年8月23日,全球累计报告超过2 321万病例,死亡超过80万[1]。全球医学和生物领域的专家都在致力于寻找、研发治疗和预防新型冠状病毒肺炎(简称新冠肺炎)的方案,但是目前羟氯喹和瑞德西韦的临床研究结果并不乐观。有文献提示,新冠肺炎患者发病2个月后,87%的出院康复者仍有症状,44%的患者感觉到生活质量恶化[2]。新冠病毒的治疗目前仍以对症治疗为主,尚无有效的抗病毒治疗药物。所以大家把防控新冠病毒的方法更多地聚焦在疫苗的研发上。根据世界卫生组织(WHO)统计,目前全球正在从8种不同种类的技术平台开展新冠肺炎疫苗的研发,分别为灭活疫苗、非复制型载体疫苗、复制型载体疫苗、减毒活疫苗、DNA疫苗、RNA疫苗、蛋白亚单位疫苗和病毒样颗粒(VLP)疫苗,本研究将复制型载体疫苗和非复制型载体疫苗合并为病毒载体疫苗,从7种不同的疫苗研发技术平台进行介绍。新冠肺炎疫苗研发技术路线几乎涵盖了现有疫苗研发的绝大多数技术类型。总体可分为三类,第一类是经典的技术路线,包括灭活疫苗和通过不断传代的减毒活疫苗;第二类是基因重组技术体外表达抗原的蛋白亚单位疫苗和VLP疫苗;第三类是基因重组或用遗传物质直接体内表达抗原的病毒载体疫苗(复制型、非复制型)、核酸类(DNA和mRNA)疫苗。截至2020年8月20日,全球共有累计168种在研究阶段,其中30种疫苗进入临床试验,138种候选疫苗处于临床前阶段(表1)[3]。本文从不同技术路线研发疫苗的机制、同类疫苗情况、生产速度、技术成熟度、优点和局限性等方面进行介绍,对不同技术研发的疫苗特性进行系统地梳理、汇总和比较,以期为疫苗的研发和使用提供参考。
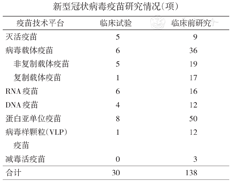
截至2020年8月20日世界卫生组织统计的全球新型冠状病毒疫苗研究情况(项)
截至2020年8月20日世界卫生组织统计的全球新型冠状病毒疫苗研究情况(项)
| 疫苗技术平台 | 临床试验 | 临床前研究 | |
|---|---|---|---|
| 灭活疫苗 | 5 | 9 | |
| 病毒载体疫苗 | 6 | 36 | |
| 非复制载体疫苗 | 5 | 19 | |
| 复制载体疫苗 | 1 | 17 | |
| RNA疫苗 | 6 | 16 | |
| DNA疫苗 | 4 | 12 | |
| 蛋白亚单位疫苗 | 8 | 50 | |
| 病毒样颗粒(VLP)疫苗 | 1 | 12 | |
| 减毒活疫苗 | 0 | 3 | |
| 合计 | 30 | 138 | |
灭活病毒疫苗的研发工艺主要是通过在细胞基质上对病毒进行培养,然后用物理或化学方法将具有感染性的病毒杀死但同时保持其抗原颗粒的完整性,使其失去致病力而保留抗原性[4]。灭活疫苗既可由整个病毒或细菌组成,也可由其裂解片断组成[5]。目前市面上可用的灭活疫苗主要有脊髓灰质炎灭活疫苗、流感灭活疫苗、乙型脑炎灭活疫苗、甲型肝炎灭活疫苗、狂犬病疫苗、EV71型手足口病疫苗、霍乱疫苗、钩端螺旋体疫苗、流行性出血热疫苗、森林脑炎病毒疫苗[6]。病毒灭活疫苗研发的关键环节主要包括病毒毒株的获得、病毒的扩增、灭活等工艺确定、安全性和有效性评价等[7]。病毒株的培养目前比较常用的传代细胞有人二倍体细胞(2BS、KMBl7、MEC-5)、非洲猴肾细胞(Vero)、Hela细胞等,使用细胞工厂或生物反应器培养[8]。病毒灭活对疫苗质量和安全性至关重要,甲醛和β-丙内酯作为灭活剂在人用疫苗生产中应用最广泛[9,10,11,12,13,14],烷化剂(包括二乙烯亚胺、乙酰乙烯亚胺等)和过氧化氢也可用于病毒灭活制备疫苗[15,16,17,18],确保病毒灭活彻底且同时保证其免疫原性。
中国团队曾研发针对严重急性呼吸道综合征冠状病毒(SARS-CoV)的灭活疫苗,并完成了Ⅰ期临床试验,研究结果显示,该灭活疫苗在人体试验中安全性表现良好,且中和抗体产生率达到100%[19]。目前全球进入临床试验的灭活新冠肺炎疫苗共有5种,其中有3种灭活疫苗进入了Ⅲ期临床试验,分别是由北京科兴生物制品有限公司、国药集团中国生物武汉生物制品研究所和北京生物制品研究所研发;另外,分别由中国医学科学院和印度Bharat Biotech公司研发的灭活疫苗也进入了Ⅰ期临床试验。武汉生物制品研究所的疫苗中期分析结果显示,不良事件主要为接种部位疼痛,其次为发热,均为轻度和自限性不良事件,安全性表现良好。在免疫原性方面,在低剂量和高剂量两组中,疫苗接种者出现100%的阳转率,而安慰剂组阳转率为0,提示该疫苗较好的免疫原性结果[20]。根据中国国务院国有资产管理委员会官方新闻披露,北京生物制品研究所的灭活疫苗在0、21 d程序和0、28 d程序组中中和抗体阳转率均为100%[21],免疫原性表现良好。
灭活疫苗研发技术是比较传统和成熟的疫苗研发技术。具有生产工艺简单、制备和产业化技术平台成熟、稳定性好、使用安全等优势[22]。此外,灭活疫苗质控点和评价方法也比较明确,而且通常都有较好的安全性和免疫原性[23]。灭活疫苗有比较成熟的生产工艺,所以研发可以利用预先已有的技术和基础设施,相较于新型疫苗技术,能够更快速地启动研发流程。
尽管灭活疫苗的研发工艺相对比较成熟,但细胞和病毒的培养、毒株和多级种子库的建立限制了该研发技术在生产阶段的产能扩大[24];另外,由于是灭活疫苗,其免疫原性相对较弱,往往需要多次接种才能产生有足够保护力的抗体,在作为应急疫苗使用时有所不足[4]。灭活疫苗制作过程中需要保持免疫原性颗粒的完整性以保持疫苗的免疫效果,对灭活的工艺要求较高,且生产过程中要求的生物安全等级较高[24]。除了上述的局限性外,灭活工艺可能存在潜在的抗体依赖增强(ADE)效应。该效应主要表现为机体接种疫苗后,再次感染病毒时,表现出对该病原的易感性增加或者疾病发病加重的现象[25]。之前关于SARS-CoV灭活疫苗研发的动物实验结果提示,疫苗接种后,小鼠出现肺部损伤和肺部嗜酸性粒细胞浸润更严重现象[26,27],提示免疫后再次感染时有可能产生增强型疾病[28]。另有一项针对中东呼吸道综合征病毒(MERS-CoV)的动物实验显示,与安慰剂组相比,灭活疫苗组在小鼠中出现嗜酸性粒细胞及相关细胞因子白细胞介素(IL)-5、IL-13明显增加,提示该疫苗存在引起肺部病理改变的风险[29]。针对两种病毒的灭活疫苗动物实验均提示ADE的风险,而SARS-CoⅤ、MERS-CoV和新冠病毒同属冠状病毒属,所以灭活疫苗的研发需要警惕ADE现象的发生。
病毒载体疫苗是指将特定病毒作为遗传信息的载体,用基因工程技术将外源性抗原基因植入到病毒基因组内并转染细胞获得重组病毒,获得的重组病毒能在机体内利用宿主的遗传物质进行表达目的抗原蛋白,并诱导机体产生相应抗体,从而达到免疫接种的目的[30]。根据病毒载体能否产生活的子代病毒分为复制型和复制缺陷型(即非复制型)病毒载体。复制型病毒载体进入机体细胞后,可以产生大量子代病毒,外源基因的数量会随着载体基因组的复制而增加,从而诱导机体产生强烈、持久的免疫反应。但同时病毒载体自身的蛋白也会大量表达,可能会对机体产生毒性作用,因此复制型病毒载体的安全性有待优化。非复制型病毒载体疫苗只能一次性感染细胞,不会产生子代病毒,安全性好,但外源基因表达相对较低,免疫效果可能比复制型病毒载体差[31]。在新冠肺炎疫情出现前,已有多种病毒载体如痘病毒、腺病毒、疱疹病毒、水泡型口炎病毒和黄病毒17D株等被用于非新冠肺炎疫苗的病毒载体的开发研究[32]。其中以腺病毒、痘病毒和水泡型口炎病毒研究最多[33],本文主要介绍腺病毒作为载体的疫苗研发信息。
腺病毒是一种无包膜的双链DNA病毒,可引起呼吸道、眼部、胃肠道、尿路等感染,在全球许多地区成人中具有较高的腺病毒抗体阳性率水平[33]。腺病毒载体技术研发主要以非复制型腺病毒研究为主。目前中国军事科学院医学研究院和天津康希诺生物股份公司基于腺病毒载体疫苗合作开发的重组埃博拉病毒疫苗于2017年在中国获批[34]。美国杨森制药公司研发的腺病毒载体埃博拉疫苗也已经完成Ⅲ期临床试验[35]。美国国家过敏症与传染病研究所和英国葛兰素史克公司合作开发的基于黑猩猩腺病毒3型载体埃博拉疫苗(ChAd3-EBO-Z)在扩大Ⅱ期临床试验中也显示出良好的免疫原性和安全性[36]。另外,美国Altimmune公司腺病毒载体鼻腔接种流感疫苗和美国Vaxart公司研发的腺病毒载体的口服流感疫苗(VXA-A1.1)都在临床试验中表现出良好的免疫原性和安全性[37,38]。
腺病毒作为基因递送载体而研发的疫苗有其独特的优势,首先腺病毒的宿主范围广,而且多数型别的腺病毒对人致病性低,且不存在整合到宿主体中的风险,无插入致突变的风险[39]。另外,腺病毒可以同时感染增殖细胞和非增殖细胞[40],而且腺病毒重组载体的构建技术相对成熟,已经可以实现在悬浮细胞中的大规模培养,生产成本相对低廉,且产能方面相较传统的疫苗研发技术有所提升[41,42];在不同的剂型配方下,腺病毒载体疫苗的储存条件方便灵活,可在4 ℃液体缓冲液中保存,或以冻干粉形式存在1年以上[43];此外,腺病毒自身既可以作为抗原,也可以作为重组基因的载体,而且有研究表明腺病毒同时具有免疫佐剂的功能,可以激发机体天然免疫反应[44],因此使疫苗的研发更加简便且有利于降低生产成本;腺病毒载体疫苗接种相对简单灵活,可以有多种接种途径,病毒载体疫苗可通过肠道或呼吸道进行黏膜免疫,如口服、鼻腔接种等[45,46,47,48]。它可以侵染不同类型的细胞和组织,可以浸染分化和未分化细胞,甚至包括抗原提呈细胞[49]。腺病毒作为载体在相关基因治疗临床试验中安全性良好并有一定疗效[50]。此外,以病毒为载体的疫苗生产工艺的平台通用性较高,可以基于同一个平台进行针对多种不同病原体的疫苗研发。
尽管拥有以上多种优势,腺病毒疫苗研发过程中有其特有的困难和挑战。其中疫苗构建过程中遇到的最大的问题就是人体本身对腺病毒预存的免疫存在。人体对腺病毒的免疫力,可能会影响到疫苗诱导的免疫反应强度从而影响保护效果[51]。新冠病毒感染重症患者多为老年人或有基础性疾病的人,这部分人免疫力比健康人弱,目前无法确定疫苗对这部分人是否能产生保护作用[52,53]。
目前以病毒载体技术平台研发的新冠肺炎疫苗共有6种进入临床试验,以腺病毒为载体的进入临床试验的新冠肺炎疫苗有5种,均为非复制型腺病毒载体疫苗。,牛津大学和阿斯利康公司合作研发的疫苗已经进入Ⅲ期临床试验;由中国军事科学院医学研究院和康希诺生物制品公司合作研发的疫苗已经完成Ⅱ期临床试验,目前尚未开展Ⅲ期临床试验;杨森公司研发的疫苗已经启动Ⅰ/Ⅱ期临床试验;由俄罗斯Gamaleya研究所研发的疫苗已经启动Ⅰ期临床试验;由意大利ReiThera、德国LEUKOCARE、比利时Univercells三家公司合作研发的疫苗也已经启动Ⅰ期临床试验。另外,由法国巴斯德研究所牵头研发的复制型麻疹病毒载体疫苗也已经启动了Ⅰ期临床试验。根据目前牛津大学发表的Ⅰ/Ⅱ期研究结果显示,腺病毒载体疫苗安全性表现良好。从免疫原性的结果来看,该疫苗可以同时诱导体液免疫和细胞免疫反应[54]。康希诺公司研发的疫苗Ⅰ期和Ⅱ期临床试验结果显示,在两个剂量组接种1剂次疫苗28 d后,血清抗体阳转率分别为96%和97%,两组的不良事件发生率分别为72%和74%[55,56]。
蛋白亚单位疫苗的研发过程为:基于已发布的病毒基因序列,将病毒目的抗原基因通过重组的方式构建在表达载体上,再转化到细菌、酵母、哺乳动物或昆虫细胞中,诱导表达出抗原蛋白,最后纯化后制成疫苗[53]。该疫苗研发技术相对成熟,目前已经上市的疫苗包括乙型肝炎疫苗、流感亚单位疫苗等。
相比于传统的灭活和减毒路线,蛋白亚单位疫苗技术路线最大的优势主要表现在:(1)生产工艺的安全性高,疫苗的生产和研发过程中不需要高等级的生物安全实验室[57]。(2)疫苗产能相较于传统的疫苗研发平台更高,该技术适合于规模化生产。疫苗生产的工艺路线确定后,易于大规模生产[24]。(3)疫苗安全性好,由于疫苗只有病原体的某种特定的抗原蛋白,不是整个病原体,所以不存在感染风险,而且疫苗的耐受性相对较好[58]。(4)疫苗稳定性相对较好。蛋白亚单位疫苗存在的挑战主要有:由于疫苗是利用不同表达系统来表达病原体的部分蛋白作为抗原,最终表达的抗原蛋白可能跟病毒蛋白的天然构象存在差异[59],这有可能在一定程度上影响疫苗的免疫原性。此外,由于只是病原体的一部分蛋白作为抗原,免疫原性弱,一般需要佐剂增强,而且产生免疫记忆效应可能较弱[60]。
目前进入临床试验的新冠病毒蛋白亚单位疫苗有7种,其中由中国科学院微生物研究所和安徽智飞龙科马生物制药公司联合研发的添加佐剂的重组蛋白疫苗已经进入Ⅱ期临床试验;其余6种疫苗已经启动Ⅰ期临床试验,分别由美国Novavax公司,美国Kentucky Bioprocessing公司,中国三叶草、英国GlaxoSmithKline、美国Dynavax三家公司联合,澳大利亚Vaxine Pty Ltd、韩国Medytox两家公司联合,澳大利亚Queensland大学、韩国Seqirus公司联合,中国基亚生物科技公司、美国国家过敏和传染病研究所、美国Dynavax公司联合研发。目前尚无相关临床试验结果发表。
DNA疫苗是在第一代减毒活疫苗、灭活疫苗和第二代亚单位疫苗基础上发展起来的第三代疫苗,属于核酸疫苗的一种[61]。DNA疫苗发挥作用机制是通过将编码外源性抗原蛋白的基因重组到真核表达元件的质粒中,然后将质粒导入到宿主体内,利用宿主细胞中的遗传物质表达抗原蛋白,通过抗原蛋白诱导机体产生相应的免疫应答,从而达到预防和治疗疾病的目的[62]。DNA疫苗已经被用于针对各种人类病原体,如HIV、流感病毒、疟疾、乙型肝炎病毒、呼吸道合胞病毒和单纯疱疹病毒等多种疫苗的开发,并已进入到临床试验阶段[63]。目前尚无人用DNA疫苗被批准上市,但是DNA疫苗在动物疫苗领域已经有多年的使用历史,有多种动物用DNA疫苗获批。
DNA疫苗相较于传统的疫苗研发技术,有非常明显的优势。首先,DNA疫苗无感染风险;此外,DNA疫苗与减毒活疫苗和载体活疫苗一样引起溶细胞性T淋巴细胞应答[64],但却不存在感染的危险,也不存在散毒、病毒污染及个体传染源的敏感性相关的毒力改变,对于常规疫苗难以培养或危险的致病体,DNA疫苗的构建也相对简单[65],且可能产生持久的免疫应答。DNA疫苗能在体内长期存在并持续表达低水平的抗原蛋白,无须后续免疫注射而能够诱导持续的免疫效应,因此很微量的抗原即可刺激机体产生强而持久的免疫应答[66]。有研究数据表明,DNA疫苗给小鼠肌肉注射后,可以在2年内持续检测到疫苗DNA[67],提示DNA疫苗可能诱导持续性的免疫效应。另外,DNA疫苗有生产方式相对简单、生产效率高、生产成本较低的特点。DNA疫苗的生产过程是通过构建表达效率较高的质粒,将重组的质粒在细菌体内大量克隆而实现疫苗的批量生产。相较于其他种类的疫苗研发,DNA疫苗省去了抗原提取、纯化等耗时较长的过程,缩短了生产周期。由于DNA疫苗可以持续表达,疫苗抗原使用量一般较小[68]。除此之外,DNA疫苗相比于传统的疫苗,由于干燥的DNA小粒在室温下相对稳定,不需要冷藏设备,所以更易于疫苗的储存和运输(表2)。
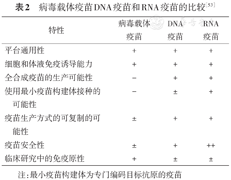
病毒载体疫苗DNA疫苗和RNA疫苗的比较[53]
病毒载体疫苗DNA疫苗和RNA疫苗的比较[53]
| 特性 | 病毒载体疫苗 | DNA疫苗 | RNA疫苗 |
|---|---|---|---|
| 平台通用性 | + | + | + |
| 细胞和体液免疫诱导能力 | + | + | + |
| 全合成疫苗的生产可能性 | - | + | + |
| 使用最小疫苗构建体接种的可能性 | - | ± | + |
| 疫苗生产方式的可复制的可能性 | ± | + | + |
| 疫苗安全性 | ± | + | ++ |
| 临床研究中的免疫原性 | + | ± | ± |
注:最小疫苗构建体为专门编码目标抗原的疫苗
除了上述的优势,DNA疫苗仍然有其需要解决的困难和挑战。(1)DNA疫苗目的基因、载体和启动子的选择要慎重。疫苗目的基因构建和筛选是决定该疫苗免疫效果的重要环节[69]。(2)潜在的安全性风险,DNA疫苗存在有部分或全部质粒序列整合到宿主基因组的风险,从而有可能导致抑癌基因失活或致癌基因激活,或导致染色体不稳定(断裂和突变),所以质粒DNA的持久性和稳定性需要在临床前进行有效的评估[70]。此外,DNA疫苗可能刺激机体产生与自身免疫性疾病(例如系统性红斑狼疮)相关的抗DNA抗体。临床前数据表明,DNA疫苗可以增加抗DNA自身抗体的产生。正常小鼠中,细菌质粒DNA诱导产生抗双链DNA自身抗体,而在狼疮小鼠中,DNA疫苗加速了自身免疫的发展[71]。(3)DNA疫苗的递送系统屏障可能影响疫苗效果,需要选择合适的接种途径。质粒DNA疫苗进入细胞核需要跨越几道屏障。疫苗质粒必须通过内吞作用或胞饮作用穿过磷脂细胞膜,避免内体、溶酶体和胞质核酸酶的降解,并跨核转运[72]。所以,如果缺乏有效的递送系统,则难以将DNA质粒递送到宿主细胞中。目前比较常用的疫苗的形态包括裸DNA疫苗直接注射及脂质包裹DNA后的注射,注射方式常用肌肉注射[73]。肌肉注射后疫苗的免疫效果相比于鼻腔内、腹腔内、静脉内和皮肉内接种表现更好。一项针对不同接种方式对DNA疫苗免疫效果的研究显示,基因枪接种比直接注射DNA疫苗效果好600~6 000倍[66]。
目前共有4种基于DNA技术平台研发的新冠病毒疫苗进入临床试验阶段,4种DNA疫苗均处于Ⅰ/Ⅱ期阶段的研究,分别由美国Inovio公司与国际疫苗机构联合,日本大阪大学、日本AnGes公司、日本Takara Bio公司三家联合,印度Cadila Healthcare Limited公司,韩国Genexine Consortium公司进行研发。目前Inovio公司已经公布了动物实验研究结果,动物在接种疫苗数月后进行攻毒试验时,可以快速产生针对新冠病毒刺突蛋白的T细胞和B细胞反应[74]。
mRNA疫苗是核酸疫苗的一种,它的机制是通过将编码抗原蛋白的mRNA接种到宿主,然后在体内细胞中利用宿主的遗传物质进行表达合成抗原蛋白,通过抗原蛋白诱导和激活机体的免疫系统产生免疫反应,从而达到预防和治疗疾病的目的[75]。根据mRNA疫苗能否自我扩增复制,可以将mRNA疫苗分为能自我扩增mRNA疫苗和非复制型mRNA疫苗[76]。自我扩增mRNA通过在宿主细胞内进行RNA的自我扩增,从而诱导高水平抗原表达[77]。近年来开发了各种mRNA疫苗技术平台,其免疫原性已在临床研究中得到验证[78]。目前,所有mRNA疫苗产品仍处于临床前研究或临床研究阶段,尚无上市使用的mRNA疫苗[79]。但是全球主要的几家mRNA疫苗研发公司,除新冠病毒疫苗外已有多个其他产品已经进入临床研究阶段,详见表3。

全球三家公司mRNA疫苗及药物研发进展
全球三家公司mRNA疫苗及药物研发进展
| 公司名 | 药物编号 | 适应症 | 临床进展 |
|---|---|---|---|
| 德国BioNTech | BNT1222 | Melanoma(黑色素瘤) | Ⅱ期 |
| BNT112 | Prostatecancer(前列腺癌) | Ⅰ期 | |
| BNT113 | HPV16+headandneckcancer1(HPV和头颈癌) | Ⅰ期 | |
| 德国CureVax | CV8102 | Melanoma、AdenoidcysticCarcinoma(黑色素瘤等肿瘤微环 | Ⅰ期 |
| CV9202 | NSCLC(非小细胞肺癌) | Ⅰ期 | |
| CV7202 | rabiesvirus(狂犬病病毒) | Ⅰ期 | |
| CV7301 | Influenza(流感) | 临床前 | |
| 美国Moderna | mRNA-4157 | Solidtumors(实体瘤) | Ⅰ期 |
| mRNA-4157 | Melanoma(黑色素瘤) | Ⅱ期 | |
| mRNA-1647 | Cytomegalovirus(CMV,巨噬细胞病毒) | Ⅰ期 | |
| mRNA-1893 | Zika(寨卡病毒) | Ⅰ期 |
mRNA疫苗研发过程主要包括,目标抗原的选定、基因序列获取、目的基因质粒构建、RNA体外转录和mRNA疫苗的修饰和优化几个关键步骤。由于不同的蛋白质是由不同的RNA序列编码,因此找到最佳蛋白质抗原是确定mRNA疫苗研发方向的关键[80]。mRNA的序列一般是通过体外转录的方式获取,但是由于mRNA本身非常容易被降解,为了保证其稳定性,在体外获取mRNA后通常需要对mRNA进行核苷酸的修饰和密码子的优化,这对于提高mRNA疫苗的翻译效率和保证其稳定性都非常重要[81]。
作为第三代疫苗,mRNA相比于传统的疫苗有其独特的优势(表2)。首先,mRNA疫苗的获取是通过酶促体外转录的过程进行生产获得,该过程不依赖于细胞的扩增,所以可以轻松实现所有的生产过程的监测和质控[82],而且该过程节省了细胞培养、抗原提取和纯化等过程,大大缩短了生产时间,能够很容易实现量产,提高了疫苗的产能[75]。根据目前研发单位的报道,mRNA的产能可以轻松地实现上亿甚至上十亿剂次的年产能,这对于快速应对全球范围的新发传染病至关重要。mRNA的研发和生产周期短,前期合成比较快,一旦临床数据验证其有效性和安全后,能够在短期内向下游推进疫苗的生产[83]。而且有临床数据显示,mRNA疫苗可能可同时诱导机体产生体液免疫和细胞免疫[84],通过多种机制来保护机体。mRNA由于其自身的特性,免疫后在转染细胞的细胞质中能够很快地降解,降低其安全性的风险,而且不存在DNA疫苗整合到宿主染色质中的风险[85]。
mRNA疫苗研发过程中也存在需要克服的挑战(表2)。首先是RNA的稳定性问题,RNA自身的不稳定性会严重影响疫苗的效果[86]。增强RNA的稳定性是一个系统工程,既可以从提高mRNA自身的稳定性如优化合成体系、密码子优化和修饰核苷入手,也可以同时通过提高递送系统的效率来达到目的[87]。裸露的mRNA直接进入体内会被降解,目前比较常见的是利用载体辅助mRNA的递送,常用载体包括树突细胞、鱼精蛋白、脂质体和高分子载体等[88]。脂质纳米粒载体是目前mRNA疫苗最常用的载体之一[89]。另外mRNA作为新一代的疫苗的潜在安全性的风险也是需要充分评估的。RNA疫苗的毒性风险主要来源于人工合成原料中的核酸类似物所产生的毒性,以及mRNA采用的包裹材料所产生的毒性[90]。另外,mRNA疫苗存在引起周围宿主细胞的凋亡的风险,大量的细胞凋亡会引起一定强度的炎症反应[91]。人工在体外转录生产出的mRNA,常常无法在一级序列和二级结构方面与人体DNA自然转录的mRNA保持一致,从而在翻译蛋白质和激活免疫反应的过程中存在差异。RNA化学合成和大规模生产的难度较大[92]。在质量控制方面,如何检测残留的模板DNA和合成不完全的mRNA,同样是当前研究开发mRNA疫苗所需面临的一大质量控制难题[85]。
基于mRNA技术研发的,目前有6个候选新冠病毒疫苗产品进入临床试验阶段。其中进展最快的是由美国Moderna公司、美国国家过敏和传染病研究所联合研发的mRNA-1273候选疫苗已经启动Ⅲ期临床试验,美国辉瑞公司、德国BioNTech公司、中国复星医药公司联合研发的BNT-162候选疫苗也已经启动Ⅲ期临床试验。由新加坡Arcturus公司、新加坡杜克国立大学联合研发的mRNA疫苗已经启动Ⅰ/Ⅱ期临床试验。另外三个分别由英国伦敦帝国学院,德国Curevac公司,中国军事科学院医学研究院与沃森生物技术公司联合研发的mRNA疫苗,均处于Ⅰ期临床研究阶段。mRNA-1273候选疫苗在超过1/2的受试者中出现了不良事件,但均为轻度或中度,有3个受试者出现严重不良事件;免疫原性方面,在接种2剂次后,所有受试者均检测到中和抗体,中和抗体强度跟恢复期患者中和抗体强度相似[93]。美国辉瑞公司、德国BioNTech公司联合研发的BNT-162疫苗公布的Ⅰ/Ⅱ期结果显示,在接种2剂次BNT-162b1候选疫苗后,中和抗体滴度相较于恢复期新冠患者血清滴度升高1.9~4.6倍,出现的不良事件多为轻度和中度,提示该疫苗安全性和免疫原性表现良好[94]。
VLP是由病毒的一种或几种衣壳蛋白在异源系统内自我组装成的与天然病毒粒子结构相同或相似,但不含病毒遗传物质的高度结构化的空心颗粒,直径在约为20~200 nm。有研究提示,病毒样颗粒的形成可能与病毒部分结构蛋白过度表达有关[95]。根据VLP的来源可以分为天然VLP和重组VLP。天然VLP主要是病毒的突变、修饰体自组装合成。在1978年,科学家第一次发现多瘤病毒的主要荚膜蛋白在无病毒核酸的情况下,可以自行组装成VLP[96]。重组VLP则完全由人工设计[97],可以在制备时对合成VLP表位的组分进行多种修饰,以满足不同的制备需求,所以人工合成VLP作为载体平台已逐渐成为VLP疫苗的研究热点。VLP按结构不同可以分为有包膜和无包膜两类。无包膜VLP有病原体的一种或多种组分自组装或在VLP表面上融合一种或多种靶抗原后组装而成,通常不包含宿主成分[98]。VLP与免疫系统的作用主要与VLP的大小和表面几何形状这两个因素有关[99]。由于其具有病毒的结构,所以VLP进入机体后,既可以与人体固有免疫应答系统相互作用,也可以有效地引起特异性体液免疫应答和特异性细胞免疫应答。作为外源性抗原,VLP可以有效地被MCH Ⅰ和Ⅱ提呈[100]。VLP疫苗研发技术目前得到了广泛的研究和应用,目前已上市或在研的VLP疫苗包括人乳头瘤病毒疫苗、乙型肝炎疫苗、戊型肝炎疫苗、诺如病毒疫苗等[101]。详见表4
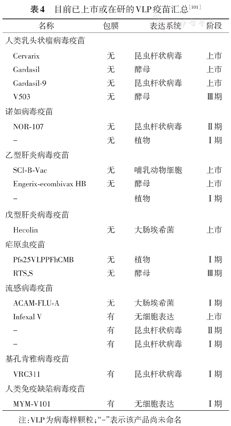
目前已上市或在研的VLP疫苗汇总[101]
目前已上市或在研的VLP疫苗汇总[101]
| 名称 | 包膜 | 表达系统 | 阶段 | |
|---|---|---|---|---|
| 人类乳头状瘤病毒疫苗 | ||||
| Cervarix | 无 | 昆虫杆状病毒 | 上市 | |
| Gardasil | 无 | 酵母 | 上市 | |
| Gardasil-9 | 无 | 昆虫杆状病毒 | 上市 | |
| V503 | 无 | 酵母 | Ⅲ期 | |
| 诺如病毒疫苗 | ||||
| NOR-107 | 无 | 昆虫杆状病毒 | Ⅱ期 | |
| - | 无 | 植物 | Ⅰ期 | |
| 乙型肝炎病毒疫苗 | ||||
| SCI-B-Vac | 无 | 哺乳动物细胞 | 上市 | |
| Engerix-ecombivax HB | 无 | 酵母 | 上市 | |
| - | 植物 | Ⅰ期 | ||
| 戊型肝炎病毒疫苗 | ||||
| Hecolin | 无 | 大肠埃希菌 | 上市 | |
| 疟原虫疫苗 | ||||
| Pfs25VLPPFhCMB | 无 | 植物 | Ⅰ期 | |
| RTS,S | 无 | 酵母 | Ⅲ期 | |
| 流感病毒疫苗 | ||||
| ACAM-FLU-A | 无 | 大肠埃希菌 | Ⅰ期 | |
| Infexal V | 有 | 无细胞表达 | 上市 | |
| - | 有 | 昆虫杆状病毒 | Ⅱ期 | |
| - | 有 | 昆虫杆状病毒 | Ⅰ期 | |
| 基孔肯雅病毒疫苗 | ||||
| VRC311 | 有 | 昆虫杆状病毒 | Ⅰ期 | |
| 人类免疫缺陷病毒疫苗 | ||||
| MYM-V101 | 有 | 无细胞表达 | Ⅰ期 | |
注:VLP为病毒样颗粒;"-"表示该产品尚未命名
VLP疫苗由于其结构中不含有病原体的遗传物质,所以其不具有感染和自主复制能力,但由于其具有和天然病毒颗粒类似的空间立体结构,表现出与天然病毒颗粒更相似的构象表位,可通过和病毒感染一样的途径提呈给免疫细胞,有效地诱导免疫系统产生免疫保护应答,是较为安全有效的抗原。另外其本身还具有佐剂功能[102,103]。VLP的制备主要包括病毒结构基因的克隆与表达、选取宿主表达系统、纯化、鉴定等环节。常用的表达系统包括:大肠杆菌、酵母、昆虫细胞等,可以通过该表达系统来表达病毒的结构蛋白。然后对表达的蛋白进行纯化,人工组装,从而形成VLP。由于该疫苗的生产环节复杂,所以疫苗的生产速度相对较慢。
目前基于VLP技术研发的新冠病毒疫苗只有加拿大Medicago公司产品进入了Ⅰ期临床试验。
减毒活疫苗是指病原体经过各种处理后,使其发生变异,通过传代培养的方式获得毒性减弱甚至无毒性作用的病原体变异株,但该变异体仍保留其免疫原性,将活的病毒变异株作为疫苗接种到机体,不会引起疾病的发生,但病原体可以在机体内诱导免疫反应,达到获得免疫保护的作用[104]。人类的疫苗史就是从减毒活疫苗开始的,英国Jenner医生在1796年第一次通过接种活的牛痘病毒来预防人类天花,从此揭开了疫苗研发的开端。随后又有法国Pasteur医生在1885年通过物理和化学方法制成了减毒狂犬疫苗,Calmette和Guerin在1921年制成了第一个减毒活细菌疫苗——卡介苗,用于预防结核病。随后又有多种减毒活疫苗被研发成功,目前已上市的减毒活疫苗包括麻疹、腮腺炎、风疹和水痘的单价减毒活疫苗及其四种联合减毒活疫苗、轮状病毒减毒重配活疫苗、脊髓灰质炎减毒活疫苗、流感减毒活疫苗、乙型脑炎减毒活疫苗、甲型肝炎减毒活疫苗、登革热减毒活疫苗、黄热病减毒活疫苗等,另外尚有多种减毒活疫苗正在研发过程中,如口服霍乱减毒活疫苗、呼吸道合胞病毒减毒活疫苗等[105]。
人类减毒活疫苗的研发历史较长,技术相对成熟。减毒活疫苗的优势主要表现在:(1)由于是活的病原体,所以减毒活疫苗有非常强的免疫原性,可以刺激机体产生特异性记忆B细胞和T细胞,同时激活体液免疫和细胞免疫,获得长期甚至终身的保护作用,具有免疫力强、作用时间长的优点[106],通过自然感染途径接种,还可以诱导出黏膜免疫,使机体获得较广泛的免疫保护[107];(2)由于诱导较强的免疫反应,减毒活疫苗一般不需要添加佐剂,其疫苗免疫剂次一般较少[108];(3)由于活的病原体有再增殖的特性,所以存在水平传播的可能性,能够扩大免疫效果,增强群体免疫屏障[107];(4)减毒活疫苗生产工艺一般不需要浓缩纯化,疫苗生产价格一般比较低廉[109]。除了上述的优势,减毒活疫苗也存在一定的挑战。首先是安全性的问题,由于是活的病原体被接种到人体,一般减毒活疫苗均保留一定残余毒力,对一些个体(如免疫缺陷者)可能诱发严重疾病,而且疫苗被接种到人体后,由于各种原因(如基因修饰等),减毒活疫苗有可能出现"毒力返祖"现象[108]。此外,因为是活的微生物制剂,人体排出的病原体,可能造成环境污染、引发交叉感染[110]。由于是活的病原体制成的疫苗,所以减毒活疫苗对于产品的保存、运输等环节的条件要求比较高[111]。而且,减毒活疫苗研发的关键步骤包括[112]:(1)传代筛选或人为突变致病位点获得减毒毒株;(2)毒株安全性以及免疫原性验证,这两个环节都非常耗时,所以减毒活疫苗的研发周期非常长[108]。另外,毒株的分离和培养、相关研究评价工作以及后面的生产都存在一定的生物安全风险,对实验室或者生产车间的生物安全级别要求高,一般要求为生物安全三级;除此之外,对于新冠肺炎的减毒活疫苗的研发,有其特有的挑战。人群对新冠病毒普遍易感,老年人及有基础疾病者感染后病情较重,儿童及婴幼儿也有发病,而且孕产妇是易感人群[113,114]。因此,要求针对新冠肺炎疫苗的研发应覆盖全年龄段;然而儿童的免疫系统功能往往弱于成年人,接种减毒活疫苗后预防效果差且易产生不良反应[115],所以新冠减毒活疫苗研发过程中需要充分考虑不同人群的适应性。
随着基因重组技术的发展,新形式的减毒活疫苗研发技术也在发展。中国香港大学目前正在研发的一种流感病毒和新冠病毒基因重组结合的减毒活疫苗,有望在近期进入临床试验[116],该疫苗的设计是基于NS1蛋白缺失的流感活病毒株进行研发,减小了流感病毒毒力的同时保持了较高的免疫原性,再通过基因工程的方式,将表达新冠病毒刺突蛋白(S蛋白)的受体结合区域(RBD)的基因整合到流感病毒基因组中,使其在流感病毒表面特异性的表达冠状病毒刺突蛋白的RBD区域蛋白,从而在注射人体内后诱导机体产生同时针对流感病毒和新冠病毒的免疫反应,达到同时预防流感病毒感染和新冠病毒感染的效果[117]。该疫苗是通过鼻喷的方式接种,有望产生比流感野毒株更好的免疫反应[118]。此外减毒疫苗的研发也在引入新的技术手段,如"冷适应"病毒株培养、反向遗传学技术和基因重组分类等技术[118]。
目前以减毒活疫苗技术研发的新冠肺炎疫苗均处于临床前研究阶段,全球尚无以减毒活疫苗技术研发的新冠疫苗进入临床试验。
不同种类的疫苗研发平台都有自己的优势和局限性(表5),在新冠肺炎形成全球大流行的形势下,接种疫苗是应对疫情和控制疫情最有效的方式。疫苗的研发需要从安全性和有效性的角度进行系统的临床试验评估,但是疫情的防控更需要充分考虑疫苗的可及性(包括短时间供应量)、可负担性和疫苗使用的公平性。没有任何一种疫苗能短时间内应对全球的大流行传染病。疫苗的研发一定需要从更大的视野布局,多技术并行研发,多途径加速研发,这才是研发疫苗的正确方式,战胜疫情的关键策略。
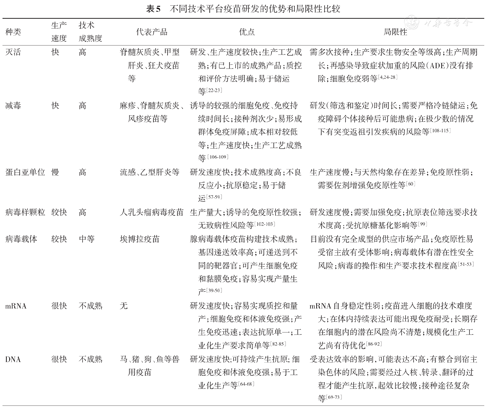
不同技术平台疫苗研发的优势和局限性比较
不同技术平台疫苗研发的优势和局限性比较
| 种类 | 生产速度 | 技术成熟度 | 代表产品 | 优点 | 局限性 |
|---|---|---|---|---|---|
| 灭活 | 快 | 高 | 脊髓灰质炎、甲型肝炎、狂犬疫苗等 | 研发、生产速度较快;生产工艺成熟;有已上市的成熟产品;质控和评价方法明确;易于储运等[22,23] | 需多次接种;生产要求生物安全等级高;生产周期长;再感染导致症状加重的风险(ADE)没有排除;细胞免疫弱等[4,24,25,26,27,28] |
| 减毒 | 快 | 高 | 麻疹、脊髓灰质炎、风疹疫苗等 | 诱导的较强的细胞免疫、免疫持续时间长;接种剂次少;易形成群体免疫屏障;成本相对较低等;生产速度快;生产工艺成熟等[106,107,108,109] | 研发(筛选和鉴定)时间长;需要严格冷链储运;免疫障碍个体接种后可能患病;在极少数的情况下有突变返祖引发疾病的风险等[108,109,110,111,112,113,114,115] |
| 蛋白亚单位 | 慢 | 高 | 流感、乙型肝炎等 | 研发速度快;技术成熟度高;不良反应小;抗原稳定;易于储运[57,58,59] | 生产速度慢;与天然构象存在差异;免疫原性弱;需要佐剂增强免疫原性等[60] |
| 病毒样颗粒 | 较快 | 高 | 人乳头瘤病毒疫苗 | 生产量大;诱导的免疫原性较强;无致病性风险等[102,103] | 研发速度慢;需要加强免疫;抗原表位筛选要求技术度高;受抗原糖基化影响等[99] |
| 病毒载体 | 较快 | 中等 | 埃博拉疫苗 | 腺病毒载体疫苗构建技术成熟;基因递送效率高;可递送到不同的靶器官;可产生细胞免疫和黏膜免疫;容易实现产量生产[39,40,41,42,43,44,45,46,47,48,49,50] | 目前没有完全成型的供应市场产品;免疫原性易受宿主故有受体影响;病毒载体有潜在性安全风险;病毒的操作和生产要求技术程度高[51,52,53] |
| mRNA | 很快 | 不成熟 | 无 | 研发速度快;容易实现质控和量产;细胞免疫和体液免疫强;产生免疫迅速;表达抗原单一;工业化生产要求简单等[82,83,84,85] | mRNA自身稳定性弱;疫苗进入细胞的技术难度大;在体内持续表达可能出现免疫耐受;长期存在细胞内的潜在风险尚不清楚;规模化生产工艺尚有待优化[86,87,88,89,90,91,92] |
| DNA | 很快 | 不成熟 | 马、猪、狗、鱼等兽用疫苗 | 研发速度快;可持续产生抗原;细胞免疫和体液免疫强;易于工业化生产等[64,65,66,67,68] | 受表达效率的影响,可能表达不高;有整合到宿主染色体的风险;需要经过入核、转录、翻译的过程才能产生抗原,起效比较慢;接种途径复杂等[69,70,71,72,73] |
所有作者均声明不存在利益冲突



























