
分析Caroli病/Caroli综合征患者的临床及病理特征。
纳入2015年1月至2018年12月首都医科大学附属北京友谊医院诊断Caroli病/Caroli综合征的患者21例。通过主要临床表现、对比分析不同临床类型间的差异,描述其肝脏病理特点。
所有纳入患者中,男8例、女13例,平均年龄13.5岁。首发症状发热6例(28.6%)、消化道出血6例(28.6%)、肝脾肿大9例(42.8%)、合并多囊肾12例(57.2%)。纳入患者分为两组,Caroli病组6例(28.6%),Caroli综合征组15例(71.4%)。Caroli病组总胆红素6.7(4.7,15.0)μmol/L、直接胆红素1.3(0.9,6.4)μmol/L,均显著低于Caroli综合征组[总胆红素16.0(10.9,33.0)μmol/L、直接胆红素3.5(2.7,16.2)μmol/L];Caroli病组血红蛋白117.0(106.0,126.2)g/L、血小板286.0(149.8,467.5)×109/L,均显著高于Caroli综合征组[血红蛋白85.0(74.0,103.0)g/L,血小板76.1(55.0,123.0)×109/L],组间差异均有统计学意义(均P<0.05)。患者行肝移植术10例(47.6%),其Child-Pugh-Turcotte肝病评分为8.0(8.0,10.2),显著高于未行肝移植组的Child-Pugh-Turcotte肝病评分[5.0(5.0,6.0),P<0.05]。
Caroli病/Caroli综合征早期症状不典型,易漏诊或误诊,通常病理为确诊依据,也可辅以实验室检查及影像学分析进行诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Caroli病/Caroli综合征是一种常染色体隐性遗传病,好发于儿童和青少年,主要表现为先天性肝内胆管囊柱状扩张。根据是否合并先天性肝纤维化,可将其分为Caroli病和Caroli综合征。其是一种罕见的遗传代谢性肝病,通常表现为肝脾肿大、胆管炎和(或)消化道出血等,部分患者合并多囊肾。从病理学角度将未合并先天性肝纤维化(CHF)者,称为Caroli病,合并CHF者称为Caroli综合征,分型不同,临床特点及预后不同。本文采用回顾性病例分析方法,总结归纳21例该病患者主要临床特点,对比Caroli病及Caroli综合征间的主要差异,并描述该病的病理及预后特点,以期加深对该病的理解,提高临床医生对本病的认识。
检索2015年1月至2018年12月于首都医科大学附属北京友谊医院住院患者中诊断Caroli病/Caroli综合征的患者共29例,排除诊断不符8例,纳入病例21例。纳入标准:(1)通过影像学表现:肝内多发囊状或柱状低密度影,与肝内胆管相通,呈"蝌蚪征"或"悬挂征"[1];(2)根据临床、影像及病理表现区分为Caroli病或Caroli综合征:Caroli病表现为单纯性肝内胆管囊性扩张,囊腔与胆管相通。Caroli综合征在Caroli病的基础上可见胆管板畸形,汇管区及汇管区周围纤维组织增生,未获得肝组织病理患者根据是否出现门静脉高压进行判断。排除标准:(1)住院时间短或曾在外院诊断,我院无影像学或肝脏病理活检,临床资料不全。(2)确诊为其他疾病,如多囊肝、继发性肝内胆管扩张或肝脏衰竭等。
收集患者的人口学、肝肾功能、血常规、凝血、尿常规及Child-Pugh-Turcotte肝病评分(Child评分)等资料。从首发临床表现、疾病分型、病理特点及预后四个方面进行总结。采用伊红染色(HE)、Masson三色染色、过碘酸雪夫氏法(DPAS)、网状纤维染色、铜染色、铁染色,免疫组化[胆管染色(CK7、CK19)]进行病理学分析。
应用SPSS 25.0统计软件,肝功生化[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GGT)、碱性磷酸酶(ALP)、白蛋白(ALB)、球蛋白(GLB)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)]及血常规[白细胞(WBC)、中性粒细胞百分比(NE%)、血红蛋白(Hb)、血小板(PLT)、凝血酶原时间(PT)、凝血酶原时间百分比(PT%)、国际标准化比率(INR)]均为偏态分布,以M(Q1,Q3)表示,采用独立样本非参数检验(Mann-Whitney U检验)进行两组间比较。双侧检验,检验水准α=0.05。
纳入的21例Caroli病/Caroli综合征患者中,男8例、女13例,发病年龄0.6~56.0岁,平均年龄13.5岁。主要临床表现:首发症状中发热占28.6%(6/21),消化道出血占28.6%(6/21),肝脾肿大占42.8%(9/21);合并多囊肾占57.2%(12/21);Caroli病(男3例、女3例)占28.6%(6/21),Caroli综合征(男5例、女10例)占71.4%(15/21)。
Caroli病组Hb、PLT指标均显著高于Caroli综合征组,两组间差异均有统计学意义(均P<0.05)。Caroli病组TBIL、DBIL、IBIL均显著低于Caroli综合征组,但Caroli病组ALP指标显著高于Caroli综合征组,两组间差异均有统计学意义(均P<0.05)。两组间PT、PT%和INR指标差异均无统计学意义(P>0.05)(表1)。
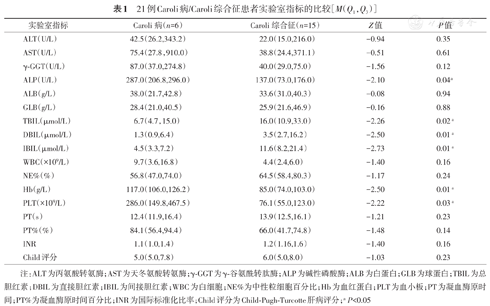
21例Caroli病/Caroli综合征患者实验室指标的比较[M(Q1,Q3)]
21例Caroli病/Caroli综合征患者实验室指标的比较[M(Q1,Q3)]
| 实验室指标 | Caroli病(n=6) | Caroli综合征(n=15) | Z值 | P值 |
|---|---|---|---|---|
| ALT(U/L) | 42.5(26.2,343.2) | 22.0(15.0,216.0) | -0.94 | 0.35 |
| AST(U/L) | 75.4(27.8,910.0) | 38.8(24.4,371.1) | -0.51 | 0.61 |
| γ-GGT(U/L) | 87.0(37.0,274.8) | 40.0(29.0,75.0) | -1.56 | 0.12 |
| ALP(U/L) | 287.0(206.8,296.0) | 137.0(73.0,176.0) | -2.10 | 0.04a |
| ALB(g/L) | 38.0(21.7,42.8) | 33.6(31.0,40.3) | -0.08 | 0.94 |
| GLB(g/L) | 28.4(21.0,40.5) | 25.9(21.6,46.9) | -0.16 | 0.88 |
| TBIL(μmol/L) | 6.7(4.7,15.0) | 16.0(10.9,33.0) | -2.26 | 0.02 a |
| DBIL(μmol/L) | 1.3(0.9,6.4) | 3.5(2.7,16.2) | -2.50 | 0.01 a |
| IBIL(μmol/L) | 4.5(3.3,7.2) | 11.6(8.2,21.4) | -2.73 | 0.01 a |
| WBC(×109/L) | 9.7(3.6,16.8) | 4.4(2.4,6.0) | -1.40 | 0.16 |
| NE%(%) | 56.8(47.0,74.0) | 64.5(58.4,80.3) | -1.17 | 0.24 |
| Hb(g/L) | 117.0(106.0,126.2) | 85.0(74.0,103.0) | -2.50 | 0.01 a |
| PLT(×109/L) | 286.0(149.8,467.5) | 76.1(55.0,123.0) | -2.22 | 0.03 a |
| PT(s) | 12.4(11.9,16.4) | 13.9(12.5,16.1) | -1.21 | 0.23 |
| PT%(%) | 84.1(56.4,94.4) | 66.0(41.7,74.8) | -1.48 | 0.14 |
| INR | 1.1(1.0,1.4) | 1.2(1.16,1.6) | -1.40 | 0.16 |
| Child评分 | 5.0(5.0,7.8) | 6.0(5.0,8.0) | -1.03 | 0.23 |
注:ALT为丙氨酸转氨酶;AST为天冬氨酸转氨酶;γ-GGT为γ-谷氨酰转肽酶;ALP为碱性磷酸酶;ALB为白蛋白;GLB为球蛋白;TBIL为总胆红素;DBIL为直接胆红素;IBIL为间接胆红素;WBC为白细胞;NE%为中性粒细胞百分比;Hb为血红蛋白;PLT为血小板;PT为凝血酶原时间;PT%为凝血酶原时间百分比;INR为国际标准化比率;Child评分为Child-Pugh-Turcotte肝病评分;aP<0.05
根据是否合并多囊肾,21例患者肾功指标对比:尿潜血阳性共5例,合并组4例(33.3%),未合并组1例(11.1%);尿蛋白阳性共5例,合并组4例(33.3%),未合并组2例(22.2%)。血尿素氮(BUN)指标升高共4例,合并组2例(16.7%),未合并组2例(22.2%);血肌酐(Cr)指标升高共2例,合并组1例(8.0%),未合并组1例(11.1%)。
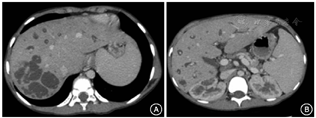
6例Caroli病患者中,影像学提示肾囊肿3例(50.0%)、肝囊肿2例(33.3%)、胆管结石3例(50.0%)、腹水0例、脾大2例(33.3%),6例行胃镜检查的患者均未发现食管静脉曲张。15例Caroli综合征患者中,影像学提示肾囊肿9例(60.0%)、肝囊肿8例(53.3%)、胆管结石5例(33.3%)、肝内胆管结石8例(53.3%)、腹水6例40.0%)、脾大7例(46.7%),15例行胃镜检查的患者中8例(53.3%)存在食管静脉曲张。21例Caroli病/Caroli综合征患者中未行肝穿刺活检的患者(8例),通过影像学诊断:CT可见肝内多发囊状或柱状低密度影,呈分支样扩张,与胆管相通,呈"囊尾征"或"蝌蚪征"(图1);MRI及磁共振胰胆管造影(MRCP)表现:可见扩张的小胆管悬挂在胆道树的枝头,形成"悬挂征"。部分还可见多囊肾、髓质海绵肾等肾脏囊性病变。

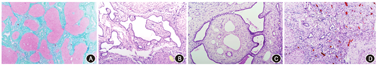
13例患者行肝穿刺活检,其中3例为Caroli病,10例为Caroli综合征组。肝活检组织取材:Caroli病患者取于肝组织(长度1.5~2.0 cm,可见7~11个汇管区),10例Caroli综合征患者取自肝移植病肝(大小约1.1 cm×1.9 cm,灰黄色,质地中等)。光镜下分别从肝硬化分级、胆管板畸形、细胆管胆栓、细胆管内粉红色物质、汇管区炎症、界面炎、急性化脓性胆管炎、细胆管炎、小叶内炎症9个方面进行比较。假小叶形成(8例)占62.0%,胆管板畸形(10例)占77.0%,细胆管胆栓9例占69.0%,粉红色物质(4例)占31.0%(图2)。汇管区炎症分为轻中度:轻度9例(69.0%),中度3例(23.0%),重度1例(8.0%)。界面炎5例(38.0%),急性化脓性胆管炎3例(23.0%),细胆管炎9例(69.0%),小叶内炎症2例(15.0%)(表2)。

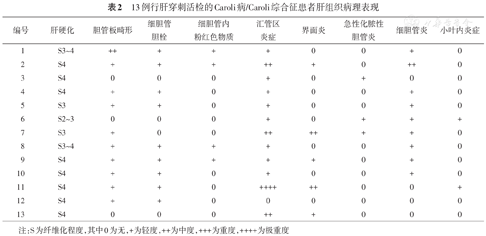
13例行肝穿刺活检的Caroli病/Caroli综合征患者肝组织病理表现
13例行肝穿刺活检的Caroli病/Caroli综合征患者肝组织病理表现
| 编号 | 肝硬化 | 胆管板畸形 | 细胆管胆栓 | 细胆管内粉红色物质 | 汇管区炎症 | 界面炎 | 急性化脓性胆管炎 | 细胆管炎 | 小叶内炎症 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | S3~4 | ++ | + | + | + | 0 | 0 | + | 0 |
| 2 | S4 | + | + | + | ++ | + | 0 | ++ | 0 |
| 3 | S4 | 0 | 0 | 0 | + | 0 | + | 0 | 0 |
| 4 | S4 | + | + | 0 | + | 0 | 0 | + | 0 |
| 5 | S3 | + | + | 0 | + | 0 | 0 | + | 0 |
| 6 | S2~3 | 0 | 0 | 0 | + | 0 | + | + | + |
| 7 | S3 | + | 0 | 0 | ++ | ++ | + | + | 0 |
| 8 | S3~4 | + | + | + | + | 0 | 0 | + | 0 |
| 9 | S4 | + | + | + | + | + | 0 | + | 0 |
| 10 | S4 | + | + | 0 | + | 0 | 0 | + | 0 |
| 11 | S4 | + | + | 0 | ++++ | ++ | 0 | 0 | + |
| 12 | S4 | + | + | 0 | 0 | 0 | 0 | 0 | 0 |
| 13 | S4 | 0 | 0 | 0 | ++ | + | 0 | 0 | 0 |
注:S为纤维化程度,其中0为无,+为轻度,++为中度,+++为重度,++++为极重度
Caroli病/Caroli综合征为罕见的先天性隐性遗传代谢性肝病,1958年由法国学者Caroli首次发现并以此命名[4]。可发生于任何年龄,80%以上患者在30岁前发病,男女发病率大致相等[5]。本研究共纳入21例患者,其中青少年女性较多。
21例患者中,Caroli病6例,Caroli综合征15例。Caroli病表现为肝内胆管多发性囊性扩张,仅涉及胆管畸形,不伴肝硬化及门静脉高压表现。早期可无明显症状,活检肝小叶结构正常。Caroli综合征为汇管区纤维化型,胆管畸形伴CHF和门静脉高压表现,肝小叶结构破坏,易较早出现脾大、腹水和静脉曲张破裂出血等肝硬化表现。可通过临床表现的不同加以区分[6]。
有文献报道,该病可合并多囊肾[7]。其分为常染色体显性多囊肾病(ADPKD)和常染色体隐性多囊肾病(ARPKD)。Caroli病/Caroli综合征和ARPKD均为同一类常染色体隐性遗传性疾病,具有共同的发病机制,表现为多发性肝囊肿、胆管扩张、胆管炎和肾囊肿[8]。本研究发现,合并多囊肾患者共12例,其中合并多囊肾患者可出现尿蛋白及尿潜血阳性,肾功能基本正常。
对于未行肝穿刺活检的患者,还可依赖于影像学检查进行诊断。腹部CT可发现囊状扩张的中央点状影,称为"中央斑点征",或囊状扩张的胆管与细小的胆管相通,形似蝌蚪,称之为"蝌蚪征"[9,10],对Caroli病提供准确的诊断。腹部MRCP平扫显示"悬挂征",囊状病变似悬挂在胆道"树"上的"果实"[11],提示Caroli综合征组常合并腹水、食管胃底静脉曲张、脾大等门静脉高压表现。有文献报道,MRCP对胆管扩张或狭窄的敏感性为90%~95%,对正常肝外胆管的显示率近100%,逐步成为首选的检查。但该病还需与梗阻性肝内胆管扩张、肝内胆管囊腺瘤、肝脓肿等疾病相鉴别[12]。
肝穿刺活检为诊断的金标准。病理方面来看:特征性的病理学表现为囊性扩张的胆管内有纤维组织和血管构成的息肉样突起及条索状结构[13],纤维化程度越轻,胆管板畸形、细胆管胆栓及界面炎程度越轻,未见细胆管内粉红色物质;纤维化程度越重,胆管板畸形、细胆管胆栓及汇管区炎症越重。Caroli病患者病变多为局限性,可见肝内胆管节段性囊状扩张,与肝内胆管树的剩余部分相交通,胆管周围可见淋巴细胞、浆细胞为主的混合性炎性细胞浸润;Caroli综合征组可见肝内胆管扩张和增生,伴程度不一的汇管区及门静脉周围纤维化。
目前对于Caroli病/Caroli综合征的最佳治疗方案仍存在争议,多数人认为手术为最佳治疗方案,包括肝叶部分切除、胆肠内引流术、肝移植术等[14],其中肝移植术可获得较好的远期疗效[15]。本研究纳入的21例患者中,有10例为Caroli综合征,病情重,出现门静脉高压、肝功能严重受损、衰竭等表现,术前评估血常规、凝血、肝功水平均提示明显异常,Child评分较差,故选择肝移植术治疗,术后患者均恢复良好[16]。
综上所述,Caroli病/Caroli综合征是一种先天性常染色体隐性遗传病,目前病因及确切的发病机制不明,发病年龄较轻,早期症状不典型,或仅出现反复发作的胆管结石表现,易漏诊或误诊,通常病理为确诊依据,但是在无肝活检组织病理情况下,也可通过临床症状的不同,辅以实验室检查及影像学分析进行诊断;Caroli综合征患者病情较Caroli病患者重,严重者内科治疗无效时,可行肝移植术治疗[17]。
所有作者均声明不存在利益冲突



























