
探讨基因分型、基因测序和基因表达分析在血液肿瘤患者ABO血型鉴定疑难情况中的应用和发现。
选择2019年6月至2020年5月河北燕达陆道培医院检验科与输血科在血型鉴定时发现血清法正反定型结果不符或凝集不典型的患者3例。分别使用序列特异性引物PCR和Sanger测序法鉴定ABO基因型,用转录组测序分析ABO和FUT1基因表达水平。
1例12岁女性急性淋巴细胞白血病患者为O.01.02和BA.04基因亚型,对应B(A)血清亚型;ABO基因表达量正常(354.80)。1例41岁女性急性髓系白血病患者为A1.02和B.01基因型,对应A1B血清型;ABO基因表达显著减低(45.70)。1例42岁男性骨髓增生异常综合征伴骨髓纤维化患者为A1.02和A2.05亚型,分别对应A1和A2血清型;ABO基因表达量为0。3例患者FUT1基因表达量均在正常范围。临床根据基因型和对应的血清型制定血制品输注策略,无输血相关不良反应发生。
血液肿瘤患者可因血型基因亚型或基因表达异常导致血清学血型鉴定困难。ABO基因分型和血型基因表达分析可帮助准确判定原因,为血制品输注提供更好的安全保障。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
ABO血型系统是最早发现并且最重要的血型系统,正确鉴定ABO血型对临床输血安全极为重要。试管法是ABO血型血清学鉴定的标准方法。由于操作简便、成本低等优势,微柱凝胶法是临床实验室最常用的方法。血清学ABO血型鉴定要求同时做正定型和反定型测试,并且正反定型结果一致。但临床有时会遇到正反定型结果不一致或凝集不典型的情况,导致结果难以判定。相关影响因素有多种,包括少见的血型亚型、疾病导致的血型抗原减弱、血浆中免疫球蛋白抗体产生或量的异常、造血干细胞移植、药物治疗等[1,2]。
血液肿瘤直接累及血细胞的异常,可能影响各系血细胞的ABO基因表达及其编码的糖基转移酶活性水平,或导致抗体生成异常等,血型鉴定疑难的发生率更高。血液肿瘤患者又经常需要输注血制品治疗,准确鉴定血型尤为重要。用序列特异性引物聚合酶链反应(PCR-SSP)和基因测序可鉴定ABO基因型,不受疾病状况干扰。基因表达分析可帮助判定血液肿瘤导致的血型抗原性改变。本研究拟探讨基因分析在血液肿瘤患者疑难血型鉴定和血型基因表达中的应用及相关发现。
选择2019年6月至2020年5月河北燕达陆道培医院检验科与输血科在血清学血型鉴定时发现正反定型结果不符和凝集不典型的临床病例3例,其中男1例,女2例;患者年龄分别为12、41和42岁;诊断分别为急性B细胞淋巴细胞白血病(B-ALL)、急性髓系白血病(AML)和骨髓增生异常综合征(MDS)伴骨髓纤维化(MF)。血液肿瘤诊断按照世界卫生组织2016版指南,结合病理、形态学、免疫分型、细胞遗传学和基因检测整合诊断[3]。本研究经过河北燕达陆道培医院伦理委员会审批(文件号:2020-05),所有研究对象均签署知情同意书。
选择2019年9月至2020年3月河北燕达陆道培医院11名造血干细胞移植健康供者(男6名,女5名)的骨髓体检标本做为转录组基因表达分析的对照样本。
微柱凝胶法、试管法、PCR-SSP基因分型和Sanger基因测序所用标本均为乙二胺四乙酸(EDTA)抗凝的外周血,转录组基因测序所用标本为EDTA抗凝的骨髓。用PerkinElmer LabChip GX型核酸提取仪和磁珠法提取基因组DNA,用北京康为世纪公司的RNA提取试剂盒(货号CW0582S)提取有核细胞总RNA。
微柱凝胶卡、血型抗体和红细胞由西班牙Diagnostic Grifols公司生产。试管法所用试剂由长春博德生物技术公司生产,抗A1、抗H试剂由上海血液生物医药公司生产。
采用天津秀鹏生物技术公司的PCR-SSP法人类红细胞ABO血型基因分型试剂盒(货号SUPER007-002-060),可鉴定A102、A201、A205、B101、O01和O02基因型。基因扩增用西安天隆科技公司Genesy 96T型PCR仪。PCR反应产物用2.5%琼脂糖凝胶电泳分析,根据电泳条带和产品说明书判读ABO基因型。
例1为12岁女性患者,临床诊断为B-ALL,病史记录血型为B型。骨髓形态学原始细胞比例为60.5%。正定型检测患者红细胞与抗A弱凝集,与抗B正常凝集;反定型检测患者血清仅与A1细胞凝集。患者父亲正反定型结果与患者相同。患者母亲正反定型相符,为A型。结合检测结果和家族史,高度怀疑患者及其父亲血型为B(A)亚型。例2为41岁女性患者,临床诊断为AML。骨髓形态学原始细胞比例为82.6%。患者自述曾多次献血,血型记录为AB型。正定型检测患者红细胞与抗A、抗B均为弱凝集且均呈双群,反定型检测患者血清与A1、B细胞均不凝集。结合临床病情怀疑为白血病导致的血型抗原减弱。例3为42岁男性患者,临床诊断为MDS伴MF,病史记录血型为A型。骨髓形态学原始细胞比例为6.1%。正定型检测患者红细胞与抗A、抗A1弱凝集且呈双群,与抗B不凝集;反定型检测患者血清仅与B细胞凝集。结合临床病情考虑为A亚型待定,但不排除白血病导致的抗原减弱。结果见表1。

3例血清型ABO血型鉴定困难患者基因鉴定结果
3例血清型ABO血型鉴定困难患者基因鉴定结果
| 例序 | 方法 | ABO正定型 | ABO反定型 | PCR-SSP | Sanger测序 | 血清型 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 抗A | 抗B | 抗D | 抗A1 | 抗H | A1细胞 | B细胞 | O细胞 | |||||
| 1 | 卡式法 | 2+ | 4+ | 4+ | / | / | 2+ | − | − | BO02 | BA.04/O.01.02 | B(A) |
| 试管法 | 2+ | 4+ | 4+ | − | 4+ | 2+ | − | − | ||||
| 2 | 卡式法 | dp | dp | 4+ | / | / | − | − | − | A1.02B1.01 | A1.02/B.01 | A1B |
| 试管法 | 1+ | 2+ | 4+ | 1+ | 3+ | − | − | − | ||||
| 3 | 卡式法 | dp | − | 4+ | / | / | − | 4+ | − | A2.05O01 | A1.02/A2.05 | A1/A2 |
| 试管法 | 2+ | − | 4+ | 2+ | 3+ | − | 4+ | − | ||||
注:卡式法为微柱凝胶卡式法;PCR-SSP为序列特异性引物PCR;+为阳性;-为阴性;dp为双群;/为未检测
例1患者和其父亲均为BO02基因型。例2患者为A1.02B1.01基因型。例3患者和其子均为A2.05O01基因型。
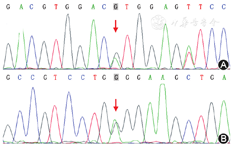
例1患者和其父亲均为BA.04/O.01.02基因型,符合遗传规律,对应B(A)血清亚型。相对于参考序列A1.01,BA.04亚型有8个位点多态性,其中除c.640A>G(图1A)外的7个位点多态性与B1.01相同[5]。例2患者为常见的A1.02/B.01基因型,对应A1B血清型。例3患者为A1.02/A2.05基因型,2个等位基因分别对应A1血清型(有A和A1抗原性)和A2血清型(只有A抗原性)。相对于参考序列A1.01,A2.05亚型有c.467C>T(与A1.02相同)和c.1009A>G(图1B)2个位点多态性[5]。

11名健康对照者ABO基因表达量为285.80(177.33~501.58)。例1患者的ABO基因表达量为354.80,处于正常范围。例2患者的ABO表达量为45.70,显著减低。例3患者的ABO表达量为0,为表达缺失。11名健康对照者FUT1基因表达量为329.86(187.51~708.56)。例1、例2、例3的FUT1表达量分别为613.65、394.32、259.24,未见明显异常。
例1患者为BA.04基因亚型导致的血清学B(A)亚型,有弱的A抗原性,免疫法鉴定时出现抗A弱凝集并且正反定不符。鉴定为B(A)亚型后,输注红细胞时应首先考虑同型,其次选择洗涤B型或洗涤O型,输注其他血制品时应选AB型。患者在本院治疗期间累计接受输注洗涤O型红细胞22单位、AB型去白细胞冰冻血浆200 ml、AB型浓缩血小板10个单位和AB型去白细胞单采血小板13个治疗量,未见明显输血相关不良反应。
例2患者为常见的A1B型,考虑因ABO表达和糖基转移酶活性减低,导致A、B抗原性减弱。患者应选择同型血制品输注。该患者在本院治疗期间累计接受输注AB型去白细胞悬浮红细胞19.5单位、AB型冰冻血浆350 ml、AB型浓缩血小板6个单位和AB型单采血小板5个治疗量,未见明显输血相关不良反应。
例3患者为A1.02/A2.05基因型,ABO表达缺失。可能主要因ABO表达缺失导致A和A1抗原性减低,出现患者红细胞与抗A、抗A1弱凝集且呈双群。该患者在本院治疗期间累计接受输注洗涤O型红细胞15单位、A型新鲜冰冻血浆3 000 ml、A型单采血小板24治疗量,未见明显输血相关不良反应。
ABO是人类免疫原性最强的血型系统,少见型等位基因可导致B(A)等血清学亚型。少见基因型和血清学亚型若不能被正确鉴定,将带来血制品输注的安全隐患。本研究中例1患者既往错误地鉴定为B型血,经基因测序明确为BA.04/O.01.02基因型和B(A)血清亚型,血制品输注时应考虑选择洗涤O型红细胞或洗涤B型红细胞更安全。例3患者根据血清学检测结果怀疑可能为A亚型,因此输注红细胞时选择洗涤O型。经基因测序证实为A1.02/A2.05杂合型后,则支持可选择A型血输注。
在2020年3月更新的Leiden基因组变异数据库中已收录了541种ABO等位基因型(http://www.LOVD.nl/ABO),仍不断有新的基因型报道[4,8]。最近的一篇研究报道在46例血清学正反定型不一致的标本中,即鉴定出12个新的ABO等位基因[4]。真实存在的ABO等位基因型还可能更多,也凸显基因测序鉴定基因型的重要性。针对某些特定的ABO多态性位点设计的PCR-SSP法具有操作方便、报告速度快等优点,但只能检测有限的基因型,并且常难以明确到具体的等位基因型。在本研究中,用PCR-SSP法未能明确鉴定出例1患者的BA.04亚型和例3患者的A2.05亚型,也证明了该方法的局限性。
Sanger测序是当前鉴定ABO基因型的标准方法。但由于ABO基因序列多态性丰富,各等位基因型常需结合多个位点的多态性确定。Sanger测序得到的是两个ABO等位基因序列的混合结果,在进行多个杂合位点的多态性关联分析时存在难以定相和判定单体型的问题。新一代高通量基因测序可部分解决定相的困难,有助于更准确鉴定ABO等位基因型和发现新的等位基因[9,10]。
ABO基因表达于多种血细胞和血液肿瘤细胞系[2,11],正常情况在早期阶段造血细胞中更高表达,并随分化成熟表达减低[12]。血液肿瘤时可能因基因突变、转录因子改变或表观遗传调控异常等导致ABO表达减低或缺失[12,13]。本研究的3例血清学结果不典型的患者中,有2例ABO基因表达显著减低甚至缺失。这也提示在血液肿瘤中,因ABO表达减低导致糖基转移酶活性和A、B抗原性减低的情况可能比基因亚型更多见。在缺乏基因型证据时,ABO表达减低的患者有可能被错误地鉴定为A亚型或B亚型。本研究观察的是骨髓有核细胞中ABO基因的表达,其与成熟红细胞上H抗原的糖基化修饰和抗原表型的关系,还待进一步研究确认。
血液肿瘤患者常需血制品输注治疗,基因型亚型和疾病状况都可能干扰血清学血型鉴定。ABO基因测序和表达量分析可帮助准确鉴定血型、为血制品输注提供安全保障,还有利于发现和鉴定新的等位基因型、揭示血液肿瘤相关的基因异常表达规律,应予重视和推广。血站特配室亦应关注基因型和疾病状况对血型基因表达的影响,在遇到不典型情况时应重视基因分型和基因表达的证据。
所有作者均声明不存在利益冲突



























