
明确氟中毒大鼠生殖损伤状态下的氧化应激和内质网应激水平,并观察α-硫辛酸(α-LA)干预后各相关指标的变化,探讨α-LA在氟中毒大鼠生殖损伤中的作用及可能机制。
将40只雄性Sprague-Dawley(SD)大鼠采用随机数字法分为四组,分别为对照组(0.9%氯化钠);α-LA组(100 mg/kg α-LA);氟化钠(NaF)组(25 mg/kg NaF);NaF和α-LA联合作用组(25 mg/kg NaF+100 mg/kg α-LA)。采用灌胃的方式染毒,染毒8周后,各组分别进行精子质量分析、睾丸氟含量测定及HE染色;TUNEL法检测睾丸组织细胞凋亡;生化法测定氧化应激相关指标;Western印迹检测睾丸组织中GRP78、PERK及CHOP的蛋白表达水平。
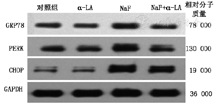
与对照组相比,NaF组的精子密度及精子存活率较低[(5.99±1.45)×106/ml比(10.96±1.83)×106/ml,P<0.01;(33.40±2.71)%比(66.41±3.33)%,P<0.01],精子畸形率较高[(26.43±2.43)%比(11.44±1.55)%,P<0.01)];与NaF组相比,NaF+α-LA组的精子密度及精子存活率较高[(8.47±0.82)×106/ml比(5.99±1.45)×106/ml,P<0.05;(49.97±3.51)%比(33.40±2.71)%,P<0.05],而精子畸形率较低[(22.69±2.39)%比(26.43±2.43)%,P<0.05]。与对照组相比,NaF组的睾丸氟含量较高[(11.14±0.77)μg/g比(5.78±0.28)μg/g,P<0.01]。光学显微镜下可见NaF组的生精细胞间结构较为疏松,生精细胞和成熟精子数量减少,与α-LA联合作用后,生精细胞结构损伤有所改善,管腔脱落细胞减少。TUNEL检测发现,NaF组的凋亡指数较高[(61.32±7.14)%比(6.99±2.17)%,P<0.01];与NaF组相比,NaF+α-LA组细胞凋亡指数较低[(45.96±5.31)%比(61.32±7.14)%,P<0.01]。氧化应激水平检测发现,与对照组相比,NaF组的丙二醛(MDA)较高[(5.46±0.30)nmol/mgprot比(3. 24±0.58)nmol/mgprot,P<0.01],超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)较低[(6.04±0.71)U/mgprot比(7.19±0.52)U/mgprot,P<0.01;(23.67±0.99)U/mgprot比(26.91±1.67)U/mgprot,P<0.01];与NaF组相比,NaF+α-LA组MDA较低[(4.66±0.70)nmol/mgprot比(5.46±0.30)nmol/mgprot,P<0.05],GSH-Px较高[(25.90±1.93)U/mgprot比(23.67±0.99)U/mgprot,P<0.05]。内质网应激水平检测发现,与对照组相比,NaF组的GRP78、PERK和CHOP蛋白表达水平明显上调(0.79±0.05比0.45±0.09,P<0.01;0.71±0.04比0.40±0.05,P<0.01;0.79±0.09比0.19±0.08,P<0.01),与NaF组相比,α-LA抑制了NaF介导的GRP78和CHOP蛋白表达上调(0.46±0.06比0.79±0.05,P<0.01;0.52±0.09比0.79±0.09,P<0.01)。
α-LA可通过抑制氧化-内质网应激信号通路,对氟中毒大鼠生殖损伤起到一定的保护作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
氟中毒是一种严重危害人类健康的全身性疾病,过量氟不仅造成骨相损害,还可引起机体其他慢性、潜在性危害,如生殖、神经及内分泌系统的损伤等[1]。由于氟暴露对机体损害的全身性、复杂性,目前国内外学者已广泛关注[2]。本课题组前期研究结果显示,内质网应激可能参与了氟中毒雄性大鼠生殖损伤机制,且氧化应激可能通过介导内质网应激在氟中毒生殖损伤中发挥作用[3],而选择一种强效的抗氧化剂成为减轻氟中毒生殖损伤的关键。近年来,α-硫辛酸(α-lipoic acid,α-LA)因其独特的抗氧化功能成为抗氧化剂研究领域的热点,其不仅可清除体内的自由基,还能还原体内的抗氧化系统,增强机体抗氧化能力,在糖尿病、肝硬化、急慢性肝炎、器官移植、男性不育症、皮肤系统等疾病的治疗方面具有广大的应用前景[4,5,6]。而α-LA在氟致雄性生殖损伤中是否具有保护的作用及其可能涉及的机制,目前尚不明确,需进一步研究证实。本研究拟通过建立氟中毒大鼠生殖损伤模型,采用抗氧化剂α-LA干预后,观察大鼠精子质量、组织形态、氧化应激、内质网应激及细胞凋亡指标的变化,探讨α-LA在氟致大鼠生殖损伤中的作用,为氟中毒雄性生殖损伤的防治提供新的思路。
选择4周龄清洁级雄性Sprague-Dawley(SD)大鼠40只,体重90~110 g,由河南省实验动物中心提供[动物中心许可证编号:SCXK (豫)2010-0002]。大鼠于清洁级动物房饲养,自由饮水,经检疫1周无异常后,采用随机数字法分成4组,每组10只,即对照组、氟化钠(NaF)组、α-LA组、NaF和α-LA联合作用组。各组大鼠每天每kg体重给药如下:对照组给予0.9%氯化钠溶液;α-LA组给予100 mg/kg α-LA溶液;NaF组给予25 mg/kg NaF溶液;NaF+α-LA联合作用组给予(25 mg/kg NaF+100 mg/kg α-LA)溶液,根据课题组前期氟中毒模型建立方法[3],各组大鼠均采用灌胃方法给予受试物。每周连续灌胃6 d后,停灌1 d,灌胃时间为8周。在本实验过程中,研究人员人道地进行动物实验,并采取合理措施,严格遵守动物实验的各项伦理条例。
全自动精子质量分析系统(上海圣荷西医疗用品有限公司);氟离子选择电极(上海电元器件厂);Bio-Rad凝胶成像系统(美国伯乐公司);DYY-4C电泳仪、DYC-31A电泳槽(北京市六一仪器厂);NaF(天津市光复精细化工研究所);α-LA(重庆药友制药有限责任公司);缺口末端标记法(TUNEL)细胞凋亡原位检测试剂盒(南京凯基生物科技发展有限公司);GRP78多克隆抗体、PERK多克隆抗体和CHOP多克隆抗体(美国Immuno Way公司);GAPDH多克隆抗体(武汉三鹰生物公司);脂质氧化产物丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)测试盒和谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所)。
大鼠处死后,立即打开腹腔,用眼科镊剥离一侧附睾尾,制备精子滤液,各取1滴精子滤液滴于载玻片上,分别统计每毫升精子数、精子活动率和精子畸形率。精子活动率(%)=活动精子数/(活动精子数+无活动精子数)×100%。精子畸形率(%)=畸形精子数/(正常精子数+畸形精子数)×100%。
取单侧睾丸于60 ℃烤箱烘烤24 h制备样本,然后取干燥至恒重的组织加入盐酸,充分研磨制备匀浆,于60 ℃水浴箱中水浴6 h,取出后离心,小心吸取上清液,用总离子强度调节缓冲液定容至10 ml,再加入5 ml去离子水,混匀备用。采用标准加入法,用氟离子选择电极测定氟浓度。睾丸氟含量(μgF-/g组织干重)=(C×15×1 000)/(m×1 000)。C为测定用样液中氟的浓度(μg/ml);m样品质量(g);15为样品液体积(ml)。
取单侧睾丸,置于10%甲醛溶液中固定48 h,随后依次进行组织浸腊、切片、脱蜡水化、染色、脱水透明,干燥后于200倍光学显微镜下观察生精上皮细胞形态结构、管腔细胞脱落情况等。
采用脱氧核糖核苷酸末端转移酶介导的TUNEL细胞凋亡检测试剂盒对睾丸组织凋亡细胞进行检测,操作过程按照试剂盒说明进行。于400倍光学显微镜光镜下观察正常细胞为蓝紫色,凋亡细胞为棕色并出现染色质浓缩、凋亡小体、细胞皱缩与周围分离等。细胞凋亡指数=凋亡细胞数/细胞总数×100%。
称取适量睾丸组织,加入9倍体积的生理盐水,冰浴下在组织匀浆器中研磨,制备的组织匀浆,用于氧化应激指标及蛋白含量的测定。取制备好的匀浆上清液,分别按照南京建成MDA、SOD和GSH-Px试剂盒测试说明书进行,细胞蛋白含量测定采用BCA法。
称取适量睾丸组织制备组织匀浆,加入裂解缓冲液,于3 871 g、4 ℃离心5 min。吸取上清即为提取的睾丸组织总蛋白,用BCA法检测蛋白浓度。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离后,转移到PVDF膜上。分别加入稀释的一抗(1∶1 000),GRP78、PERK和CHOP的兔多克隆抗体,4 ℃摇床振荡过夜,次日加入HRP标记的羊抗兔二抗,室温孵育1 h,ECL化学发光法显色,Bio-Rad凝胶像系统采集图像,Quanlity one软件蛋白条带进行光密度分析。以GAPDH为内参,分析蛋白相对表达量,目的蛋白与GAPDH灰度的比值即为目的蛋白的相对表达量。
采用SPSS 21.0对数据进行统计处理,复合正态分布的计量资料用 ±s表示。采用单因素方差分析进行多组间比较,两两比较采用LSD-t检验法。双侧检验,检验水准α=0.05。
±s表示。采用单因素方差分析进行多组间比较,两两比较采用LSD-t检验法。双侧检验,检验水准α=0.05。
采用全自动精子质量分析仪检测大鼠精子质量,与对照组相比,NaF组的精子密度及精子存活率较低,而精子畸形率较高,差异有统计学意义(P<0.01);经与α-LA联合作用后,与NaF组相比,NaF+α-LA组的精子密度及精子存活率较高,而精子畸形率较低,差异有统计学意义(P<0.05) (表1)。
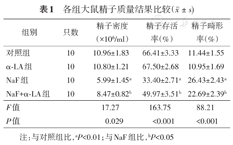
各组大鼠精子质量结果比较( ±s)
±s)
各组大鼠精子质量结果比较( ±s)
±s)
| 组别 | 只数 | 精子密度(×106/ml) | 精子存活率(%) | 精子畸形率(%) |
|---|---|---|---|---|
| 对照组 | 10 | 10.96±1.83 | 66.41±3.33 | 11.44±1.55 |
| α-LA组 | 10 | 10.80±1.21 | 67.50±2.68 | 10.95±1.69 |
| NaF组 | 10 | 5.99±1.45a | 33.40±2.71a | 26.43±2.43a |
| NaF+α-LA组 | 10 | 8.47±0.82b | 49.97±3.51b | 22.69±2.39b |
| F值 | 17.27 | 163.75 | 88.21 | |
| P值 | 0.029 | <0.001 | <0.001 |
注:与对照组比,aP<0.01;与NaF组比,bP<0.05
采用氟离子选择电极法测定睾丸氟浓度,睾丸氟含量如下:对照组为(5.78±0.28)μg/g;α-LA组为(5.88±0.15)μg/g;NaF组为(11.14±0.77)μg/g;NaF+α-LA组为(10.73±0.28)μg/g,结果显示,各组间差异有统计学意义(F=454.67,P<0.01),其中,NaF组的睾丸氟含量高于对照组,差异有统计学意义(P<0.01);与α-LA联合作用后,NaF+α-LA组睾丸氟浓度低于NaF组,差异无统计学意义(P>0.05)。
采用HE染色睾丸组织,在光学显微镜下观察组织形态,可见对照组和α-LA组的生精上皮细胞形态结构完整,管腔细胞无脱落,有大量成熟精子;NaF组的生精细胞间结构较为疏松,生精细胞数量减少,管腔中有脱落的精子及组织,成熟精子数量减少;与α-LA联合作用后,生精细胞结构有所改善,管腔脱落细胞减少(图1)。
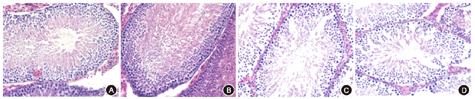

采用TUNEL法对睾丸组织进行组织化学染色,在光学显微镜下显示凋亡细胞为棕色,正常细胞为蓝紫色(图2)。观察并计数睾丸组织的凋亡细胞,统计凋亡指数结果,对照组为(6.99±2.17)%;α-LA组为(7.19±1.78)%;NaF组为(61.32±7.14)%;NaF+α-LA组为(45.96±5.31)%;各组间差异有统计学意义(F=175.13,P<0.01),其中,NaF组的凋亡指数高于对照组(P<0.01);与α-LA联合作用后,NaF+α-LA组细胞凋亡指数低于NaF组(P<0.01)。


检测各组睾丸组织的氧化应激相关指标,与对照组相比,NaF组的MDA含量较高,SOD和GSH-Px活力较低(P<0.01);与α-LA联合作用后,与NaF组相比,NaF+α-LA组MDA含量较低,GSH-Px活力较高(均P<0.05)(表2)。
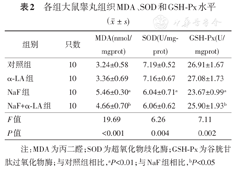
各组大鼠睾丸组织MDA、SOD和GSH-Px水平( ±s)
±s)
各组大鼠睾丸组织MDA、SOD和GSH-Px水平( ±s)
±s)
| 组别 | 只数 | MDA(nmol/mgprot) | SOD(U/mgprot) | GSH-Px(U/mgprot) |
|---|---|---|---|---|
| 对照组 | 10 | 3.24±0.58 | 7.19±0.52 | 26.91±1.67 |
| α-LA组 | 10 | 3.36±0.69 | 7.16±0.67 | 27.08±1.73 |
| NaF组 | 10 | 5.46±0.30a | 6.04±0.71a | 23.67±0.99a |
| NaF+α-LA组 | 10 | 4.66±0.70b | 6.06±0.62 | 25.90±1.93b |
| F值 | 19.69 | 6.26 | 7.11 | |
| P值 | <0.001 | 0.004 | 0.002 |
注:MDA为丙二醛;SOD为超氧化物歧化酶;GSH-Px为谷胱甘肽过氧化物酶;与对照组相比,aP<0.01;与NaF组相比,bP<0.05
Western印迹法检测睾丸组织内质网应激相关蛋白表达情况(图3)。与对照组相比,NaF组的GRP78、PERK和CHOP蛋白表达水平明显上调(P<0.01);经与α-LA联合作用后,与NaF组相比,α-LA明显抑制了GRP78和CHOP蛋白表达水平的上调(P<0.01)(表3)。
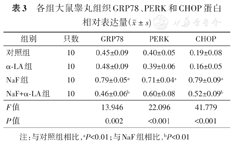
各组大鼠睾丸组织GRP78、PERK和CHOP蛋白相对表达量( ±s)
±s)
各组大鼠睾丸组织GRP78、PERK和CHOP蛋白相对表达量( ±s)
±s)
| 组别 | 只数 | GRP78 | PERK | CHOP |
|---|---|---|---|---|
| 对照组 | 10 | 0.45±0.09 | 0.40±0.05 | 0.19±0.08 |
| α-LA组 | 10 | 0.48±0.09 | 0.39±0.06 | 0.16±0.05 |
| NaF组 | 10 | 0.79±0.05a | 0.71±0.04a | 0.79±0.09a |
| NaF+α-LA组 | 10 | 0.46±0.06b | 0.60±0.08 | 0.52±0.09b |
| F值 | 13.946 | 22.096 | 41.779 | |
| P值 | 0.002 | <0.001 | <0.001 |
注:与对照组相比,aP<0.01;与NaF组相比,bP<0.01

氟是自然界化学性质最活泼的非金属元素,广泛分布于各环境介质中。生殖系统为氟蓄积后产生毒作用的重要靶器官之一,而睾丸及附睾成为氟中毒生殖损伤的主要软组织[7]。本实验是在前期氟致生殖损伤机制研究的基础上开展的,根据前期实验结果,NaF灌胃7周以后,大鼠可出现氟中毒症状[3]。另外,亚急性染毒实验的染毒剂量一般根据受试物的半数致死量(LD50)来确定,通常为1/10LD50,经口灌胃时,每日每千克体重20 mg NaF可引起氟中毒症状。因此,为了更好地观察NaF生殖毒效应及其机制,本研究采用每日每千克体重25 mg NaF染毒8周后检测各指标,结果显示,NaF组大鼠的睾丸氟含量升高;精子密度及精子存活率降低,精子畸形率升高;睾丸组织形态结构破坏,生精细胞及成熟精子数量减少;睾丸组织细胞凋亡指数升高。上述证据说明氟致大鼠生殖损伤模型建立成功。
近年来,关于氟中毒发病机制的研究涉及到了很多方面,其中包括氧化应激、内质网应激、炎症因子、生殖激素和MAPK信号通路等[8,9,10]。本课题组前期研究发现,活性氧诱导的氧化应激既是内质网应激的诱因,又是氟致睾丸支持细胞损伤的重要环节,活性氧-内质网应激信号通路可能是染氟睾丸支持细胞损伤的重要机制之一[11]。本次研究采用生化方法检测睾丸组织氧化应激水平,结果显示,NaF造成大鼠睾丸组织中的MDA含量升高,SOD和GSH-Px活力降低,说明机体出现了过量的氧化应激。另外,采用Western印迹方法检测睾丸组织内质网应激相关蛋白的表达情况,结果显示,NaF明显上调了内质网应激分子伴侣GRP78、感应蛋白PERK及特异性凋亡因子CHOP的蛋白表达水平。上述结果提示,本次研究建立的大鼠生殖损伤模型中同时出现了氧化应激和内质网应激。
α-LA属于B族维生素的一种,广泛存在于自然界动植物及微生物中,其兼具脂溶性和水溶性的双重特性,可自由进出细胞,在人体各个部分发挥作用。α-LA具有独特双硫键抗氧化分子结构,可清除氢氧自由基、氢氧化物等氧化应激产物;可与二氢硫辛酸相互转化,还原内源性抗氧化酶,使其恢复活性;其是细胞线粒体的主要酶之一,能以辅酶形式参与能量形成,发挥其生理作用[12,13]。近年来临床上α-LA的应用较为广泛,且α-LA对精子损伤的保护作用,目前已受到国内外相关学者的关注[14,15,16]。而α-LA在氟致生殖损伤过程中是否具有保护作用及其作用机制,目前尚不明确。本实验采用抗氧化剂α-LA干预后,结果显示,生殖损伤有所减轻,如精子质量明显提高,生精细胞结构损伤有所改善,细胞凋亡减少,氧化应激水平降低,且抑制了内质网应激相关蛋白表达的上调。以上结果提示,a-LA能够减轻NaF介导的大鼠生殖损伤,降低睾丸组织中的氧化应激和内质网应激水平。
综上所述,本研究证实α-LA可有效拮抗NaF介导的生殖损伤相关效应,能够保护睾丸组织对抗NaF引起的氧化损伤,且能抑制NaF对内质网应激相关蛋白表达的上调作用。提示α-LA可通过抑制氧化-内质网应激信号通路,对NaF介导的大鼠生殖损伤起到一定的保护作用。而目前α-LA对氟致雄性生殖损伤的研究仅涉及动物实验,仍需进一步的临床研究明确其疗效,为氟致男性生殖损伤的防治提供新的思路。
所有作者均声明不存在利益冲突



























