
晚期胃癌患者因缺乏有效的二线及后线治疗手段,其生存时间始终难以突破1年。近年随着多学科诊疗及新药研发的推进,晚期胃癌的药物治疗及治疗策略正在发生着重大变化。近期几个Ⅲ期临床试验已证实伊立替康和紫杉类为代表的细胞毒药物仍为二线治疗之基石,不同靶点的靶向药物也可作为二线治疗的选择之一。此外,免疫检查点抑制剂的出现,或可成为改写晚期胃癌三线治疗格局的关键。本文总结了晚期胃癌当前现有的二线及后线药物治疗的进展和未来潜在的发展方向,为临床诊疗提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是我国乃至全世界最常见的恶性肿瘤之一,据2019年国家癌症中心发布数据显示:2015年估计中国胃癌的新发病例数每年在40.3万例左右,死亡人数在29.1万例左右[1]。我国接近60%的胃癌患者就诊时已属中晚期,且1.7%为胃癌合并双原发癌,非根治性手术治疗后平均生存13个月,预后更差[2]。晚期胃癌的综合治疗手段疗效有限,目前以铂类和氟尿嘧啶类为常规的胃癌一线化疗失败后缺乏有效的后线治疗手段[3]。为更规范地推广胃癌的二线/后线治疗,本文对晚期胃癌目前常用的二线药物及后线治疗常用方案及进展进行综述。
胃癌患者二线治疗的疗效个体差异较大,总生存(OS)时间为3.5~10.7个月,客观缓解率(ORR)为4.8%~52.3%。美国国立综合癌症网络(NCCN)指南中二线治疗的原则是参考一线治疗方案,优先选择未曾使用的一线药物,这也就使得二线化疗药物有多种选择可能。
1.以伊立替康(CPT-11)为主的方案:2011年Thuss-Patience等[4]进行的Ⅲ期临床试验纳入了40例一线铂类耐药的患者,随机入组接受二线伊立替康单药化疗或最佳支持治疗(BSC);观察组疾病无进展生存(PFS)时间优于对照组(4.0个月比2.4个月),观察组OS时间优于对照组(6.87个月比5.46个月),死亡风险比(HR)降至0.48;经治疗,观察组肿瘤相关症状改善率明显优于对照组(50%比7%)。Kang等[5]公布的目前最大规模胃癌二三线化疗的Ⅲ期随机对照研究表明,单药化疗(多西他赛或伊立替康)+BSC组(133例)的中位OS时间为5.3个月,BSC组(69例)的中位OS时间为3.8个月; 60例接受伊立替康单药化疗患者的中位治疗时间为4.2个月,与BSC组相比,化疗组死亡风险降低了34%(HR=0.657,P=0.007)。至此肯定了晚期胃癌二线化疗可以通过减轻症状、延长总生存期带来获益。Higuchi等[6]报道130例一线治疗失败后的晚期胃癌患者使用伊立替康联合顺铂(BIRIP组)对比伊立替康单药双周化疗,尽管BIRIP组的PFS时间和疾病控制率(DCR)明显优于伊立替康组,但两组的中位OS时间差异无统计学意义。李建旺等[7]报道了168例复治晚期胃腺癌患者随机给予伊立替康联合顺铂或伊立替康单药治疗的疗效,两组DCR、ORR、OS和PFS时间的差异均无统计学意义;但亚组分析显示,肠型腺癌中两药组的中位OS时间优于单药组。说明单药伊立替康可作为胃癌的二线治疗药物,联合顺铂方案或许对肠型胃癌患者带来一定生存获益。
2.紫杉醇:Hironaka等[8]在氟尿嘧啶及顺铂一线治疗失败后的219例胃癌患者中比较紫杉醇与伊立替康方案的有效性及安全性;伊立替康组中位OS时间为8.4个月,紫杉醇组中位OS时间为9.5个月,证实两者都是晚期胃癌的合理二线用药选择。Im等[9]入组了至少一次化疗失败,Karnofsky活动状态评分表(KPS评分)为2~3分的晚期胃癌患者,给予同样的紫杉醇单药方案,中位OS为7.1个月,毒性可耐受。单药紫杉醇是NCCN胃癌指南二线治疗的标准用药推荐,中国临床肿瘤学会(CSCO)胃癌指南也特别指出对美国东部肿瘤协作组(ECOG)=2的患者应给予单药紫杉醇(1A类证据)。
3.以多西他赛、白蛋白结合型紫杉醇为主的方案:多西他赛很早就奠定了在胃癌二线治疗中标准用药地位[5, 10],既往研究认为多西他赛和紫杉醇可能存在交叉耐药。日本一项回顾性研究发现使用任何一种紫杉类化疗药出现进展以后,换用另一种紫杉类药物进行化疗的ORR为5%(1/20),DCR为17.9%(5/28),提示可能存在交叉耐药[11]。ABSOLUTE研究是日本72家机构开展的随机、开放标签、非劣效的Ⅲ期临床试验[12],证实了白蛋白结合型紫杉醇的生存率不劣于溶剂型紫杉醇,但试验组超敏反应发生率较低。因此白蛋白结合型紫杉醇以其制剂的优势成为胃癌二线治疗推荐的方案之一。龚继芳等[13]报道了一项关于白蛋白结合型紫杉醇联合替吉奥二线治疗晚期胃癌的前瞻性Ⅰb期临床试验,19例患者DCR为63.2%,中位随访21.2个月后,治疗失败的时间(TTF)为161 d,至死亡时间(TTD)为404 d,进一步提示该方案在胃癌二线治疗中的可行性。目前胃癌单药的二线化疗DCR为20%~65%,单药伊立替康、紫杉醇类药物均可作为选择,如一线治疗未使用过氟尿嘧啶类,替吉奥和卡培他滨也可作为联合用药或单药选择。具体方案的选择除需要考虑患者一线用药情况外,还需结合患者体力状况、肿瘤组织学类型以及前序治疗的累积性毒性等因素。
胃癌靶向药物的热点当属抗人表皮生长因子受体-2(HER-2)抗体及抗血管生成抗体。另外,呋喹替尼和瑞戈非尼等小分子多靶点酪氨酸激酶抑制剂(TKI)也有一定的进展,而针对其他靶点的药物在胃癌二线治疗的临床研究均无阳性结果,例如依维莫司、舒尼替尼等。
1.HER-2阳性患者的二线治疗:一项Ⅱ期非随机研究显示一线未使用曲妥珠单抗者,二线曲妥珠单抗联合紫杉醇治疗HER-2阳性的胃癌患者有较好的疗效和安全性[14],本课题组一项单中心回顾性研究显示,无论一线、二线或三线,何时使用曲妥珠单抗均能为HER-2阳性胃癌患者带来临床获益[15];然而一项前瞻性研究结果却有不同结论,即HER-2阳性胃癌患者一线使用曲妥珠单抗进展后,二线继续使用曲妥珠单抗的跨线治疗并不能延长PFS[16]。除曲妥珠单抗外,帕妥珠单抗也是经典的抗HER-2的治疗药物。遗憾的是,对于HER-2阳性胃癌患者,一线曲妥珠联合帕妥珠同时联合双药化疗的JACOB研究的阴性结果[17],阻碍了双妥抗HER-2治疗在胃癌领域的探索。吡咯替尼是一种中国原研的小分子、不可逆、泛HER受体TKI,已批准用于治疗HER-2阳性乳腺癌,目前有国内研究发现吡咯替尼在HER2阳性胃癌中的应用会产生促进血管内皮细胞增殖和运动的更强外泌体,也有其治疗胃癌的个案报道,Ⅰ期临床试验正在招募,希望成为胃癌抗HER-2新的武器[18]。虽然在既往的研究中提示拉帕替尼、恩美曲妥珠单抗(TDM-1)均未能改变胃癌患者二线的生存时间,但是依然没能阻止对抗HER-2治疗的探索。2020年5月Trastuzumab deruxtecan(DS-8201)获美国食品药品监督管理局(FDA)授予在胃癌中的孤儿药称号,DS-8201是一种新型抗体-药物偶联物,由人源化抗HER-2单抗曲妥珠单抗、可切割的肽基连接体和拓扑异构酶Ⅰ抑制剂组成,具有更高的载药量,进一步提高了安全性和给药剂量,DESTINY-Gastric01研究是评估DS-8201用于至少经两种治疗进展的HER-2表达晚期胃癌患者的Ⅱ期研究,结果显示DS-8201明显提高了二线后晚期胃癌的ORR,且与化疗方案相比,其死亡风险减低了41%(HR=0.59),未来将成为HER-2阳性胃癌患者的新希望[19]。
2.雷莫芦单抗(Ramucirumab):RAINBOW研究是一项全球多中心随机双盲对照Ⅲ期临床试验[20],结果显示雷莫芦单抗联合紫杉醇组的中位OS时间显著高于安慰剂联合紫杉醇组,PFS时间和ORR均高于紫杉醇单药组;但亚组分析提示欧美患者获益显著,亚洲患者OS时间无显著改善;但因该研究中亚洲例数仅占约1/3,所以总人群仍得到了阳性结果。欧洲肿瘤内科学会(ESMO)亚洲年会指南认为,紫杉醇加雷莫芦单抗现在是KPS评分良好的转移性胃癌患者的首选二线治疗药物。日本推荐雷莫芦单抗单药,或联合白蛋白结合型紫杉醇作为二线治疗药物。因雷莫芦单抗在我国的临床试验尚在进行,目前没有写入CSCO指南。
3.TKI联合方案:小分子抗血管生成的TKI尽管无充足证据,但鉴于阿帕替尼在三线治疗的数据,不少中国研究者开展了二线的临床研究,初步证实了阿帕替尼联合氟尿嘧啶类化疗药物的可行性[21]。相比多西他赛单药,阿帕替尼联合多西他赛能显著提高ORR和DCR,联合用药组的中位PFS时间为3.5个月,明显优于单药化疗组的2.0个月[22]。Xu等[23]发现呋喹替尼联合紫杉醇二线治疗晚期胃癌Ⅰ/Ⅱ期临床试验结果显示,在推荐剂量4 mg组,25例患者ORR达到32%,持续至少8周的DCR达到72%,该方案表现出积极的疗效与可控的安全性,Ⅲ期研究已开始招募。2019年的一项Ⅰb期REPEAT研究探索了瑞戈非尼联合紫杉醇用于晚期食管胃癌二线或以上治疗的最大耐受剂量(瑞戈非尼 120 mg/d,紫杉醇80 mg/m2 每周,每3周给药),并提示安全性良好,中位PFS时间为4.1个月,OS时间为7.8个月[24]。这些小样本的探索性研究提示抗血管生成的TKI联合化疗的确有一定的治疗前景。
KEYNOTE-061研究旨在探索帕博利珠单抗用于晚期胃或胃食管结合部腺癌二线治疗的疗效与安全性[25]。经一线含铂及氟尿嘧啶方案治疗失败的患者随机接受帕博利珠单抗或紫杉醇治疗,主要终点为在程序性死亡受体-配体1(PD-L1)阳性,即联合阳性评分(CPS)≥1患者的PFS和OS,研究设定统计效能91%,单侧α=0.025,OS的α=0.021 5,PFS的α=0.003 5,所需PD-L1阳性样本量为360例,只要帕博利珠单抗的疗效满足任一主要研究终点即可。2018年初次报道结果显示,帕博利珠单抗组较紫杉醇组未能显著延长OS,中位OS时间:9.1个月比8.3个月,且两组中位PFS时间分别为1.5个月和4.1个月;亚组分析显示,对于CPS≥10或者微卫星高度不稳定(MSI-H)的胃癌患者,帕博利珠单抗组能够更好地改善OS时间。2020年再次报道了延长两年随访后的更新数据,结果表明,两组PFS时间差异仍无统计学意义,两组中位OS时间数值尽管没变,但P=0.03,接近预设的α值,特别是在PD-L1阳性、CPS≥5的人群中,两组的中位OS时间分别为10.4个月和8.3个月(HR=0.72,P=0.02),提示帕博利珠单抗二线治疗可延长PD-L1阳性胃癌患者的总生存时间。目前美国NCCN指南根据两项单队列研究仅推荐在错配修复基因缺失(dMMR)或MSI-H这一特定类型的转移性胃癌患者的二线及以后的治疗中可以使用帕博利珠单抗[26, 27]。
各指南对二线治疗药物的推荐略有不同。NCCN推荐雷莫芦单抗+紫杉醇、单药紫杉类、伊立替康、雷莫芦单抗,ESMO对于体力状况评分0~1分的患者,推荐使用紫杉烷(多西他赛、紫杉醇)或伊立替康,或雷莫芦单抗单药,或雷莫芦单抗与紫杉醇联合治疗[28]。日本指南建议在无法使用紫杉醇+雷莫芦单抗时,单独应用紫杉醇、多西他赛、伊立替康、雷莫芦单抗,可作为附加条件推荐方案;不能使用紫杉醇可选择白蛋白结合型紫杉醇。韩国推荐雷莫芦单抗联合紫杉醇、单药紫杉类、伊立替康、雷莫芦单抗。而我国CSCO指南仅推荐单药紫杉类、伊立替康,特别ECOG=2的患者,仅推荐紫杉醇单药治疗,在中国胃癌二线治疗常规不推荐免疫治疗,仅用于dMMR/MSI-H患者;而其他的靶向药物或免疫治疗方案仍在不断的探索中。
1.化疗药物:包括曲氟尿苷替匹嘧啶片(TAS-102)。目前各大指南均认为:因为三线化疗仅涉及小样本研究,获益不明确,应综合治疗风险和利益,考虑单药化疗(3类证据),如果没有在早期的治疗中使用伊立替康或紫杉醇,三线仍可选择。日本的TAGS研究入选了507例既往接受过≥2线的全身化疗胃腺癌和胃食管结合部腺癌患者,随机分为TAS-102单药组和安慰剂组,结果显示,TAS-102组患者的OS时间、有效率、DCR显著高于安慰剂组(OS时间:5.7比3.6个月,ORR:4%比2%,DCR:44%比14%)[29]。基于TAGS和EPOC1201研究[29, 30],NCCN胃癌指南已在2019年将TAS-102列为转移性胃癌后线治疗的标准方案。
2.抗血管生成药物:Li等[31]在2014年ASCO报道了阿帕替尼用于治疗二线标准化疗失败的晚期胃癌患者的Ⅲ期临床研究,结果显示,阿帕替尼组与安慰剂组的ORR率分别为2.84%和0;中位OS时间和PFS时间均明显延长。这是中国自主研发药物中第一个在胃癌治疗中获得成功的小分子靶向药物,因此CSCO胃癌指南将阿帕替尼作为三线治疗推荐选择。
3.免疫检查点抑制剂:ATTRACTION-2和KEYNOTE-059研究已证实纳武利尤单抗和帕博利珠单抗是晚期胃癌三线及以后治疗中的一个选择[32, 33]。2017年FDA接连批准了其在治疗晚期胃癌三线治疗的适应证,纳武利尤单抗的适应证不论PD-L1状态,而帕博利珠单抗的适应证则需PD-L1 CPS评分≥1。目前,纳武利尤单抗、帕博利珠单抗和TAS-102可作为胃癌三线及后续治疗的选择。
4.联合治疗方案:2019年ASCO报道了来自日本的一项ⅠB期研究[34],方案为纳武利尤单抗联合瑞戈非尼,胃癌组均为MSS型,三线及更后线治疗的ORR高达44%,2020年ASCO GI更新数据显示,中位PFS时间为5.6个月,中位OS时间为12.8个月。该数据超过既往胃癌三线治疗的临床试验数据,特别是该方案不必局限于dMMR/MSI-H和PD-L1表达阳性的患者。另一项免疫治疗联合抗血管治疗的小样本Ⅱ期临床研究显示[35],帕博利珠单抗联合仑伐替尼在胃癌一二线治疗中,ORR达到了69%,DCR达100%,即使在PD-L1 CPS<1的患者中,ORR也达到了40%。这为胃癌后线治疗提供了联合用药的思路,但毕竟是小样本研究的探索,临床应用仍需谨慎,还需要在更大队列的Ⅲ期随机对照研究中进一步验证。还有很多新药正在胃癌治疗中进行探索,例如STAT3抑制剂Napabucasin(NAPA,代号:BBI608)、Smo抑制剂GDC-0499、针对CLDN18.2靶向药Zolbetuximab、PARB抑制剂Pamiparib、组蛋白脱乙酰基酶抑制剂伏立诺他(Vorinostat)等。胃癌二三线治疗推荐药物详见表1。
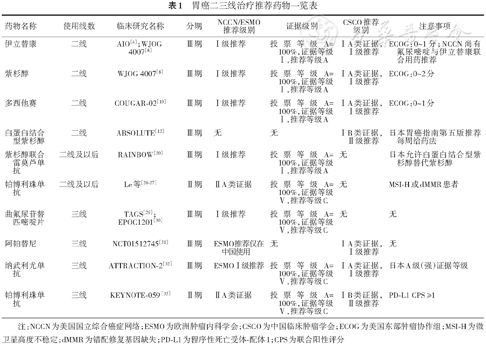
胃癌二三线治疗推荐药物一览表
胃癌二三线治疗推荐药物一览表
| 药物名称 | 使用线数 | 临床研究名称 | 分期 | NCCN/ESMO 推荐级别 | 证据级别 | CSCO推荐级别 | 注意事项 |
|---|---|---|---|---|---|---|---|
| 伊立替康 | 二线 | AIO[4];WJOG 4007[8] | Ⅲ期 | Ⅰ级推荐 | 投票等级A=100%,证据等级Ⅰ,推荐等级A | ⅠA类证据,Ⅰ级推荐 | ECOG:0~1分;NCCN尚有氟尿嘧啶与伊立替康联合用药推荐 |
| 紫杉醇 | 二线 | WJOG 4007[8] | Ⅲ期 | Ⅰ级推荐 | 投票等级A=100%,证据等级Ⅰ,推荐等级A | ⅠA类证据,Ⅰ级推荐 | ECOG:0~2分 |
| 多西他赛 | 二线 | COUGAR‑02[10] | Ⅲ期 | Ⅰ级推荐 | 投票等级A=100%,证据等级Ⅰ,推荐等级A | ⅠA类证据,Ⅰ级推荐 | ECOG:0~1分 |
| 白蛋白结合型紫杉醇 | 二线 | ABSOLUTE[12] | Ⅲ期 | 无 | 无 | ⅠB类证据,Ⅱ级推荐 | 日本胃癌指南第五版推荐每周给药法 |
| 紫杉醇联合雷莫芦单抗 | 二线及以后 | RAINBOW[20] | Ⅲ期 | Ⅰ级推荐 | 投票等级A=100%,证据等级Ⅰ,推荐等级A | 无 | 日本允许白蛋白结合型紫杉醇替代紫杉醇 |
| 帕博利珠单抗 | 二线及以后 | Le等[26‑27] | Ⅱ期 | ⅡA类证据 | 投票等级A=100%,证据等级Ⅴ,推荐等级C | 无 | MSI‑H或dMMR患者 |
| 曲氟尿苷替匹嘧啶片 | 三线 | TAGS[29];EPOC1201[30] | Ⅲ期 | Ⅰ级推荐 | 投票等级A=100%,证据等级Ⅴ,推荐等级C | 无 | 无 |
| 阿帕替尼 | 三线 | NCT01512745[31] | Ⅲ期 | ESMO推荐仅在中国使用 | 无 | ⅠA类证据,Ⅰ级推荐 | 无 |
| 纳武利尤单抗 | 三线 | ATTRACTION‑2[32] | Ⅲ期 | ESMOⅠ级推荐 | 投票等级A=100%,证据等级Ⅴ,推荐等级C | ⅠA类证据,Ⅰ级推荐 | 日本A级(强)证据等级 |
| 帕博利珠单抗 | 三线 | KEYNOTE‑059 [33] | Ⅱ期 | ⅡA类证据 | 投票等级A=100%,证据等级Ⅴ,推荐等级C | ⅠB类证据,Ⅱ级推荐 | PD‑L1 CPS ≥1 |
注:NCCN为美国国立综合癌症网络;ESMO为欧洲肿瘤内科学会;CSCO为中国临床肿瘤学会;ECOG为美国东部肿瘤协作组;MSI-H为微卫星高度不稳定;dMMR为错配修复基因缺失;PD-L1为程序性死亡受体-配体1;CPS为联合阳性评分
与BSC相比,伊立替康,紫杉醇和雷莫芦单抗能够提高胃癌二线生存获益,新兴药物研发已经从针对单一瘤种转为面向生物标志物的个体化研究;针对胃癌二线治疗的伞式试验——韩国VIKTORY试验显示,105例接受生物标志物指导下药物治疗的患者有较好的治疗反应和显著改善的生存结局[36]。未来分子靶向药物的临床试验更加专注于针对特定的患者亚群进行,将通过最大限度地提高药物疗效并最小化不良反应来提高晚期胃癌患者的整体治疗质量。而现有的试验已经证实胃癌的免疫治疗单药疗效有限,何种人群能够获益、如何与其他治疗手段联合也是未来研究必须明确的问题。
所有作者均声明不存在利益冲突



























