
比较介入和外科两种治疗方式对心脏瓣膜替换术后瓣周漏的治疗效果。
采用回顾性分析筛选自2016年1月至2019年12月在北京安贞医院因心脏瓣膜替换术后瓣周漏接受介入或外科治疗患者,对两组治疗效果以及治疗成本进行比较分析。
连续141例患者纳入本研究,其中介入组65例患者年龄大于外科组的76例患者[(56.8±12.8)岁比(50.1±12.8)岁,t=-3.124,P=0.002]。外科组的手术成功率更高[83.1% 比 98.7%(χ²=10.960,P<0.001)],残余分流的发生率更低(33.3%比13.3%,χ²=-2.525,P=0.012),而手术时间[(93±38)min比(395±132)min,t=19.065,P<0.001],重症监护病房(ICU)使用时间[0 h比 28 (21,74) h,Z=-10.738,P<0.001],住院时间[7(4,10)d 比21(15,25)d,Z=-8.075,P<0.001],以及住院总费用[46 073(36 837,52 448)元 比 130 798(104 048,186 188)元,Z=-10.059,P<0.001]介入组更具优势。对数据资料矫正后,介入组和外科组30 d死亡率方面差异无统计学意义。在中位21(11.5,32.0)个月的随访后,全因死亡风险介入组优于外科组(OR=0.054,95%CI:0.007~0.445,P=0.007)。
介入和外科两种治疗方式均是瓣周漏的有效治疗手段,外科治疗的即刻效果更好,而介入治疗中期效果更令人满意,且能减少医疗费用。

瓣周漏是外科心脏瓣膜替换术后较常见的并发症,发生率为2.3%~5.0%[1, 2]。对于合并溶血和(或)心衰的瓣周漏需要积极处理,外科手术仍然是治疗瓣周漏的金标准,但是再次外科手术技术难度和手术风险均较高,而瓣周漏的介入治疗近年来在国外成熟开展且效果确切[3, 4, 5],并被2017年更新的美国心脏协会(AHA)/美国心脏病学学会(ACC)心脏瓣膜管理指南列为Ⅱa级推荐[6]。瓣周漏的介入治疗在我国虽然起步较晚,总完成例次较少,然而近来逐步成为结构性心脏病的一个新的治疗热点[7, 8],但目前国内瓣周漏两种治疗方案的效果、风险及成本比较数据依然相当匮乏。本研究旨在分析应用外科或介入治疗瓣周漏的单中心数据,比较两种治疗方案的效果,为临床应用提供科学依据。
1.研究对象:北京安贞医院于2015年下半年开展瓣周漏介入治疗,因此在本院统计室筛选自2016年1月至2019年12月因心脏瓣膜替换术后瓣周漏接受介入或外科治疗的连续141例患者资料并进行回顾性研究,本研究符合《赫尔辛基宣言》有关伦理学要求。瓣周漏干预治疗指征为:(1)中等量以上瓣周反流;(2)纽约心脏协会(NYHA)心功能分级Ⅲ或Ⅳ级和(或)发生溶血性贫血。数据收集与随访:根据统计室筛选资料查阅电子病历,收集患者住院期间的基线资料、介入或外科手术数据以及结果资料。根据定期门诊随访病历以及定期电话随访,获得随访期间患者的相应资料,内容包括患者有无死亡、NYHA心功能分级、有无输血、有无因心力衰竭住院以及有无再次接受心脏外科或心导管介入治疗。
2.瓣周漏介入及外科治疗技术:介入手术于局部麻醉下在导管室进行,术中利用数字减影血管造影(DSA)透视及经胸超声心动图监测进行评估。主动脉瓣周漏主要应用经股动脉逆行入路完成,少数采用经肱动脉入路完成。二尖瓣瓣周漏根据解剖位置不同,选择经股动脉逆行入路或穿刺房间隔建立动静脉轨道两种方式完成。封堵器根据超声评估结果选择不同类型的Amplatzer型封堵器,包括室间隔缺损封堵器,动脉导管未闭封堵器及血管塞。具体手术细节在相关文献报道[9, 10, 11]。外科手术治疗瓣周漏均采用正开胸标准术式,对于人工瓣膜条件良好、且瓣周漏不大的患者采用直接修补术;对于瓣周漏较大、人工瓣膜撕脱以及瓣膜条件不佳的患者则采用再次瓣膜替换术。
3.观察指标:主要观察指标:(1)技术成功:介入治疗技术成功定义为封堵器成功植入,输送系统成功撤出,无干扰瓣叶及重要血管分支血流,无术中转外科治疗或发生非计划性其他介入治疗,无围手术期死亡。外科治疗技术成功定义为瓣周漏矫治成功,无围手术期死亡或围手术期二次手术。(2)临床成功:定义为瓣周反流量较前下降至少1级,心功能改善至少1级,溶血性贫血患者无输血指征,无30 d心血管相关死亡。次要观察指标为医疗资源使用情况包括手术时间、重症监护病房(ICU)使用时间、总住院时间及总住院费用等。
4.统计学处理:所有数据采用SPSS 20.0软件进行统计分析。符合正态性分布计量资料用表示,组间比较采用独立样本的t检验,不符合正态分布的计量资料用M(Q1,Q3)表示,组间比较用秩和检验。计数资料以频数和率或构成比表示,组间比较采用χ2检验或Fisher精确概率法检验,等级资料应用秩和检验。采用logistic回归对资料进行矫正,将单因素分析中P<0.05的变量纳入多因素分析,对矫正后的资料进行30 d死亡率及全因死亡率进行分析。随访期生存率采用Kaplan-Meier生存分析曲线。采用双侧检验,检验水准α=0.05。
1.基线资料:141例患者年龄(53.2±13.2)岁,男99例(70.2%),女42例(29.8%)。介入治疗65例(46.1%),外科治疗76例(53.9%)。瓣周漏的受累瓣膜以单纯二尖瓣受累居多,共85例(60.3%)。在患者心功能分级及瓣周漏所致的临床症状方面,两组患者差异均无统计学意义。而介入组患者年龄(56.8±12.8)岁,高于外科组的(50.1±12.8)岁(t=-3.124,P=0.002),介入组男性患者比例略少于外科组[61.5%(40例)比77.6%(59例),χ2=4.339,P=0.037]。合并症方面,介入组白塞综合征或感染性心内膜炎的患者均少于外科组[分别为1.5%(1例) 比 13.2%(10例)、3.1%(2例)比13.2%(10例),χ2=6.576、4.573,均P<0.05)]。两组基线资料见表1。
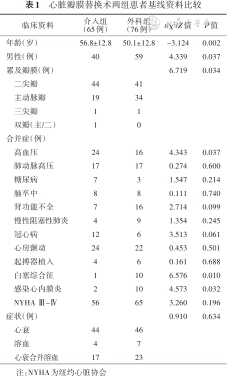
心脏瓣膜替换术两组患者基线资料比较
心脏瓣膜替换术两组患者基线资料比较
| 临床资料 | 介入组(65例) | 外科组(76例) | t/χ2/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 56.8±12.8 | 50.1±12.8 | -3.124 | 0.002 |
| 男性(例) | 40 | 59 | 4.339 | 0.037 |
| 累及瓣膜(例) | 6.719 | 0.034 | ||
二尖瓣 | 44 | 41 | ||
主动脉瓣 | 19 | 34 | ||
三尖瓣 | 1 | 1 | ||
双瓣(主/二) | 1 | 0 | ||
| 合并症(例) | ||||
高血压 | 24 | 16 | 4.343 | 0.037 |
肺动脉高压 | 17 | 17 | 0.274 | 0.600 |
糖尿病 | 7 | 3 | 1.547 | 0.214 |
脑卒中 | 8 | 8 | 0.111 | 0.740 |
肾功能不全 | 7 | 16 | 2.714 | 0.099 |
慢性阻塞性肺炎 | 4 | 9 | 1.354 | 0.245 |
冠心病 | 12 | 6 | 3.513 | 0.061 |
心房颤动 | 24 | 22 | 0.453 | 0.501 |
起搏器植入 | 4 | 6 | 0.161 | 0.688 |
白塞综合征 | 1 | 10 | 6.576 | 0.010 |
感染心内膜炎 | 2 | 10 | 4.573 | 0.032 |
NYHA Ⅲ~Ⅳ | 56 | 65 | 3.260 | 0.196 |
| 症状(例) | 0.910 | 0.634 | ||
心衰 | 44 | 46 | ||
溶血 | 4 | 7 | ||
心衰合并溶血 | 17 | 23 |
注:NYHA为纽约心脏协会
2.治疗结果:治疗结果见表2,共有129例患者成功完成手术,介入组技术成功率83.1%(54/65),外科组技术成功率(更高)98.7%(75/76)(χ2=10.960,P<0.001),外科组1例患者发生手术相关死亡;介入组11例患者未实现技术成功标准,其中4例选择外科治疗,7例选择保守观察。技术成功后瓣周残余分流量的改善情况同样也是外科组更佳(无残余分流:66.7% 比 86.7%,χ2=-2.525,P=0.012)。由于介入治疗微创,应用局部麻醉等优点,在治疗的医疗成本使用方面,无论是手术时间、ICU的使用时间还是总住院时间,介入组都具有明显优势,手术时间:(93±38) min比(395±132) min,t=19.065,P<0.001; ICU用时:0 h比 28 (21,74)h,Z=-10.738,P<0.001;总住院天数7 (4,10) d 比 21 (15,25)d,Z=-8.075,P<0.001。同样,总住院费用也是介入组更少[46 073(36 837,52 448)元比130 798(104 048,186 188)元,Z=-10.059,P<0.001]。
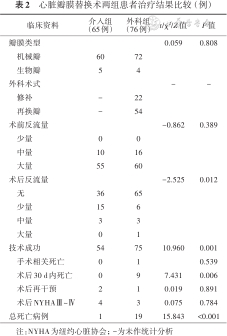
心脏瓣膜替换术两组患者治疗结果比较 (例)
心脏瓣膜替换术两组患者治疗结果比较 (例)
| 临床资料 | 介入组(65例) | 外科组(76例) | t/χ2/Z值 | P值 |
|---|---|---|---|---|
| 瓣膜类型 | 0.059 | 0.808 | ||
机械瓣 | 60 | 72 | ||
生物瓣 | 5 | 4 | ||
| 外科术式 | - | - | ||
修补 | - | 22 | ||
再换瓣 | - | 54 | ||
| 术前反流量 | -0.862 | 0.389 | ||
少量 | 0 | 0 | ||
中量 | 10 | 16 | ||
大量 | 55 | 60 | ||
| 术后反流量 | -2.525 | 0.012 | ||
无 | 36 | 65 | ||
少量 | 15 | 6 | ||
中量 | 3 | 3 | ||
大量 | 0 | 1 | ||
| 技术成功 | 54 | 75 | 10.960 | 0.001 |
手术相关死亡 | 0 | 1 | 0.539 | |
术后30 d内死亡 | 0 | 9 | 7.431 | 0.006 |
术后再干预 | 2 | 1 | 0.019 | 0.891 |
术后NYHAⅢ~Ⅳ | 4 | 3 | 0.075 | 0.784 |
| 总死亡病例 | 1 | 19 | 15.843 | <0.001 |
注:NYHA为纽约心脏协会; -为未作统计分析
尽管术后30 d死亡率介入组低于外科组(0比11.8%,χ²=6.460,P=0.006),然而对两组患者基线资料进行矫正后,仅有术前合并慢阻肺[OR:9.848,95%置信区间(CI):1.160~83.569,P=0.036]或感染性心内膜炎(OR:20.163,95%CI:1.227~331.440,P=0.035)是患者术后30 d死亡的预测指标,数据矫正后两种不同的治疗手段对30 d死亡率差异无统计学意义,见表3。术后1年内,有2例介入患者由于瓣周漏进展导致溶血或心衰加重,再次成功完成介入治疗,1例外科纠正成功患者术后再发瓣周漏,选择介入治疗并获得成功,再干预率方面两组差异无统计学意义(3.1% 比 1.3%,χ²=0.019,P=0.891)。
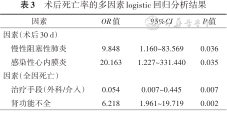
术后死亡率的多因素logistic回归分析结果
术后死亡率的多因素logistic回归分析结果
| 因素 | OR值 | 95%CI | P值 |
|---|---|---|---|
| 因素(术后30 d) | |||
慢性阻塞性肺炎 | 9.848 | 1.160~83.569 | 0.036 |
感染性心内膜炎 | 20.163 | 1.227~331.440 | 0.035 |
| 因素(全因死亡) | |||
治疗手段(外科/介入) | 0.054 | 0.007~0.445 | 0.007 |
肾功能不全 | 6.218 | 1.961~19.719 | 0.002 |
3.随访结果:中位21(11.5,32.0)个月随访期内两组患者心功能NYHA Ⅲ级以上患者均较术前减少,两组间比较差异无统计学意义。随访期内介入组死亡1例,外科组死亡9例,介入组随访期内全因死亡风险优于外科组(OR:0.054,95%CI:0.007~0.445,P=0.007),Kaplan-Meier生存分析曲线见图1。而肾功能不全则是中期死亡风险的一项重要预测指标(OR:4.918,95%CI:1.261~19.179,P=0.002)。见表3。


瓣周漏是心脏瓣膜替换术后常见的并发症,严重的瓣周漏会导致心衰或溶血等临床症状,影响长期预后,因此需积极治疗。许多研究从不同角度论证了瓣周漏介入或外科治疗的效果,但是临床上如何选择治疗策略,其相关的数据依然非常匮乏。本研究对本院近4年来瓣周漏介入和外科治疗的患者进行比较分析,得出如下几点临床提示:(1)介入与外科均能有效治疗瓣周漏,外科治疗残余漏发生率更低,而介入治疗简便易行,能够最大化地节约医疗成本与病患负担;(2)数据矫正后,两种治疗方式在术后30 d死亡风险差异无统计学意义,30 d死亡仅与合并慢阻肺及是否发生过感染性心内膜炎有关,因此对瓣周漏进行干预时应重视患者基础疾病;(3)两种治疗方式中,介入治疗的中期死亡风险低于外科治疗,而是否合并肾功能不全是中期死亡的另一项重要预测指标。
尽管不同的研究肯定了介入技术在瓣周漏治疗领域的地位,但将介入治疗与外科进行效果及成本比较的研究,特别是样本量超过100例的研究仍然非常少。本研究将治疗结果与医疗成本共同纳入比较,与诸多研究存在共同认识又有不同点。首先,由于外科手术是在直视下进行修补或再换瓣,因此外科组技术成功率更高(98.7%),术后残余分流发生率更低(13.3%),多项不同的研究均肯定了这一点 [12, 13, 14]。介入治疗技术成功率低的主要原因是瓣周漏的介入治疗操作复杂,学习曲线较长,此外目前缺乏瓣周漏封堵专用器械,常需一些技术补充[15],因此解释了瓣周漏封堵残余分流的发生率明显高于其他结构性心脏病封堵的原因[16]。同时本研究也进一步明确了相对于外科组,介入组体现出了手术时间、总住院时间以及ICU使用时间更短,总住院费用更低等优势,为该类患者治疗方案的选择提供了临床经济学证据。
其次,本研究外科组30 d死亡率为11.8%,但只有合并慢阻肺以及感染性心内膜炎是30 d死亡的预测指标。分析主要原因为,患者的肺功能状况直接影响外科术后的恢复情况,合并感染性心内膜炎的患者许多需要外科处理,因此初步统计介入组30 d死亡率显著优于外科组,而通过数据矫正后两组差异无统计意义。在一项单中心10年间的比较研究中[17],围手术期死亡率同样是外科组看似更高,但通过数据矫正,两种治疗方案差异并无统计学意义。只有合并感染性心内膜炎、慢性肾功能不全以及严重的瓣环钙化是围手术期死亡的预测因素。
第三,虽然国外的许多研究认为再次外科手术和介入治疗比较长期生存率有差异[17, 18],但本研究认为在中期生存率方面介入治疗依然具有较大优势。介入治疗存在创伤小,无需全身麻醉,无需体外循环等特点,因此在术后恢复及社区医疗管理上具备其特有优势。同时,本研究发现肾功能不全是影响中长期预后的危险因素,Taramasso等[14]在一项最长14年的瓣周漏外科修复随访中同样论证了这一观点。需要重视的是除患者本身存在肾功能基础疾病外,瓣周漏导致的溶血同样会造成肾功能受损,特别是介入治疗的患者残余分流的发生率较高,应提防术后新发溶血或溶血加重。本中心介入治疗患者随访期内术后溶血加重仅1例,可能与样本量小、随访周期短有关。
本研究尚存在一些局限性,作为回顾性分析,且由于瓣周漏治疗的样本量较小,不可避免地存在选择性偏倚。其次,瓣周漏介入治疗在本中心2015年底引入后逐步推广,因此介入患者的时间构成更为偏后,随访周期略短于外科组。未来应组织随机对照试验,更有信度地评价两种治疗方式对于瓣周漏治疗的效果。
总之,无论是外科还是介入治疗均是瓣周漏的有效治疗手段,外科治疗成功率更高,即刻效果更好,而介入治疗中期结果更为满意且医疗成本更低。瓣周漏的患者病情较复杂,术前应详细评估,对于再次外科手术的高危患者,可以首选介入治疗。
所有作者均声明不存在利益冲突



























