
探讨高龄老人血浆尿酸水平对2型糖尿病(T2DM)发病风险的影响。
资料来自老年健康生物标志物队列研究(HABCS),该项目于2008—2009年开展基线调查,于2011—2012年、2014年和2017—2018年进行了3次随访,共2 213名≥80岁高龄老人被纳入本研究。收集对象人口学特征、生活方式和患病情况等资料,并对其进行体格测量,收集空腹静脉血进行尿酸和血糖检测。追踪随访对象糖尿病发病、死亡结局情况。采用 Cox比例风险回归模型探索高尿酸血症和血浆尿酸水平对T2DM发病的影响,采用限制性立方样条(RCS)函数来探索血浆尿酸水平与T2DM发病风险之间的剂量反应关系。
研究对象年龄为(93.2±7.6)岁,女性占66.7%(1 475名)。基线调查时血浆尿酸水平为(289.1 ±88.0)μmol/L,高尿酸血症患病率为13.3%(294例)。9年累积随访7 471人年(人均随访3.38年),T2DM新发病例122例,发病密度为1 632.98/10万人年。Cox比例风险回归分析结果显示,血浆尿酸水平每升高10 μmol/L,T2DM发病风险增加1.1% [HR(95%CI):1.011(1.004,1.017)]。与处于血浆尿酸最低五分位数(Q1)者相比,最高五分位数(Q5)高龄老人T2DM发病风险增加20.7 % [HR(95%CI):1.207(1.029,1.416)]。与血浆尿酸正常者相比,高尿酸血症者T2DM发病风险增加19.2% [HR(95%CI):1.192(1.033,1.377)]。RCS函数显示,随着血浆尿酸水平升高,糖尿病发病风险增加,呈非线性剂量反应关系(P=0.016)。
随着血浆尿酸水平升高高龄老人T2DM发病风险增加。

2型糖尿病(T2DM)是一组以血糖代谢紊乱为特征的慢性疾病,肥胖、年龄、高脂饮食和缺乏体育锻炼为其主要危险因素[1],同时还受遗传和环境因素影响[2]。中国糖尿病患病率已从1980年的0.67%上升至2013年的10.4%[3],其中≥60岁人群T2DM患病率为19.4%[4],发病率为603.11/10万,≥80岁高龄老人的T2DM发病率高达713.85/10万[5]。目前,针对高龄老人T2DM发病的影响因素研究极少,本研究利用老年健康生物标志物队列研究(Healthy Aging and Biomarkers Cohort Study,HABCS)资料,探讨血浆尿酸水平对中国长寿地区高龄老人T2DM发病风险的影响。
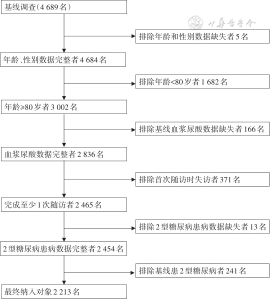
1.资料:源自HABCS,该研究选取中国9个长寿地区,分别为山东省烟台市莱州市、河南省商丘市夏邑县、湖北省荆门市钟祥市、湖南省怀化市麻阳县、广东省佛山市三水区、广西壮族自治区桂林市永福县、 海南省澄迈县、江苏省南通市如东县和四川省都江堰市[6],于2008—2009年开展基线调查,2011—2012、2014和2017—2018年分别进行了3次随访,每次随访均纳入一定数量的新增对象并对其进行基线调查[7]。共4 689名对象完成了基线调查,其中2008—2009、2011—2012和2014年分别为1 852、1 708和1 129名。排除年龄<80岁、年龄、性别、血浆尿酸水平和糖尿病患病情况等任一数据缺失者,最终纳入2 213名≥80岁高龄老人,其中2008—2009、2011—2012和2014年分别纳入756、828和629名(图1)。本研究通过了中国疾病预防控制中心环境与健康相关产品安全所伦理审查委员会审查(批号:201922),所有调查对象均由本人或其家属签署了知情同意书。

2.基线调查:(1)问卷调查:通过面对面调查收集对象人口学特征、生活习惯和健康状况等资料;(2)体格检查:测量对象的身高和体重,计算体质指数(BMI),测量方法及定义详见文献[7];(3)血浆生化指标检测:采集对象5 ml空腹静脉血于肝素抗凝采血管,分离血浆并置-20 ℃保存,由首都医科大学临床检验中心统一检测。采用7180型自动生化仪(日本日立公司),以尿酸酶比色法测定血浆尿酸,以胆固醇氧化酶法测定血浆总胆固醇(TC)、以直接法测定高密度脂蛋白胆固醇(HDL-C),以甘油磷酸氧化酶-过氧化物酶法测定三酰甘油(TG)。
3.随访:对存活对象的随访内容同基线调查;对死亡对象的家属和相关医护人员进行死亡问卷调查,收集死亡者发病结局、死亡日期和死亡原因等信息;对无法联系到本人或其家属者列为失访。
4.相关指标的分类标准:(1)高尿酸血症:正常嘌呤饮食状态下,非同日2次空腹血浆尿酸水平:男性>420 μmol / L,女性>360 μmol / L[8, 9];(2)T2DM:空腹血糖≥7.0 mmol/L或已被医院确诊[3];(3)高血压:收缩压≥140 mmHg(1 mmHg=0.133 kPa),或舒张压≥90 mmHg[10],或已被医院确诊;(4)高胆固醇血症:TC≥6.2 mmol/L;(5)高TG血症:TG≥2.3 mmol/L;(6)低HDL-C血症:HDL-C<1.0 mmol/L[11];(7)其他疾病:经医院确诊的脑卒中及脑血管疾病、心脏病和支气管炎、肺气肿、哮喘病或肺炎等呼吸系统疾病。
5.质量控制:调查前对符合条件的调查人员进行培训;采用统一的标准问卷进行调查;中国(省级)疾病预防控制中心人员对调查工作进行管理和监督,通过随机抽查评价问卷效度和完整性,如有信息缺失或错误则安排补充调查;尿酸和血糖水平等生化指标由专业医务人员按照标准操作流程进行检测;数据实时双录入以确保录入准确性。
6.统计学分析:采用Epidata 3.0 软件录入数据,采用SAS 9.4软件进行统计学分析。采用精确法计算人年。血浆尿酸水平、年龄和受教育年限符合正态分布,以表示,采用t检验比较其在高尿酸血症和正常组的差异。分类变量以频数和比例(率)表示,对二分类变量和等级变量分别采用 χ2检验和Wilcoxon秩和检验比较其在高尿酸血症和正常组的差异。采用Cox比例风险回归模型分析血浆尿酸水平(高尿酸血症)对T2DM发病风险的影响。采用限制性立方样条(Restricted cubic splinc,RCS)曲线分析血浆尿酸水平与T2DM发病风险的剂量反应关系。双侧检验,以P<0.05为差异有统计学意义。
1.基本情况:研究对象年龄为(93.2±7.6)岁,女性占66.7%(1 475名)。血浆尿酸水平为(289.1±88.0)μmol/L,高尿酸血症患病率为13.3%(294例)。9年内共随访7 471人年(人均随访3.38年),T2DM新发病例122例(3次随访新发病例数分别为15、57和50例),发病密度为1 632.98/10万人年,高尿酸血症患病率为13.3%(294例)。高尿酸血症组吸烟率、鱼类、鸡蛋、蔬菜、猪(禽)肉类摄入频率、BMI、高胆固醇血症、心脏病和高TG血症患病率均高于正常组;两组年龄、性别构成、受教育年限、民族、饮酒率、体育锻炼、饮食摄入豆制品频率、高血压、脑血管疾病、肺炎等呼吸系统疾病和低HDL-C血症患病率差异无统计学意义(表1)。
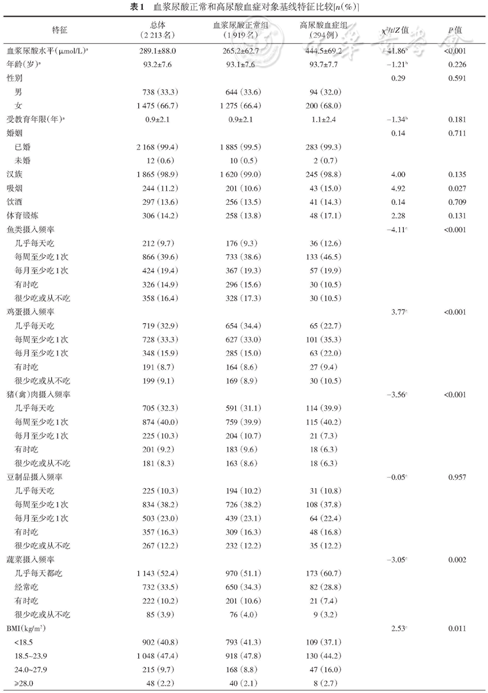
血浆尿酸正常和高尿酸血症对象基线特征比较[n(%)]
血浆尿酸正常和高尿酸血症对象基线特征比较[n(%)]
| 特征 | 总体 (2 213名) | 血浆尿酸正常组 (1 919名) | 高尿酸血症组 (294例) | χ2/t/Z值 | P值 |
|---|---|---|---|---|---|
| 血浆尿酸水平(μmol/L)a | 289.1±88.0 | 265.2±62.7 | 444.5±69.2 | -41.86b | <0.001 |
| 年龄(岁)a | 93.2±7.6 | 93.1±7.6 | 93.7±7.7 | -1.21b | 0.226 |
| 性别 | 0.29 | 0.591 | |||
男 | 738 (33.3) | 644 (33.6) | 94 (32.0) | ||
女 | 1 475 (66.7) | 1 275 (66.4) | 200 (68.0) | ||
| 受教育年限(年)a | 0.9±2.1 | 0.9±2.1 | 1.1±2.4 | -1.34b | 0.181 |
婚姻 | 0.14 | 0.711 | |||
已婚 | 2 168 (99.4) | 1 885 (99.5) | 283 (99.3) | ||
| 未婚 | 12 (0.6) | 10 (0.5) | 2 (0.7) | ||
| 汉族 | 1 865 (98.9) | 1 620 (99.0) | 245 (98.8) | 4.00 | 0.135 |
| 吸烟 | 244 (11.2) | 201 (10.6) | 43 (15.0) | 4.92 | 0.027 |
| 饮酒 | 297 (13.6) | 256 (13.5) | 41 (14.3) | 0.14 | 0.709 |
| 体育锻炼 | 306 (14.2) | 258 (13.8) | 48 (17.1) | 2.28 | 0.131 |
| 鱼类摄入频率 | -4.11c | <0.001 | |||
几乎每天吃 | 212 (9.7) | 176 (9.3) | 36 (12.6) | ||
每周至少吃1次 | 866 (39.6) | 733 (38.6) | 133 (46.5) | ||
每月至少吃1次 | 424 (19.4) | 367 (19.3) | 57 (19.9) | ||
有时吃 | 326 (14.9) | 296 (15.6) | 30 (10.5) | ||
很少吃或从不吃 | 358 (16.4) | 328 (17.3) | 30 (10.5) | ||
| 鸡蛋摄入频率 | 3.77c | <0.001 | |||
几乎每天吃 | 719 (32.9) | 654 (34.4) | 65 (22.7) | ||
每周至少吃1次 | 728 (33.3) | 627 (33.0) | 101 (35.3) | ||
每月至少吃1次 | 348 (15.9) | 285 (15.0) | 63 (22.0) | ||
有时吃 | 191 (8.7) | 164 (8.6) | 27 (9.4) | ||
很少吃或从不吃 | 199 (9.1) | 169 (8.9) | 30 (10.5) | ||
| 猪(禽)肉摄入频率 | -3.56c | <0.001 | |||
几乎每天吃 | 705 (32.3) | 591 (31.1) | 114 (39.9) | ||
每周至少吃1次 | 874 (40.0) | 759 (39.9) | 115 (40.2) | ||
每月至少吃1次 | 225 (10.3) | 204 (10.7) | 21 (7.3) | ||
有时吃 | 201 (9.2) | 183 (9.6) | 18 (6.3) | ||
很少吃或从不吃 | 181 (8.3) | 163 (8.6) | 18 (6.3) | ||
| 豆制品摄入频率 | -0.05c | 0.957 | |||
几乎每天吃 | 225 (10.3) | 194 (10.2) | 31 (10.8) | ||
每周至少吃1次 | 834 (38.2) | 726 (38.2) | 108 (37.8) | ||
每月至少吃1次 | 503 (23.0) | 439 (23.1) | 64 (22.4) | ||
有时吃 | 357 (16.3) | 309 (16.3) | 48 (16.8) | ||
很少吃或从不吃 | 267 (12.2) | 232 (12.2) | 35 (12.2) | ||
| 蔬菜摄入频率 | -3.05c | 0.002 | |||
几乎每天都吃 | 1 143 (52.4) | 970 (51.1) | 173 (60.7) | ||
经常吃 | 732 (33.5) | 650 (34.3) | 82 (28.8) | ||
有时吃 | 222 (10.2) | 201 (10.6) | 21 (7.4) | ||
很少吃或从不吃 | 85 (3.9) | 76 (4.0) | 9 (3.2) | ||
| BMI(kg/m2) | 2.53c | 0.011 | |||
<18.5 | 902 (40.8) | 793 (41.3) | 109 (37.1) | ||
18.5~23.9 | 1 048 (47.4) | 918 (47.8) | 130 (44.2) | ||
24.0~27.9 | 215 (9.7) | 168 (8.8) | 47 (16.0) | ||
≥28.0 | 48 (2.2) | 40 (2.1) | 8 (2.7) | ||
| 低HDL-C血症 | 417 (18.8) | 355 (18.5) | 62 (21.1) | 1.12 | 0.290 |
| 高胆固醇血症 | 87 (3.9) | 66 (3.4) | 21 (7.1) | 9.26 | 0.002 |
| 高TG血症 | 120 (5.4) | 92 (4.8) | 28 (9.5) | 11.12 | 0.001 |
| 高血压 | 1 284 (58.1) | 1 104 (57.7) | 180 (61.2) | 1.34 | 0.247 |
| 脑血管疾病 | 127 (5.9) | 105 (5.6) | 22 (7.7) | 1.90 | 0.166 |
| 肺炎等呼吸系统疾病 | 165 (7.6) | 142 (7.6) | 23 (8.0) | 0.06 | 0.806 |
| 心脏病 | 124 (5.8) | 100 (5.3) | 24 (8.4) | 4.31 | 0.038 |
| 糖尿病 | 122 (5.5) | 107 (5.6) | 15 (5.1) | 1.86 | 0.394 |
注:a;bt值;cZ值;BMI:体质指数;HDL-C:高密度脂蛋白胆固醇;TG:三酰甘油
2.血浆尿酸与T2DM发病的关联关系:Cox比例风险回归模型分析显示:完全调整模型(模型3)调整年龄、性别、婚姻状况、民族、受教育年限、体育锻炼、吸烟、饮酒、鱼类、鸡蛋、豆制品、猪(禽)肉和蔬菜摄入频率、BMI、低HDL-C血症、高TG血症、高胆固醇血症、高血压、心脏病、脑血管疾病和呼吸系统疾病等因素后,尿酸每升高10 μmol/L,T2DM发病风险增加1.1% [HR(95%CI):1.011(1.004,1.017)];与尿酸正常者相比,高尿酸血症对象T2DM发病风险增加19.2% [HR(95%CI):1.192(1.033,1.377)];与尿酸水平最低五分位数组相比,最高五分位数组T2DM发病风险升高20.7 % [HR(95%CI):1.207(1.029,1.416)](表2)。
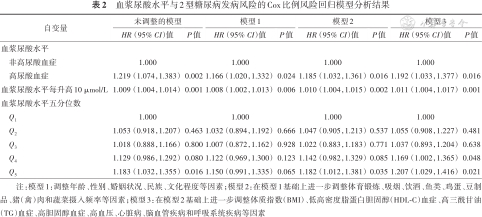
血浆尿酸水平与2型糖尿病发病风险的Cox比例风险回归模型分析结果
血浆尿酸水平与2型糖尿病发病风险的Cox比例风险回归模型分析结果
| 自变量 | 未调整的模型 | 模型1 | 模型2 | 模型3 | ||||
|---|---|---|---|---|---|---|---|---|
| HR (95% CI)值 | P值 | HR (95% CI)值 | P值 | HR (95% CI)值 | P值 | HR (95% CI)值 | P值 | |
| 血浆尿酸水平 | ||||||||
非高尿酸血症 | 1.000 | 1.000 | 1.000 | 1.000 | ||||
高尿酸血症 | 1.219 (1.074,1.383) | 0.002 | 1.166 (1.020,1.332) | 0.024 | 1.185 (1.032,1.361) | 0.016 | 1.192 (1.033,1.377) | 0.016 |
| 血浆尿酸水平每升高10 μmol/L | 1.009 (1.004,1.014) | 0.001 | 1.008 (1.002,1.013) | 0.006 | 1.010 (1.004,1.015) | 0.002 | 1.011 (1.004,1.017) | 0.001 |
| 血浆尿酸水平五分位数 | ||||||||
Q1 | 1.000 | 1.000 | 1.000 | 1.000 | ||||
Q2 | 1.053 (0.918,1.207) | 0.463 | 1.032 (0.894,1.192) | 0.666 | 1.047 (0.905,1.213) | 0.537 | 1.055 (0.908,1.227) | 0.481 |
Q3 | 1.018 (0.888,1.166) | 0.800 | 1.007 (0.872,1.162) | 0.928 | 1.022 (0.883,1.183) | 0.771 | 1.037 (0.893,1.204) | 0.638 |
Q4 | 1.129 (0.986,1.292) | 0.080 | 1.122 (0.969,1.300) | 0.123 | 1.142 (0.982,1.329) | 0.085 | 1.169 (1.002,1.365) | 0.048 |
Q5 | 1.183 (1.032,1.355) | 0.016 | 1.150 (0.991,1.335) | 0.065 | 1.182 (1.012,1.381) | 0.035 | 1.207 (1.029,1.416) | 0.021 |
注:模型1:调整年龄、性别、婚姻状况、民族、文化程度等因素;模型2:在模型1基础上进一步调整体育锻炼、吸烟、饮酒、鱼类、鸡蛋、豆制品、猪(禽)肉和蔬菜摄入频率等因素;模型3:在模型2基础上进一步调整体质指数(BMI)、低高密度脂蛋白胆固醇(HDL-C)血症、高三酰甘油(TG)血症、高胆固醇血症、高血压、心脏病、脑血管疾病和呼吸系统疾病等因素
3.血浆尿酸水平与T2DM发病风险的剂量反应关系:RCS曲线显示(图 2A):血浆尿酸水平与糖尿病发病风险呈非线性剂量反应关系(P=0.016)。以血浆尿酸水平M(276.0 μmol/L)为参照,P95水平(451.3 μmol/L)T2DM发病风险增加35.2% [HR(95%CI):1.352(1.161,1.575)]。按性别分组后RCS曲线显示:血浆尿酸水平与T2DM发病风险在男性中不存在剂量反应关系(P=0.333)(图2B);在女性中呈非线性剂量反应关系(P=0.006)(图 2C),与血浆尿酸水平M(259.0 μmol/L)相比,P95水平(424.8 μmol/L)T2DM发病风险增加42.9%[HR(95%CI):1.429(1.203,1.698)]。
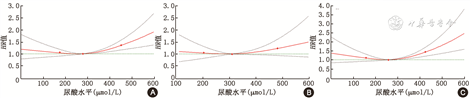

注:A为总体,B为男性,C为女性;红色实线为HR估计值;黑色虚线为95% CI值;绿色虚线为参考值;红色节点值(μmol/L)由小到大依次为169.6、276.0和451.3(2A),198.0、310.4和489.0(2B),162.3、259.0和424.8(2C);模型调整了年龄、性别、婚姻状况、民族、受教育年限、体育锻炼、吸烟、饮酒、鱼类、鸡蛋、豆制品、猪(禽)肉和蔬菜摄入频率、体质指数(BMI)、低HDL-C血症、高TG血症、高胆固醇血症、高血压、心脏病、脑血管疾病和呼吸系统疾病等因素
国际糖尿病联盟数据显示:2019年中国糖尿病患者人数为1.164亿例,预计2030年将达到1.405 亿例[12]。2019年中国糖尿病相关卫生达1 090亿美元[12],造成严重的公共卫生负担[13, 14]。
Bhole等[15]对5~70岁人群的队列研究显示,T2DM发病率随血浆尿酸水平的升高而增加。Liu等[16]发现:血浆尿酸水平升高≥30%者与正常人群相比,T2DM发病风险升高71%。Krishnan等[17]对18~30岁居民的随访显示:与血浆尿酸正常组相比,高尿酸血症组T2DM发病风险升高87%,但Sun等[18] 对10~15岁青少年进行的队列研究显示血浆尿酸水平对T2DM的发病风险无影响。目前尚无循证医学证据表明高尿酸血症是T2DM发病的独立危险因素。本研究显示血浆尿酸水平升高的高龄老人T2DM发病风险增加,其机制可能为:(1)高龄老人多具有代谢综合征,此时尿酸会成为一种强氧化剂[19],使代谢综合征进一步恶化,代谢综合征和高尿酸血症引起的炎症和氧化应激可能使个体易患T2DM[20];(2)尿酸刺激血管平滑肌增殖,减少内皮一氧化氮的产生,从而导致内皮功能障碍和胰岛素抵抗[21, 22, 23],同时尿酸会引起血管炎症和动脉损伤[21,24],增加T2DM和动脉粥样硬化风险[25, 26];(3)尿酸与肾小球压力升高和肾内钠重吸收增高有关,而这些肾脏反应在高胰岛素浓度下大大增强[27, 28],胰岛素抵抗和高尿酸血症对肾功能的联合作用可能导致葡萄糖耐受不良、高血压和糖尿病风险的增加。
本研究的优点在于:(1)本研究为队列研究,检验因果的能力较强;(2)血浆尿酸和血糖由专业医务人员按照标准操作流程检测,真实性好;(3)样本量较大,为探索易于监测且易于干预的影响高龄老人T2DM的生物标志物提供了线索。本研究的局限性在于:(1)血浆尿酸为动态变化指标,仅使用基线数据存在一定的信息偏倚;(2)研究对象仅为我国长寿地区的≥80岁高龄老人,代表性受到一定影响;(3)未考虑对象服用降尿酸、降糖和降脂药物的情况;(4)未调整潜在的混杂因素(如基因等遗传学因素),影响结论的真实性。
所有参加HABCS队列项目的成员和参与项目现场调查以及管理的工作人员
所有作者均声明不存在利益冲突



























