本指南由肾脏病和血液净化专家组成的编写委员会共同编写,系统介绍了肾性贫血的病因与发病机制、诊断与病情评估、治疗原则、靶目标与具体方案、治疗低反应性以及特殊肾脏疾病患者贫血诊疗。本指南针对如何规范诊断肾性贫血,红细胞生成刺激剂(ESAs)应用的时机和靶目标,如何评估铁状态以及铁剂应用的时机和靶目标,非透析、血液透析和腹膜透析患者贫血治疗方案,肾移植、儿童、老年与糖尿病患者的贫血治疗方案,如何规范应用低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)等6个主要临床问题,同时借鉴和参考了目前国内外肾性贫血相关临床指南。目的在于指导、规范肾性贫血的诊断以及ESAs、铁剂和HIF-PHI的合理应用,提高肾性贫血诊疗水平。

肾性贫血是指各种肾脏疾病导致红细胞生成素(erythropoietin,EPO)绝对或相对生成不足,以及尿毒症毒素影响红细胞生成及其寿命而发生的贫血。肾脏疾病合并的炎症反应、继发性甲状旁腺功能亢进等可加重肾性贫血的进展;并且,肾脏疾病患者也可合并营养不良性贫血、溶血性贫血、出血性贫血、地中海贫血、再生障碍性贫血以及血液系统肿瘤等疾病导致的贫血。因此,贫血是肾脏疾病患者常见的临床表现,既是肾脏疾病重要的并发症,也是常见的合并疾病。贫血影响肾脏疾病患者的生活质量[1, 2],增加肾脏疾病进展、终末期肾脏病、心血管事件及死亡的风险[2, 3, 4]。
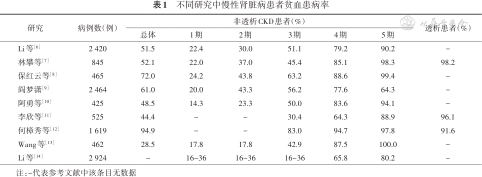
基于中国临床试验数据,慢性肾脏病(chronic kidney disease,CKD)患者贫血患病率显著高于普通人群,2009年上海市浦东新区进行的抽样调查中,3 326例18岁以上社区居民中贫血患病率1.7%,其中532例CKD患者的贫血患病率为3.0%[5];非透析CKD患者总体贫血患病率28.5%~72.0%,并随着 CKD进展而增加,透析患者贫血患病率高达91.6%~98.2%(表1)[6, 7, 8, 9, 10, 11, 12, 13, 14];887例接受活体供肾移植的患者,肾移植1、3、6、12个月贫血患病率分别为84.3%、39.5%、26.2%和21.6%[15]。因此,中国CKD患者贫血的防治任务十分艰巨。
不同研究中慢性肾脏病患者贫血患病率
不同研究中慢性肾脏病患者贫血患病率
| 研究 | 病例数(例) | 非透析CKD患者(%) | 透析患者(%) | |||||
|---|---|---|---|---|---|---|---|---|
| 总体 | 1期 | 2期 | 3期 | 4期 | 5期 | |||
| Li等[6] | 2 420 | 51.5 | 22.4 | 30.0 | 51.1 | 79.2 | 90.2 | - |
| 林攀等[7] | 845 | 52.1 | 22.0 | 37.0 | 45.4 | 85.1 | 98.3 | 98.2 |
| 保红云等[8] | 465 | 72.0 | 24.2 | 43.8 | 63.2 | 88.6 | 99.4 | - |
| 阎梦潇[9] | 2 464 | 61.0 | 20.0 | 43.3 | 56.2 | 77.6 | 64.3 | - |
| 阿勇等[10] | 425 | 48.5 | 14.3 | 23.3 | 50.0 | 83.6 | 94.1 | - |
| 李欣等[11] | 525 | 44.4 | - | - | 30.4 | 64.3 | 88.9 | 96.1 |
| 何樟秀等[12] | 1 619 | 94.9 | - | - | 83.0 | 94.7 | 97.8 | 91.6 |
| Wang等[13] | 462 | 28.5 | 17.8 | 17.8 | 42.9 | 87.5 | 100.0 | - |
| Li等[14] | 2 924 | - | 16~36 | 16~36 | 16~36 | 65.8 | 80.2 | - |
注:-代表参考文献中该条目无数据
针对肾性贫血,2007年中华医学会肾脏病学分会发布《重组人促红细胞生成素在肾性贫血中合理应用的专家共识》[16];2013年中国医师协会肾脏内科医师分会发布《肾性贫血诊断与治疗中国专家共识》[17],并于2014年进行修订[18],2018年中华医学会肾脏病学分会再次进行修订[19]。这些专家共识修订过程中重点更新了治疗时机和肾性贫血治疗靶目标值:2007年提出,若间隔2周或者以上连续2次血红蛋白(hemoglobin,Hb)检测值均<110 g/L,并除外铁缺乏等其他贫血病因,应开始实施重组人EPO(recombinant human erythropoietin,rHuEPO)治疗;Hb治疗靶目标值为Hb ≥110 g/L,但不推荐Hb维持在130 g/L以上。2013年提出,转铁蛋白饱和度(transferrin saturation,TSAT)<20%,非透析和腹膜透析患者血清铁蛋白(serum ferritin,SF)<100 μg/L,血液透析患者SF<200 μg/L;SF在200~500 μg/L和(或)TSAT≤30%时,如Hb有望升高,红细胞生成刺激剂(erythropoiesis-stimulating agents,ESAs)用量有望降低,应给予补铁治疗;并且更新ESAs治疗时机为Hb<100 g/L。2014年更新铁剂治疗指征为TSAT≤30%且SF≤500 μg/L。2018年再次更新铁剂治疗指征为非透析和腹膜透析患者TSAT≤20%和(或)SF≤100 μg/L,血液透析患者TSAT≤20%和(或)SF≤200 μg/L;更新Hb治疗靶目标值为Hb≥115 g/L,但不推荐>130 g/L。此外,2020年中国国家卫生健康委员会颁布的血液净化技术质控指标中,肾性贫血治疗达标标准为Hb≥110 g/L。
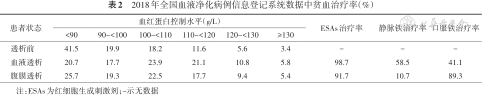
肾性贫血专家共识的发布,促进了我国肾性贫血治疗的规范化,但临床诊治现状仍不乐观。2012年一项纳入全国6个城市9个中心2 388例透析患者(血液透析1 775例,腹膜透析613例)的横断面调查中,85.3%的患者接受EPO治疗,21.0%的患者接受静脉铁注射,40.7%口服铁剂;但59.3%的患者(腹膜透析53.5%,血液透析61.2%)治疗后Hb<110 g/L[20]。2016年一项研究结果显示,2 420例非透析CKD患者中,只有39.8%的贫血患者接受EPO治疗,27.1%的患者接受铁剂治疗;22.7%的患者Hb<70 g/L时才开始治疗,治疗后Hb达到110~120 g/L者仅为8.2%[6]。2018年全国血液净化病例信息登记系统数据显示,透析患者贫血治疗现状并不理想,仍需持续改进(表2)。
2018年全国血液净化病例信息登记系统数据中贫血治疗率(%)
2018年全国血液净化病例信息登记系统数据中贫血治疗率(%)
| 患者状态 | 血红蛋白控制水平(g/L) | ESAs治疗率 | 静脉铁治疗率 | 口服铁治疗率 | |||||
|---|---|---|---|---|---|---|---|---|---|
| <90 | 90~<100 | 100~<110 | 110~<120 | 120~<130 | ≥130 | ||||
| 透析前 | 41.5 | 19.9 | 18.2 | 11.6 | 5.6 | 3.4 | - | - | - |
| 血液透析 | 20.7 | 17.7 | 23.9 | 21.1 | 10.8 | 5.8 | 98.7 | 58.5 | 41.1 |
| 腹膜透析 | 25.7 | 19.3 | 22.5 | 17.7 | 9.4 | 5.4 | 91.7 | 10.7 | 89.3 |
注:ESAs为红细胞生成刺激剂;-示无数据
上述专家共识,主要针对肾性贫血时ESAs和铁剂的合理应用。但是,仍存在以下问题:(1)对肾性贫血的系统性评估不充分,系统性诊断不足;目前部分临床医师对CKD 3期以上贫血患者,不经系统贫血诊断,就应用ESAs治疗。(2)缺乏对绝对铁缺乏和功能性铁缺乏的鉴别诊断,易导致功能性铁缺乏患者的铁剂使用剂量过大。(3)缺乏rHuEPO之外的ESAs治疗指导。(4)缺乏对新型药物低氧诱导因子脯氨酰羟化酶抑制剂(hypoxia-inducible factor prolyl hydroxylase inhibitors,HIF-PHI)规范应用的指导。(5)对肾移植、儿童、老年及糖尿病等特殊肾脏疾病患者贫血诊疗的针对性指导建议不足。并且,近年来中国学者报道了许多基于国内临床资料的肾性贫血研究数据,为制定中国肾性贫血诊治临床实践指南奠定了基础。
我们组建了由肾脏病和血液净化专家组成的指南编写委员会,针对如何规范诊断肾性贫血,ESAs应用的时机和靶目标,如何评估铁状态以及铁剂应用的时机和靶目标,非透析、血液透析和腹膜透析患者贫血治疗方案,肾移植、儿童、老年与糖尿病患者的贫血治疗方案,如何规范应用HIF-PHI等6个主要临床问题,检索PubMed、中国知网(CNKI)及中国生物医学文献数据库(CBM)发表的英文和中文论文,分析论文是否可以回答主要临床问题,并评价论文的证据等级。指南编写专家组参照日本CKD患者肾性贫血指南所采用的推荐强度和证据等级相结合的方法,将推荐强度分为:[1]推荐;[2]建议。证据等级分为:A:高度确定(荟萃分析等);B:中度确定(随机对照研究等);C:低度确定(观察性研究等);D:很低度确定(专家共识、专家意见等)以及未分级:不能明确推荐[21]。推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过2/3的专家意见。同时,借鉴和参考了目前国内外CKD贫血相关临床指南。经过6次专家讨论会进行修改和定稿,共同编制了《中国肾性贫血诊治临床实践指南》。本指南系统介绍了肾性贫血的病因与发病机制、诊断与病情评估、治疗原则、靶目标与具体方案、治疗低反应性以及特殊肾脏疾病患者贫血诊疗。目的在于指导、规范肾性贫血的诊断以及ESAs、铁剂和HIF-PHI的合理应用,提高肾性贫血诊疗水平。
红系祖细胞在EPO的刺激下,分化为各期幼红细胞,叶酸和维生素B12作为DNA合成的主要辅酶,参与幼红细胞分裂增殖。铁和原卟啉合成正铁血红素,与珠蛋白合成Hb。衰老的红细胞被单核-吞噬细胞吞噬。
人EPO是一种相对分子质量为30 400的酸性糖蛋白,包括肽链和糖链两部分,肽链由165个氨基酸组成,与4条糖链由二硫键连接形成4个稳定的α螺旋结构[22, 23]。90%以上的EPO由成人肾皮质间质细胞产生,与红系祖细胞表面EPO受体结合,促进红系定向干细胞分化、Hb合成及红细胞释放。低氧是刺激EPO合成释放的主要因素,主要调节因子是低氧诱导因子(hypoxia-induced factor,HIF)-2[24]。
Fe2+被吸收后在肠黏膜细胞内被氧化为Fe3+,与细胞内转铁蛋白结合进入血浆,与幼红细胞表面转铁蛋白受体(transferrin receptor,TfR)结合进入细胞内,参与Hb合成。与铁分离后的转铁蛋白及TfR被排出细胞外再度发挥功能。铁调素是由肝脏分泌的铁调节激素,与受体结合并诱导转运蛋白内吞,导致铁无法进入循环,机体无法利用铁。
从红细胞代谢的角度,肾脏疾病导致贫血的病因与发病机制包括:(1)红细胞生成减少:EPO生成不足、EPO活性降低、铁缺乏及代谢障碍、营养不良、甲状旁腺功能亢进、炎症状态、尿毒症毒素等;(2)红细胞破坏增加:尿毒症毒素、甲状腺功能亢进、红细胞脆性增加等;(3)红细胞丢失增加:透析失血、化验失血等。具体发病机制包括以下几个方面。
CKD患者由于肾脏损伤,导致肾脏产生EPO减少。与非肾脏病患者相比,对同样程度的贫血和低氧刺激,产生的EPO减少,表现为血EPO浓度下降或低于肾功能正常而贫血程度相当的患者。同时,炎症状态、继发性甲状旁腺功能亢进、尿毒症毒素等可导致EPO活性降低[25]。
铁缺乏及代谢障碍是导致肾脏疾病合并贫血的重要因素。消化道出血、血液透析中失血以及频繁抽血检查等可导致绝对铁缺乏,表现为SF和TSAT降低[17]。如SF正常,而TSAT降低,则提示铁的储备足够而铁的利用障碍,称之为相对铁缺乏[17]。因使用EPO而加速铁的利用造成铁储备相对不足。炎症也可升高铁调素,导致铁利用障碍[17]。
甲状旁腺素可直接或间接影响EPO释放[27],下调EPO受体表达,干扰红细胞生成,降低外周组织EPO敏感性[28];抑制红细胞膜钙泵活性,使细胞内钙离子增多、脆性增加、红细胞寿命缩短[29]。
CKD患者晚期糖基化终末产物、晚期脂质氧化物等激发炎症反应,以及免疫力下降导致反复感染等,炎症因子通过减少EPO生成及活性、升高铁调素、引起营养不良等抑制红细胞生成,加重贫血[30, 31]。
胍类及其衍生物可缩短红细胞寿命,胍类物质致血小板功能障碍,引起出血,酚类及其衍生物和多胺等抑制骨髓造血功能[32]。
CKD患者长期抽血检查、血液透析患者透析结束后管路残留血液以及消化道出血等,均可加重贫血。
肾移植术后随着移植肾功能改善,EPO水平可逐渐恢复,但急性排斥反应会导致EPO水平急剧下降。移植后体内急、慢性感染及免疫抑制药物均可引起EPO抵抗[33]。移植后使用的多种免疫抑制剂包括霉酚酸酯、硫唑嘌呤等均存在骨髓抑制作用[34]。依据PTA的原因和发病机制分为:(1)早期PTA(<6个月):围手术期失血,术后频繁抽血化验,大剂量免疫抑制剂的骨髓抑制作用,术后肾功能延迟恢复;(2)后期PTA(>6个月):EPO生成不足,EPO活性降低,造血物质缺乏,感染(微小病毒B19、巨细胞病毒等),免疫抑制药物影响。
肾性贫血患者,应系统检查,明确非肾性贫血的病因(1D)。
通过系统检查除外合并的贫血疾病后,才能确诊肾性贫血(1D)。
肾性贫血患者应进一步诊断加重贫血的危险因素(1D)。
肾性贫血诊断是复杂的临床问题,只有系统规范地检查和评估,才能进行正确诊断。多项国际临床实践指南均推荐,对于CKD患者应进行系统的贫血评估[21,26,35, 36]。其中,2015年日本CKD患者肾性贫血指南强调了CKD贫血诊断应鉴别引发贫血的各种血液系统疾病[21]。2015年英国国家卫生与临床优化研究所(National Institute of Health and Care Excellence,NICE)CKD贫血管理指南明确提出:估算肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 ml·min-1·(1.73 m2)-1的CKD患者应启动贫血评估,eGFR≥60 ml·min-1·(1.73 m2)-1时,贫血更可能与其他原因有关[37]。指南编写专家参照国际临床实践指南的建议,依据肾性贫血的常见病因,提出了肾性贫血的诊断流程和检测项目。
居住海平面地区的成年人,男性Hb<130 g/L,非妊娠女性Hb<120 g/L,妊娠女性Hb<110 g/L,可诊断贫血;但应考虑患者年龄、种族、居住地的海拔高度对Hb的影响(表3)[38]。

平均血红蛋白浓度海拔高度的校正
平均血红蛋白浓度海拔高度的校正
| 海拔高度(m) | 平均血红蛋白校正值(g/L) |
|---|---|
| <1 000 | 0 |
| 1 000 | -2 |
| 1 500 | -5 |
| 2 000 | -8 |
| 2 500 | -13 |
| 3 000 | -19 |
| 3 500 | -27 |
| 4 000 | -35 |
| 4 500 | -45 |
注:海拔高度为较海平面上升的高度
1. 明确是否存在营养不良性贫血:合并贫血的CKD患者需要常规检测Hb、红细胞比容(hematocrit,Hct),红细胞指标[红细胞计数、平均红细胞体积(mean corpuscular volume,MCV)、平均红细胞Hb量(mean corpuscular hemoglobin,MCH)、平均红细胞Hb浓度(mean corpuscular hemoglobin concentration,MCHC)以及网织红细胞计数]。符合小细胞低色素贫血时,应检测血清铁、总铁结合力(total iron binding capacity,TIBC)、TSAT、SF以及C反应蛋白(C-reactive protein,CRP),建议有条件的单位检测血清可溶性TfR(soluble transferrin receptor,sTfR)/铁蛋白对数(sTfR/log Ferritin)的比值、网织红细胞Hb(reticulocyte hemoglobin content,CHr)水平等铁参数;大细胞性贫血时应检测血清叶酸、维生素B12浓度,明确是否存在营养不良性贫血。
2. 明确是否存在溶血性贫血:合并贫血的CKD患者,应常规检测尿胆原(urobilinogen,URO)、尿胆红素(urine bilirubin,UBIL)以及血清总胆红素(total bilirubin,TBil)、直接胆红素(direct bilirubin,DBil)、间接胆红素(indirect bilirubin,IBil)、乳酸脱氢酶(lactate dehydrogenase,LDH)及网织红细胞计数和外周血红细胞形态,可疑溶血的患者应检测酸化血清溶血(Ham′s)试验、游离Hb和血清结合珠蛋白,以明确有无溶血;对于存在溶血的患者应检测直接/间接抗人球蛋白(Coombs)试验、冷凝集素试验及冷溶血(Donath-Landsteiner,DL)试验等以及骨髓象检查,以明确溶血病因。
3. 明确是否存在出血性贫血疾病:即使临床上没有明显出血表现,CKD贫血患者应常规进行粪便潜血检测,必要时行胃肠镜检查,明确是否存在消化道出血;对女性患者应注意月经量的多少,注意是否存在妇科疾病引起的出血;特别要注意没有明显临床症状与体征的隐匿性出血性疾病。
4. 明确是否存在血液系统疾病导致的贫血:合并小细胞低色素贫血CKD患者补铁治疗效果不佳时,应行珠蛋白和基因检测,明确是否存在地中海贫血;贫血程度与患者肾功能水平不匹配时,应检测血清和尿液游离轻链蛋白或尿本周氏蛋白以及血清免疫电泳,明确是否存在浆细胞增殖性疾病;贫血治疗效果不佳或合并白细胞、血小板数量异常,或合并出血、血栓疾病时应做骨髓象检查,除外相关血液系统疾病。
对于肾性贫血患者,除外营养不良性贫血、溶血性贫血、出血性贫血以及地中海贫血、再生障碍性贫血和血液系统肿瘤等其他疾病导致的贫血后,才能诊断肾性贫血。
1. 检测全段甲状旁腺素(intact parathyroid hormone,iPTH),评估继发性甲状旁腺功能亢进的程度。
2. 检测CRP,评估患者的炎症状态。
3. 检测主观综合营养评估(subjective global assessment,SGA)及营养不良炎症评分法(malnutrition inflammation score,MIS)、人体测量及血糖、血脂、血清白蛋白等,透析患者检测标化氮表现率蛋白当量(normalized protein nitrogen appearance,nPNA)、蛋白分解代谢率(protein catabolic rate,PCR)等,评估患者营养状态,明确是否存在营养不良。
4. 接受血液透析和腹膜透析治疗的患者,应检测尿素清除指数(Kt/V)、尿素下降率(urea reduction ratio,URR)等评估透析充分性。
肾性贫血的诊断流程和检测项目见图1。
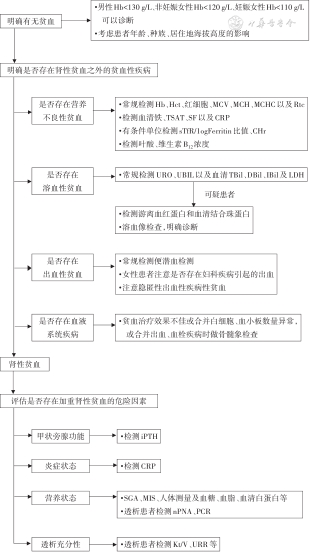

注:Hb为血红蛋白;Hct为红细胞比容;MCV为平均红细胞体积;MCH为平均红细胞血红蛋白量;MCHC为平均红细胞血红蛋白浓度;Rtc为网织红细胞计数;TSAT为转铁蛋白饱和度;SF为血清铁蛋白;CRP为C反应蛋白;sTfR为可溶性转铁蛋白受体;log Ferritin为铁蛋白对数;CHr为网织红细胞血红蛋白;URO为尿胆原;UBIL为尿胆红素;TBil为血清总胆红素;DBil为直接胆红素;IBil为间接胆红素;LDH为乳酸脱氢酶;iPTH为全段甲状旁腺素;SGA为主观综合营养评估;MIS为营养不良炎症评分法;nPNA为标化氮表现率蛋白当量;PCR为蛋白分解代谢率;Kt/V为尿素清除指数;URR为尿素下降率
3期以上CKD患者应常规进行贫血筛查(1D)。
合并贫血和贫血初始治疗阶段的CKD患者,至少每月检测1次血常规、网织红细胞计数以及SF和TSAT(1C)。
贫血维持治疗阶段或Hb较为稳定的CKD患者,至少每3个月检测1次血常规以及SF和TSAT(1C)。
针对CKD贫血患者进行CHr、sTfR/log Ferritin比值及血清/血浆CRP检验,有助于准确评估铁状态(2D)。
可疑存在非肾性贫血或ESAs治疗低反应的患者,应检验血清叶酸、维生素B12,必要时进行骨髓象检查(1D)。
血常规项目中的Hb水平是诊断贫血的标准,也是评价贫血治疗效果的标准;红细胞参数对鉴别CKD贫血的病因具有重要提示作用,小细胞低色素贫血提示缺铁性贫血或地中海贫血,巨幼细胞贫血提示维生素B12和(或)叶酸缺乏,或者遗传性或药物等获得性DNA合成障碍引起的贫血;白细胞和血小板参数的异常对再生障碍性贫血、骨髓增生异常综合征和多发性骨髓瘤等血液系统肿瘤的诊断具有提示作用。
CKD患者体内红细胞寿命缩短,透析患者中,红细胞寿命可缩短20%[39],可短至60~90 d[40]。红细胞寿命缩短的主要原因包括内源性EPO生成不足、功能性缺铁、急慢性炎症、甲状旁腺功能亢进、铝中毒、叶酸等营养素缺乏,导致红细胞生成受到抑制[37],红细胞凋亡增加[41]。并且,增加Hb检测频率可增加患者Hb稳定性。美国一项2 763个透析中心,436 442例透析患者回顾性研究的纵向模型分析结果显示,Hb测量频率从每月1次增加到每周1次,Hb维持在平均值±10 g/L和±20 g/L范围内的患者比例分别增加7%和6%[42]。
多项国际临床实践指南推荐了CKD患者的贫血检测频次。2006年美国肾脏基金会肾脏疾病结果质量倡议(Kidney Disease Outcomes Quality Initiative,KDOQI)CKD贫血临床实践指南推荐:CKD患者至少每年做1次贫血检查;Hb检测频次,ESAs初始治疗阶段的患者至少每月1次,ESAs维持治疗阶段或没有使用ESAs治疗的患者至少每3个月1次[26]。2012年肾脏疾病改善全球预后(Kidney Disease Improving Global Outcomes,KDIGO)CKD贫血临床实践指南推荐:Hb检测频次,不合并贫血的CKD患者中,CKD 3期患者至少每年1次,CKD 4~5期非透析患者每年至少2次,血液透析或腹膜透析患者至少每3个月1次;合并贫血但没有使用ESAs治疗的CKD患者中,CKD 3~5期非透析患者和腹膜透析患者至少每3个月1次;ESAs初始治疗阶段的患者至少每月1次;ESAs维持治疗阶段的非透析患者至少每3个月1次,透析患者至少每月1次[35]。2015年日本CKD患者肾性贫血指南:CKD 5期血液透析患者至少每个月1次[21]。
网织红细胞计数是反映骨髓造血功能及判断贫血疗效的重要指标。网织红细胞增多表示骨髓红系增生旺盛,常见于溶血性贫血、急性失血性贫血、缺铁性贫血以及巨幼细胞贫血等;网织红细胞减少表示骨髓造血功能减低,常见于再生障碍性贫血、骨髓病性贫血。ESAs和(或)铁剂治疗后,网织红细胞增多早于Hb升高,是评估、预测ESAs和(或)铁剂治疗效果的指标。因此合并贫血的患者以及贫血初始治疗阶段,应在检测血液常规同时进行网织红细胞检测。
铁缺乏不仅是缺铁性贫血的病因,也是肾性贫血ESAs治疗低反应的主要原因。铁缺乏包括机体铁储备不足引起的绝对铁缺乏,以及小肠上皮细胞和巨噬细胞内铁向血液中转运障碍,导致机体内储存铁不能有效利用引起的功能
性铁缺乏。
准确评估CKD患者铁状态十分困难。SF虽然可以作为反映机体铁储备的指标,但SF也是急性期炎症反应蛋白。研究显示,SF≤30 μg/L表明存在严重铁缺乏,高度提示骨髓铁缺乏;而在炎症状态下SF≤50 μg/L也存在绝对铁缺乏[37,43, 44, 45]。SF接近100 μg/L的CKD患者,大多数骨髓铁染色仍呈阳性;SF≥300 μg/L的CKD患者几乎全部具有正常的骨髓铁储备[35]。SF<200 μg/L提示CKD患者缺铁,但SF 200~1 200 μg/L则可能与炎症、潜伏感染、恶性肿瘤或肝脏疾病相关[46]。因此,SF水平正常或升高均不一定反映机体铁储备的充足,建议SF检验同时检验血浆/血清CRP,以减少对铁储备评估的偏倚。研究显示CRP≤6.5 mg/L可预测血液透析患者的Hb达到靶目标值,而CRP每升高1 mg/L,透析患者达到目标Hb水平的可能性降低7.5%[47]。TSAT、CHr和sTfR/log Ferritin是反映体内储存铁能否有效利用的指标。但是,TSAT受患者炎症和营养状态影响,导致诊断铁缺乏的可靠性降低,并且日内变异较大[48]。CHr诊断铁缺乏具有中等程度的灵敏度和特异度,与SF和TSAT相比,受炎症的影响较小,可作为反映贫血治疗反应的早期预测因子[49];CHr<29 pg可准确评估铁缺乏[50],并且被NICE推荐使用[36]。但是,由于网织红细胞寿命仅1 d左右,检测到的CHr仅能反映很短时间内可利用铁的状态,因此CHr反映机体铁利用状态也有一定局限性[51]。细胞膜TfR与结合铁原子的转铁蛋白结合,通过内化作用使铁从细胞外转运至细胞内形成内含体,继而通过内含体的酸化将铁释放入胞质以供细胞利用。细胞膜表面TfR经膜相关丝氨酸蛋白酶水解后,经过胞吐的方式释放到血浆中,从而形成sTfR。sTfR主要来源于幼稚红细胞,其次来源于网织红细胞,且血清中sTfR水平与膜表面TfR数量呈正比。sTfR是反映有核红细胞铁元素需求的指标,但在炎症状态下一些细胞因子独立于铁状态影响sTfR水平。近年认为,铁蛋白指数(sTfR/logSF比值)可以更好地判断铁蛋白偏高的CKD贫血患者是否存在伴有炎症的铁缺乏,一般认为sTfR/logSF<1 提示炎症性贫血,sTfR/logSF>2则提示铁缺乏合并炎症性贫血,即功能性铁缺乏[49]。在慢性肾衰竭患者中,sTfR和sTfR/log Ferritin比值较其他实验室指标对于缺铁性贫血诊断的灵敏度和特异度更好,且sTfR/log Ferritin比值优于sTfR[52]。
普通人群铁缺乏的诊断标准:(1)绝对性铁缺乏:SF≤30 μg/L,且(或)TSAT<20%;(2)功能性铁缺乏:SF 30~100 μg/L,且(或)TSAT<20%;(3)非铁缺乏:SF>100 μg/L,且(或)TSAT≥20%[53]。但是,CKD患者铁缺乏的诊断标准尚未确立。一般认为非透析患者或腹膜透析患者SF≤100 μg/L且TSAT≤20%为绝对铁缺乏,SF>100~500 μg/L且TSAT≤20%为功能性铁缺乏;血液透析患者SF≤200 μg/L且TSAT≤20%为绝对铁缺乏[43,54]。CHr<29 pg[36,49, 50]和(或)sTfR/log Ferritin比值>2[52],提示功能性铁缺乏。
关于铁代谢参数检测的时机与频率,目前循证研究证据不充分。研究显示,100例Hb<110 g/L、未使用ESAs或铁剂治疗的CKD 3~5期患者中,31%骨髓铁正常,48%骨髓铁缺乏,18%骨髓铁超载[54]。178例CKD 3~5期患者中,68.5%患者SF<100 μg/L且(或)TSAT<20%[55]。933 463例CKD患者中20.6%合并贫血,贫血患者中30%为绝对铁缺乏,19%为功能性铁缺乏;绝对铁缺乏与高心血管病住院风险相关,功能性铁缺乏与死亡率和心血管病住院风险增加相关[56]。626例未接受ESAs治疗的非透析CKD患者的开放标签、多中心、前瞻性随机对照研究中,在56周随访期间以SF 400~600 μg/L为靶目标的静脉铁剂治疗,可迅速达到并维持Hb水平,延迟和(或)减少ESAs治疗的需要[57]。42 230例血液透析1年以上患者随访8年的研究中,SF 300~800 μg/L和TSAT 30%~50%的患者全因死亡率最低[58]。此外,铁缺乏在腹膜透析患者中也普遍存在[50]。2014—2017年6个国家3 603例腹膜透析患者的PDOPPS研究结果显示,19%~57%的腹膜透析患者铁蛋白<300 μg/L,45%~67%的腹膜透析患者TSAT<30%[59]。腹膜透析患者每年会因胃肠道失血、诊断性静脉抽血等原因丢失约1 g铁,铁缺乏是引起腹膜透析患者贫血的重要原因[60]。由于CKD患者存在较高铁缺乏和铁超载患病率,并且影响患者全因死亡率以及ESAs治疗,因此CKD患者应定期进行铁状态评估。
多项国际临床实践指南推荐了CKD患者的铁状态评估频次。2006年KDOQI CKD贫血临床实践指南推荐:ESAs初始治疗阶段应每月1次检测SF和TSAT;ESAs维持治疗阶段或未接受ESAs治疗的血液透析患者,至少每3个月检测1次SF和TSAT[26]。2012年KDIGO CKD贫血临床实践指南推荐:ESAs治疗期间至少每3个月评估1次铁状态(TSAT和SF),包括决定开始或继续铁治疗;在开始或增加ESAs剂量、失血、静脉注射铁后监测反应时,以及铁储备可能耗尽的其他情况下,应更频繁地检测铁状态(TSAT和SF)[35]。2015年日本CKD患者肾性贫血指南推荐:应定期评估铁状态,铁剂治疗阶段每月1次,非铁剂治疗时每3个月1次[21]。NICE CKD贫血管理指南推荐:对于CKD患者每3个月1次(血液透析患者1~3个月1次)评估铁状态[36]。
体内缺乏维生素B12和(或)叶酸,导致DNA合成障碍,可引发巨幼细胞贫血,也是ESAs治疗低反应的原因之一。临床上CKD患者贫血程度与患者肾功能水平不匹配时,应重视对血液系统疾病的筛查。当出现血常规中三系细胞减少、血清和尿液游离轻链蛋白或尿本周氏蛋白增加、合并出血或血栓疾病,以及贫血治疗效果不佳时,应做骨髓象检查,除外相关疾病。
总体治疗原则:(1)肾性贫血治疗目的是避免患者输血,减少心血管事件发生,改善认知功能和提高生活质量。(2)肾性贫血治疗涉及ESAs、铁、营养状态以及透析充分性等多方面,其中应用ESAs补充EPO,或者通过HIF-PHI调控内源性EPO为肾性贫血治疗的关键。(3)治疗肾性贫血应首先纠正加重贫血的可逆因素。(4)治疗前及治疗期间应评估铁状态,对于存在绝对铁缺乏的患者应补充铁剂治疗。(5)ESAs/HIF-PHI治疗过程中,应依据Hb变化幅度调整剂量,避免Hb波动幅度过大。(6)出现治疗低反应时,应再次评估是否存在感染、继发性甲状旁腺功能亢进、铝中毒、药物及透析不充分等加重贫血的危险因素,以及是否合并其他导致贫血的疾病,并给予相应治疗。
肾性贫血治疗的Hb靶目标为:Hb≥110 g/L,但不超过130 g/L(1A)。
肾性贫血患者,应依据患者年龄、透析方式、生理需求及并发症情况个体化调整Hb靶目标(2D)。
存在脑卒中、冠心病、肿瘤等病史患者,应根据原发病情况调整ESAs/HIF-PHI治疗的Hb靶目标(2,未分级)。
肾性贫血治疗的铁代谢指标的靶目标为:SF>100 μg/L且TSAT>20%,或者CHr>29 pg/红细胞和(或)sTfR/log Ferritin比值≤2(1B)。
肾性贫血患者,应维持SF 200~500 μg/L,TSAT 20%~50%(2B)。
肾性贫血治疗期间,应密切监测ESAs/HIF-PHI及铁剂的不良反应,并给予及时治疗(1,未分级)。
单中心随机对照前瞻性队列研究中,以Hb靶目标值100~110 g/L和110~130 g/L分为两组,中位随访时间15.3个月;结果显示,两组患者的主要联合终点(血清肌酐倍增、eGFR下降25%、肾脏替代治疗以及全因死亡、非致死性心肌梗死、非致死性脑卒中、充血性心力衰竭入院)和生活质量,以及不良反应均无明显差别;但100~110 g/L患者EPO用量明显减少,每年节省医疗费用877.45元/人[61]。
24项随机对照临床试验10 361例患者的荟萃分析结果显示,与低Hb靶目标(Hb约100 g/L)相比,高Hb靶目标(Hb约130 g/L)的死亡风险增加18%,高血压风险增加40%,脑卒中风险增加73%,以及住院风险增加7%[62]。9项研究3 228例患者的荟萃分析结果显示,与低Hb靶目标相比,高Hb靶目标的血管内瘘血栓形成的风险增加34%,心血管事件、感染和输血的风险无明显差异[63]。5项随机对照临床试验7 902例患者的荟萃分析结果显示,高Hb靶目标的血管通路血栓形成的风险增加34%,脑卒中风险增加74%,但对终末期肾脏病风险或全因死亡风险无明显影响[64]。一项17个随机对照研究的荟萃分析结果显示,高Hb靶目标的患者生活质量没有得到改善[65];但另一项15个研究的系统评价中,高Hb靶目标的治疗适度地改善了生活质量[66]。此外,31项随机对照试验 12 956例患者的荟萃分析结果显示,使用相当于 10 000 U/周以上rHuEPO/阿法依泊汀剂量的ESAs将增加高血压、脑卒中、血栓、透析血管通路相关血栓形成以及全因死亡风险[67]。
MIRACLE-CKD 研究纳入了2 851例Hb<110 g/L的非透析CKD患者,使用持续性EPO受体激活剂(continuous erythropoietin receptor activator,CERA)治疗12周,在第12周时按照Hb水平分为Hb<110 g/L组和≥110 g/L组,生存分析显示Hb≥110 g/L组患者肾脏存活率明显高于Hb<110 g/L组[68]。9 269例接受ESAs治疗的腹膜透析患者的观察性队列研究结果显示,与Hb水平110~<120 g/L相比,Hb水平100~<110、90~<100、≤90 g/L患者的死亡风险分别增加12%、30%和38%[69]。
多项国际临床实践指南推荐了CKD贫血治疗的Hb靶目标值。KDOQI CKD贫血临床实践指南——Hb靶点更新(2007年)推荐:接受ESAs治疗的CKD透析和非透析患者(成人和儿童),Hb浓度110~120 g/L范围内,不应>130 g/L[70]。2012年KDIGO CKD贫血临床实践指南推荐:对于成人CKD患者不建议ESAs治疗维持Hb浓度>115 g/L,但有必要进行个体化治疗;某些患者Hb浓度>115 g/L可能改善生活质量,但需准备接受相应风险;接受ESAs治疗的所有成年CKD患者,Hb浓度≤130 g/L;接受ESAs治疗的所有儿童CKD患者,Hb浓度110~120 g/L[35]。2015年日本CKD患者肾性贫血指南推荐:成人血液透析患者周初(上次透析2 d后)透析前仰卧位采血,Hb浓度≥100 g/L且<120 g/L;非透析成人CKD患者Hb浓度≥110 g/L且<130 g/L,但既往或合并严重心血管疾病患者,Hb>120 g/L应减量或停药;成人腹膜透析患者Hb浓度≥110 g/L且<130 g/L;并推荐依据上述患者的实际诊疗情况,参考上述目标值,个体化制定患者的Hb目标值;CKD患儿Hb浓度≥110 g/L,并考虑上幼儿园、上学、学习和运动能力进行个体化调整[21]。2015年NICE CKD贫血管理指南推荐:通常情况下的理想Hb范围,成人、青少年和2岁及以上儿童100~120 g/L,2岁以下儿童95~115 g/L[36]。
研究结果显示,铁剂治疗维持SF≥100 μg/L,低色素红细胞<10%,TSAT≥20%,有助于rHuEPO治疗CKD贫血获得最佳效果[71]。对于SF高水平的CKD贫血患者,补充铁剂仍可改善贫血[72];31例血液透析患者的病例对照研究结果显示,静脉补充铁制剂维持SF水在500~1 200 μg/L可提高EPO反应性[73]。但是,铁剂补充过量可导致铁超载,导致死亡、心血管事件、住院或感染风险增加[74]。CKD患者绝对铁缺乏的诊断标准尚未确立。虽然合并炎症状态下,SF>50 μg/L仍有可能存在绝对铁缺乏[45];日本1 086例血液透析患者的2年观察性研究结果显示,经常性SF>100 μg/L患者的心脑血管并发症和感染风险增加[75]。因此,一般认为CKD患者SF<100 μg/L且TSAT<20%,开始铁剂治疗。CHr>29 pg和(或)sTfR/log Ferritin比值≤2,提示不存在功能性铁缺乏;而对于CHr<29 pg和(或)sTfR/log Ferritin比值>2的患者,可尝试HIF-PHI治疗,改善功能性铁缺乏。
非透析CKD患者的随机对照研究结果显示,补充静脉铁剂维持SF 100~200 μg/L或400~600 μg/L,12个月以上随访期间eGFR保持稳定[76]。一项为期1年非透析CKD患者的开放性、多中心、前瞻性研究中,SF靶目标100~200 μg/L组与400~600 μg/L组间心血管病、感染以及不良事件和严重不良事件无明显差别[77];静脉铁剂治疗提高SF至400~600 μg/L,可以进一步提高Hb的同时减少ESAs剂量,同时有助于eGFR保持稳定[76, 77]。在一项血液透析患者的前瞻性观察研究中,仅当TSAT<20%且SF<200 μg/L时给予静脉补铁,常规依据Hb水平调整ESAs剂量;8个月随访期间Hb保持稳定,并且平均补充铁剂量从(77.8±87.6) mg/周降至(24.4±52.9) mg/周;SF从(947.7±1 056.4) μg/L降至(570.7±424.4) μg/L,TSAT从(41.5±22.4)%降至(32.6±13.7)%[78]。DOPPS研究结果显示,在校正炎症、铁剂和ESAs治疗因素后,美国和欧洲血液透析患者SF>500 μg/L、日本血液透析患者SF>100 μg/L可增加心血管和全因死亡风险[79]。42 230例血液透析1年以上患者随访8年的研究中,SF 300~800 μg/L和TSAT 30%~50%的患者全因死亡率最低[58]。也有学者认为血液透析患者维持TSAT不高于45%~50%,有利于内体铁正平衡,并且对血管、心脏和内分泌器官的风险较低[80]。但是,在8 339例普通成人中,SF每增加100 μg/L,eGFR下降0.26 ml·min-1·(1.73 m2)-1(95%CI:0.08~0.44);sTfR每增加5 mg/L,eGFR下降6.0 ml·min-1·(1.73 m2)-1;但转铁蛋白与eGFR无明显相关性[81]。
多项国际临床实践指南推荐了CKD贫血治疗铁代谢指标的靶目标值。2006年KDOQI CKD贫血临床实践指南推荐:ESAs治疗期间,血液透析患者维持SF>200 μg/L,且TSAT>20%或CHr>29 pg/红细胞;未透析CKD患者和腹膜透析患者维持SF>100 μg/L,且TSAT>20%;SF>500 μg/L时不推荐常规静脉铁剂治疗,而应权衡ESAs反应性、Hb和TSAT水平以及患者临床状况后再决定[26]。2012年KDIGO CKD贫血临床实践指南推荐:对于未实施ESAs和铁剂治疗的成人CKD患者,以不应用ESAs并提高Hb水平为目的,并且TSAT≤30%且SF≤500 μg/L时建议补充铁剂治疗;对于ESAs治疗但未补充铁剂治疗的成人CKD患者,为提高Hb水平或减少ESAs剂量,建议补充铁剂治疗;儿童CKD患者维持SF>100 μg/L且TSAT>20%[70]。2015年日本CKD患者肾性贫血指南推荐:对于未实施ESAs和铁剂治疗、不能维持Hb目标值的患者,SF≤50 μg/L时,建议ESAs治疗前先补充铁剂治疗;ESAs治疗不能维持Hb目标值的患者,SF≤100 μg/L且TSAT≤20%时,推荐补充铁剂治疗;ESAs治疗不能维持Hb目标值的患者,未见铁利用率低下的病理生理状态、并且SF≤100 μg/L或TSAT≤20%时建议补充铁剂治疗;SF>300 μg/L患者,不推荐补充铁剂治疗[35]。2015年NICE CKD贫血管理指南推荐:除非SF>800 μg/L,应控制低色素红细胞<6%,CHr>29 pg,SF>100 μg/L且TSAT>20%[21]。
1. 肾性贫血患者治疗前应评估患者的贫血程度、生理需求、铁代谢状态、营养状态、炎症状态、透析治疗充分性以及感染、心脑血管、肿瘤等并发症和(或)合并疾病的状态。
2. 依据上述评估结果确定合适的Hb靶目标。
3. ESAs/HIF-PHI及静脉铁剂治疗前应权衡获益与风险。
4. 依据上述评估结果确定合适的ESAs/HIF-PHI治疗剂量及给药方式;并定期检测Hb,依据Hb水平调整ESAs/HIF-PHI治疗剂量。
5. 依据上述评估结果确定合适的铁剂治疗剂量及给药方式;并定期评估铁代谢状态,调整铁剂治疗剂量。
6. 肾性贫血治疗期间,应密切监测高血压、血栓栓塞性疾病、过敏、感染、肿瘤及心脑血管等并发症发生与变化,关注ESAs/HIF-PHI及铁剂的不良反应,并给予及时治疗。
ESAs可有效治疗肾性贫血(1A),但治疗前应尽可能纠正铁缺乏或炎症状态等加重肾性贫血的危险因素(1D)。
ESAs治疗前应权衡减少输血及贫血相关症状带来的获益与ESAs治疗可能引起的脑卒中、高血压、肿瘤等风险(1B),既往存在脑卒中、恶性肿瘤病史或活动性肿瘤患者应仔细评估肿瘤进展、脑卒中再发风险,谨慎使用ESAs(2C)。
纠正绝对铁缺乏后Hb<100 g/L的患者,给予ESAs治疗(1C);不建议Hb≥100 g/L的非透析CKD患者开始ESAs治疗(2B);尽量避免血液透析患者Hb<90 g/L时才开始使用ESAs治疗,为提高部分Hb>100 g/L患者的生活质量,可给予个体化ESAs治疗(2,未分级)。
根据CKD患者Hb水平和临床情况选择ESAs种类,并决定ESAs初始治疗剂量(1D)。具体剂量:rHuEPO:每周50~150 U/kg,分1~3次给药。达依泊汀α:0.45 μg/kg,每1~2周给药1次。CERA:0.6 μg/kg,每2~4周给药1次。
ESAs初始治疗Hb速度控制在每月10~20 g/L;若每月Hb增长速度>20 g/L,应减少ESAs剂量的25%~50%。若每月Hb增长速度<10 g/L,应将ESAs的剂量每次增加20 U/kg,每周3次(2D)。
ESAs治疗期间,Hb达到115 g/L时,应将ESAs剂量减少25%;Hb升高且接近130 g/L时,应暂停ESAs治疗,并监测Hb变化,Hb开始下降时应将ESAs剂量降低约25%后重新给药;Hb达到目标值时,推荐减少ESAs剂量而不是停用ESAs,除非出现明显的严重不良反应(1D)。
非透析CKD和腹膜透析患者选择ESAs皮下注射给药,特殊情况下也可采用静脉注射给药;规律血液透析治疗患者选择ESAs静脉或皮下注射给药(2B)。
疑似或诊断抗EPO抗体诱导的纯红细胞再生障碍性贫血(PRCA)患者停止ESAs治疗(1A)。
高剂量ESAs增加心血管事件、死亡及肿瘤复发的风险,Hb≥90 g/L的合并心力衰竭CKD患者不建议使用ESAs治疗(2B);既往存在恶性肿瘤病史或有活动性肿瘤的CKD患者,Hb靶目标<100 g/L(2D)。
ESAs是EPO的类似物,目前主要有以下3种类型[82, 83, 84, 85, 86]。
1. 第一代ESAs:即rHuEPO,为短效ESAs,1989年由美国食品药品监督管理局(FDA)批准上市,是一种免疫学及生物学特性均与人内源性EPO极其相似的唾液酸蛋白激素。皮下注射剂型及静脉注射剂型的半衰期分别为19.4、6.8 h,需要每周1~3次给药。临床常用的有rHuEPO-α和rHuEPO-β两种类型。
2. 第二代ESAs:即达依泊汀α,为长效ESAs,20世纪90年代上市。达依泊汀α有两条与N端相连的糖基链,这种糖基化结构改变其在体内的药代动力学,增加其在体内的稳定性,其半衰期约是第一代ESAs的2~3倍,皮下注射剂型及静脉注射剂型的半衰期分别为48.8、25.3 h。
3. 第三代ESAs:CERA,即甲氧聚二醇重组人EPO(methoxy-polyethylene glycol-epoetin beta,MPG-EPO),是一种化学合成的持续性EPO受体激活剂,其最大的特点是半衰期长,皮下注射剂型及静脉注射剂型的半衰期分别为133、130 h。
上述3种类型的ESAs均能明显减少CKD患者的输血次数及减轻贫血相关症状[87, 88, 89, 90, 91, 92, 93, 94, 95]。随机对照研究结果显示,与rHuEPO相比,达依泊汀α能够减少给药次数,且安全性与rHuEPO相似[96];CERA每月1~2次皮下给药维持透析患者Hb水平的疗效相同,且安全性良好,能够减少给药次数,提高患者依从性,减少Hb变异度[97, 98]。在非透析CKD患者中,目前尚无充分证据表明这3种类型的ESAs在提高Hb水平、引起的不良反应(包括全因死亡、心脑血管事件、肿瘤、高血压、血栓等)及改善生活质量方面存在差异[99, 100, 101]。建议根据患者临床情况、耐受性和依从性、Hb波动情况选择ESAs种类。
ESAs治疗的目的是补充CKD患者的绝对或相对EPO不足。如前所述,CKD患者的贫血病因多样,只有排除其他贫血原因后诊断为肾性贫血的CKD患者,才适用ESAs治疗。
93 087例血液透析患者的的回顾性分析中,以Hb 110~120 g/L为参考值,Hb<100 g/L患者的死亡风险增加64%,首次住院风险增加34%;而Hb 120~130 g/L的患者死亡风险减少21%,为最低水平;Hb≥130 g/L患者的首次住院风险减少11%[102]。58 058例血液透析患者2年队列研究中,以Hb 115~120 g/L为参考值,患者的死亡风险Hb<100 g/L患者增加超过48%,Hb 120~130 g/L患者增加12%,Hb>135 g/L患者增加24%[103]。9 269例接受ESAs治疗的腹膜透析患者观察性队列研究结果显示,Hb<100 g/L腹膜透析患者全因死亡风险和心血管死亡风险明显增加[69];对于合并无症状性缺血性心脏病等高风险患者,Hb在90~100 g/L使用ESAs治疗,有利于Hb维持在100 g/L[104]。因此,推荐Hb<100 g/L患者开始ESAs治疗,避免Hb<90 g/L。
如前所述,CKD患者常常存在铁缺乏,铁剂治疗不仅可以明显改善部分CKD贫血患者的Hb,而且可增加ESAs的疗效。292例未接受ESAs治疗的非透析CKD患者中,口服铁剂(元素铁200 mg/d)4周,21.6%患者Hb增加>10 g/L,其他患者第8、12、24和52周Hb增加>10 g/L的比例分别为11.1%、19.9%、25.9%和28.7%[105]。因此,建议肾性贫血患者ESAs治疗前应纠正铁缺乏;纠正绝对铁缺乏后如果Hb<100 g/L,应给予ESAs治疗。
108例Hb<90 g/L的血液透析患者的随机对照单盲研究显示,随访第6个月,安慰剂组平均Hb为74 g/L,而应用ESAs治疗Hb靶目标95~110 g/L组和Hb靶目标115~130 g/L组的平均Hb分别为102 g/L和117 g/L,提示未应用EPO治疗的血液透析贫血患者的Hb较快下降至80 g/L以下[106]。因此,建议Hb<90 g/L的CKD患者,可在补充铁剂的同时,给予ESAs治疗。
ESAs可引起血压升高、促进肿瘤生长、增加恶性肿瘤患者血栓栓塞风险,因此对于合并活动性肿瘤(尤其是预计可治愈的肿瘤)、脑卒中病史或恶性肿瘤病史患者应用ESAs需谨慎[35]。CHOIR研究二次分析结果显示,无论是ESAs治疗后4个月还是9个月,高剂量(>20 000 U/周)ESAs组较相同Hb目标值的低剂量(<20 000 U/周)ESAs组患者的死亡、心肌梗死、心力衰竭住院及脑卒中的终点事件明显升高;4个月时高剂量ESAs组终点事件危险比增加57%,而与Hb目标值无关;高ESAs剂量组终点事件危险比的对数与ESAs的周使用剂量呈线性关系[107]。31项研究12 956例CKD患者的荟萃分析证实了高剂量ESAs与全因死亡率、高血压、脑卒中和血栓事件(包括血管通路相关的血栓事件)密切相关[67]。13 933例肿瘤患者的荟萃分析结果显示,使用ESAs治疗增加了全试验阶段的死亡率(HR=1.17,95%CI:1.06~1.30),降低了总体生存率(HR=1.06,95%CI:1.00~1.12);其中10 441例接受化疗的肿瘤患者中,在全试验阶段使用ESAs治疗的总体死亡合并HR为1.10(95%CI:0.98~1.24),总生存的合并HR为1.04(95%CI:0.97~1.11)[108]。此外,ESAs还会增加肿瘤患者的脑卒中、血栓风险[109];但是,荟萃分析结果也证实接受化疗、Hb<100 g/L的Ⅳ期肿瘤患者,达依泊汀α治疗12周72%的患者Hb增加>10 g/L,需要输血的患者减少24%,且在治疗期间未发现其他不良事件[110]。因此,ESAs治疗前应评估全身状况,权衡获益与风险,根据个体需求、功能状态、疾病负担及预后等情况综合决定;既往或合并脑卒中、活动性肿瘤且预后较好的患者,应慎用ESAs。
1. 初始剂量:多项国内外临床实践指南和专家共识均推荐根据CKD患者Hb水平和临床情况决定ESAs初始治疗剂量;对于初始Hb偏高的患者,应降低ESAs起始剂量;对于既往患有脑血管病、血栓栓塞、癫痫或高血压的患者,ESAs初始剂量应在较低范围内;具体剂量如下[17, 18,21,35, 36,70,82]:(1)rHuEPO:每周50~150 U/kg,分1~3次给药。(2)达依泊汀α:0.45 μg/kg,每1~2周给药1次。(3)CERA:0.6 μg/kg,每2~4周给药1次。
2. 剂量调整:ESAs剂量调整的频率取决于初始治疗期间Hb浓度的上升速率以及维持治疗期间Hb浓度的稳定性,ESAs剂量调整最小间隔一般为2周。Hb增长速度随着个体对ESAs反应性而变化。严重感染或手术等可能影响ESAs反应性,需根据患者的临床状况重新调整ESAs剂量。34 963例血液透析患者的回顾性研究发现,Hb变异度是死亡的独立危险因素[111]。因此应密切监测Hb变化,个体化调整ESAs剂量,避免Hb波动过大。多项国内外临床实践指南和专家共识均推荐根据ESAs治疗期间Hb的变化程度,调整ESAs的剂量[17, 18,21,26,35, 36,70]。(1)建议初始治疗时Hb增长速度控制在每月10~20 g/L;若每月Hb增长速度>20 g/L,应减少ESAs剂量的25%。若每月Hb增长速度<10 g/L,应将rHuEPO的剂量每次增加20 U/kg,每周3次,或调整ESAs剂量为每次10 000 U,每2周3次。(2)当Hb达到115 g/L时,应将ESAs剂量减少25%;当Hb升高且接近130 g/L时,应暂停ESAs治疗,并监测Hb变化,当Hb开始下降时,应将ESAs剂量降低约25%后重新给药。(3)当Hb达到目标值时,推荐减少ESAs剂量而非停用ESAs。(4)当出现ESAs不良反应或ESAs低反应性时,需要重新评估贫血的加重因素,调整ESAs剂量。
3. 给药方式:短效ESAs(rHuEPO)的静脉给药与皮下给药相比,生物利用度更高;30例患者的临床研究中,短效ESAs(rHuEPO)从皮下注射改为静脉给药,6个月后的平均Hct以及经过体重校正的平均rHuEPO剂量均没有明显差异[112];长效ESAs(达依泊汀、CERA)皮下给药疗效与静脉给药相比疗效相当[113]。采用预充式注射器注射使用方便并可减少污染[114]。(1)未透析CKD患者:建议非透析CKD患者ESAs治疗采用皮下注射给药。(2)血液透析患者:规律血液透析治疗的患者,建议ESAs治疗静脉或皮下注射给药。(3)腹膜透析患者:建议腹膜透析患者ESAs治疗采用皮下注射给药,特殊情况下也可以选择静脉给药。
1. 常见不良反应及处理:ESAs治疗常见不良反应包括高血压、低血压、非心源性胸痛、头痛、头晕、脑卒中、癫痫、咳嗽、呼吸困难、上呼吸道感染、肺炎、恶心、呕吐、腹泻、便秘背部疼痛、肢体疼痛、肌肉痉挛、血管通路血栓形成、脓毒血症、鼻咽炎、外周水肿等[86,115, 116, 117]。
(1)高血压:发生机制主要为:①ESAs治疗后增加的红细胞容积导致外周血管阻力增加;②ESAs治疗升高内皮素-1、前列腺素F2α和血栓素B2水平,增加外周血管阻力[118, 119]。20%~30%接受 ESAs治疗的 CKD患者发生高血压或高血压加重,血压升高最早在ESAs治疗后的2周至4个月内发生,最常见于透析患者中,这些患者往往有高血压史[120, 121]。9个随机对照试验5 143例患者的荟萃分析结果显示,固定效应模型中高Hb目标组(Hb≥120 g/L)血压控制不良的风险明显高于低目标Hb组(RR=1.27,95%CI:1.08~1.50,P=0.004)[122]。4 022例血液透析患者的多中心、观察性、前瞻性、横断面研究结果显示,ESAs治疗是透析前高血压和血压控制不良的独立危险因素[123]。接受初始ESAs治疗的患者,一旦出现高血压或高血压加重,可给予降压药物治疗,一般不需要停用ESAs治疗;但发生难治性高血压,需要ESAs减量或停药[19]。难治性高血压患者血压控制在160/100 mmHg(1 mmHg=0.133 kPa)以下后,可给予推荐范围内最小剂量ESAs治疗,并控制Hb上升速度不超过每2周10 g/L [124]。
(2)血栓形成:ESAs治疗后红细胞生成增多,Hct增高,血液黏度增加,增加血栓形成风险。TREAT研究中,4 038例糖尿病、CKD和贫血患者随机分为达依泊汀α治疗组(2 012例)和安慰剂组(2 026例),治疗组Hb靶目标值为130 g/L,安慰剂组Hb低于90 g/L时使用达依泊汀α进行补救治疗;研究结果显示,达依泊汀α治疗组相比于安慰剂组,静脉血栓栓塞事件(2.0%比1.1%,P=0.02)和动脉血栓栓塞事件(8.9%比7.1%,P=0.04)发生风险均明显增加[120]。
(3)癫痫:ESAs治疗早期以维持Hb正常水平为目标值时,癫痫发生率为2%~17%;多伴有难以控制的高血压和Hb快速上升[125, 126]。但是,12项随机对照试验638例CKD患者的荟萃分析结果显示,接受ESAs和未接受ESAs治疗的CKD患者,癫痫发生率无明显差异(RR=1.14,95%CI:0.66~1.97)[121]。
(4)肌痛及输液样反应:通常发生在应用 rHuEPO 1~2 h后,出现肌痛、骨骼疼痛、低热、出汗等症状,可持续12 h,2周后可自行消失。症状较重者可给予非类固醇类抗炎药治疗[127]。
(5)其他:曾有报道ESAs治疗发生严重的皮肤反应,包括多形性红斑、Stevens-Johnson综合征、中毒性表皮坏死松解症;可能发生过敏反应,包括过敏症、血管性水肿、支气管痉挛、皮疹以及荨麻疹;含有人血浆衍生物(白蛋白),可能存在传染源的风险,包括病毒感染和克雅氏病的风险[128, 129, 130]。发生上述情况应立即停用ESAs。
2. 抗EPO抗体介导的PRCA:ESAs治疗引发的抗EPO抗体介导的PRCA是一种罕见但严重的并发症,发生率为0.02~0.03/10 000患者年,至少在ESAs治疗后3周发生,通常发生在ESAs治疗6~8个月后[131]。长期使用ESAs患者可产生抗EPO抗体,该抗体与内源性EPO发生交叉反应,严重抑制红细胞生成,进而导致PRCA。主要临床表现为Hb以每周5~10 g/L的速度快速下降,或需要1~2周输红细胞以维持Hb水平;网织红细胞绝对计数<10×109/L,且血小板和白细胞计数正常范围;骨髓活检可见红系增生显著低下或完全缺失,血清学检测存在抗EPO抗体[132, 133, 134]。大多数病例与皮下注射有关[135]。
(1)抗EPO抗体介导的PRCA的诊断:①当ESAs治疗超过4周并出现以下情况时需考虑抗EPO抗体介导的PRCA:Hb以每周5~10 g/L的速度快速下降,或需要以1~2周的速度输红细胞以维持Hb水平;网织红细胞绝对计数<10×109/L,且血小板和白细胞计数正常。②确诊必须存在EPO抗体检测阳性,以及骨髓活检提示不存在或几乎不存在红系细胞。
(2)抗EPO抗体介导的PRCA的治疗:①疑似或确诊抗EPO抗体介导的PRCA患者应停止ESAs治疗,且由于抗体可能发生交叉反应,不能转换成另一种ESAs治疗。②抗EPO抗体介导的PRCA最有效的治疗是肾移植,其次是免疫抑制治疗[136]。免疫抑制药物包括环孢素A、皮质类固醇和环磷酰胺等,目前首选环孢素A[136, 137, 138, 139];47例抗EPO抗体介导的PRCA患者回顾性研究发现,接受免疫抑制治疗的37例患者中29例(78%)患者抗EPO抗体消失,而未接受免疫抑制治疗的9例患者抗EPO抗体持续存在[132]。也可试用大剂量静脉丙种球蛋白或血浆置换治疗。
1. 既往合并脑卒中的患者慎用ESAs:TREAT研究中治疗组Hb靶目标值为130 g/L,安慰剂组Hb<90 g/L时使用达依泊汀α进行补救治疗;结果显示,ESAs治疗组较安慰剂组脑卒中风险增加1.92倍(95%CI:1.38~2.68)[117],其中脑卒中病史(OR=2.1,95%CI:1.5~2.9)和ESAs治疗(OR=2.0,95%CI:1.4~2.9)是新发脑卒中的独立危险因素[140]。
2. 既往存在恶性肿瘤病史或有活动性肿瘤的CKD患者,应以最小的ESAs剂量进行治疗以控制症状,同时Hb治疗靶目标不能超过100 g/L[127]:EPO与肿瘤细胞的EPO受体结合,可促进肿瘤细胞增殖、降低凋亡;与单核细胞和巨噬细胞的EPO受体结合,诱导免疫抑制;同时改变组织供氧,增加淋巴血管新生[109,127,141]。并且,合并恶性肿瘤的CKD贫血发生除了CKD相关的EPO缺乏、铁缺乏等,还与肿瘤本身、肿瘤相关的化疗、炎症等相关,因此合并肿瘤的CKD贫血更需要仔细评估贫血的可能病因。合并肿瘤的CKD患者使用ESAs,需进行促进医师与癌症患者安全使用ESAs的风险说明(Assisting Providers and cancer Patients with Risk information for the Safe use of ESAs,APPRISE)肿瘤学计划[141]。美国临床肿瘤学会和美国血液学会的联合指南:对于可治愈的恶性肿瘤患者以及预期化疗后可获得中到长期生存的恶性肿瘤患者,使用ESAs带来不可接受的风险可能超过其潜在获益,因此建议在接受治愈性治疗的恶性肿瘤患者中,应谨慎使用ESAs治疗;对于化疗所致Hb<100 g/L患者化疗期间使用ESAs治疗,化疗结束后1个月内停止使用,并降低Hb靶目标值;但对于有合并CKD的恶性肿瘤患者无推荐意见;并强调医护工作者与患者需要就ESAs治疗的风险和获益进行详细讨论[142]。英国药品和保健产品监管机构(the Medicines and Healthcare products Regulatory Agency,MHRA)不建议将ESAs给予没有适应证的肿瘤患者,并提出应密切监测,以确保使用最低剂量ESAs达到改善贫血症状和控制贫血[143]。2012年KDIGO 贫血临床实践指南建议:伴有活动性恶性肿瘤或恶性肿瘤病史,请谨慎使用ESAs;Hb≥100 g/L的患者不需要使用ESAs,Hb<100 g/L的患者则应用ESAs治疗避免Hb<90 g/L[35]。
3. 高剂量ESAs增加心血管事件和死亡风险:CHOIR 研究二次分析结果显示,高剂量(>20 000 U/周)ESAs组较低剂量(<20 000 U/周)ESAs组治疗4个月时患者的死亡、心肌梗死、心力衰竭住院及脑卒中的终点事件风险增加57%,终点事件危险比的对数与ESAs的周使用剂量呈线性关系[107]。31项随机对照研究12 956例CKD患者的荟萃分析显示,前3个月ESAs平均剂量以及全试验周期的ESAs平均剂量与全因死亡相关;ESAs前3个月的治疗剂量每增加10 000 U,全因死亡风险增加1.42倍,ESAs总剂量每增加10 000 U,全因死亡风险增加1.09倍[112]。
4. Hb≥90 g/L的合并心力衰竭CKD患者不建议使用ESAs治疗:严重贫血是心力衰竭的独立危险因素[144, 145, 146, 147]。ESAs治疗前Hb每下降10 g/L,心力衰竭风险增加1.28倍,再发心力衰竭的风险增加1.20倍[148]。9项ESAs治疗心力衰竭贫血患者随机对照研究的系统综述显示,纠正贫血可提高患者运动时间及强度、心脏射血分数、纽约心功能分级(NYHA)、生活质量指数,减少心力衰竭相关住院;但其中仅3项研究入组了CKD患者[149]。13项随机对照研究3 172例心力衰竭患者的荟萃分析中也仅1项研究入组了轻中度肾功能不全的患者,结果显示ESAs治疗可改善呼吸困难和NYHA分级,但未明显降低死亡率和住院率,且增加血栓事件发生率[150]。319例心力衰竭合并贫血患者[平均eGFR 47.2 ml·min-1·(1.73 m2)-1,Hb 90~125 g/L]的STAMINA-HeFT研究结果显示,ESAs较安慰剂未见明显临床获益[151]。2 278例收缩功能障碍的心力衰竭合并贫血患者[平均eGFR 45.7 ml·min-1·(1.73 m2)-1,Hb 90~120 g/L]的大样本随机对照研究同样发现,Hb治疗靶目标为130 g/L,ESAs和安慰剂组的全因死亡率或因严重心衰住院率无明显差异;ESAs组血栓及脑卒中事件发生率有增加趋势,但差异无统计学意义[152]。2017年美国心脏病学会/美国心脏协会/美国心力衰竭学会(ACC/AHA/HFSA)指南建议,ESAs不用于合并心力衰竭的贫血患者[147]。
存在绝对铁缺乏患者,无论是否接受ESAs治疗,应给予铁剂治疗(1B)。
存在功能性铁缺乏患者,应权衡治疗获益与风险后决定是否给予铁剂治疗(2B)。
开始铁剂治疗之前,应首先评价Hb水平和铁代谢状态,寻找并处理铁缺乏潜在原因。对铁剂治疗的途径、剂量和疗程的选择,应权衡治疗获益与风险后决定(未分级)
透析前CKD患者和腹膜透析患者,首先选择口服途径补铁治疗1~3个月,如不耐受或无效,可转为静脉铁剂治疗(1B);血液透析患者常规选择静脉铁剂治疗,建议青壮年血液透析贫血患者可选择高剂量低频次静脉铁剂治疗(2B)。
老年血液透析患者尽量避免高剂量静脉铁剂冲击治疗(2C)。
铁剂治疗后Hb无进一步升高或减少ESAs剂量的需求,且排除活动性感染及肿瘤等因素影响,满足以下任何一项铁超载标准应停止铁剂治疗:SF>800 μg/L和TSAT>50%(2C);低色素红细胞百分比(HRC%)<10%和(或)CHr>33 pg/红细胞或sTfR<1 000 μg/L(2C)。
任何静脉铁剂都可能出现危及生命的超敏反应。在首次静脉铁剂治疗时,输注的前60 min应对患者进行生命体征监护,同时需配备必要的急救药品(1C)。
存在全身活动性感染的CKD贫血患者,应避免静脉铁剂治疗(2C)。
元素铁是骨髓成红细胞向成熟红细胞分化过程中合成Hb必要原料物质。如果机体存在铁缺乏,即使EPO充足,肾性贫血也难以纠正。然而,CKD贫血患者铁缺乏的发生率高达50%,维持性血液透析患者的铁缺乏率更高[43,55,153]。CKD患者铁缺乏类型分为绝对铁缺乏和功能性铁缺乏。绝对铁缺乏指机体铁元素储备量绝对减少,主要原因包括铁摄入减少、血液透析患者透析器和管路中失血等。功能性铁缺乏为铁元素在网状内皮系统滞留,使铁元素利用障碍,肇始因素为炎症、铁调素水平增加等[43]。
纠正铁缺乏是肾性贫血关键治疗措施,将机体铁代谢维持在一个合理水平,以确保ESAs治疗反应性,降低CKD贫血导致的不良临床预后,改善患者生存率和生活质量。本章节针对CKD铁缺乏治疗靶目标、治疗时机、方法以及停止治疗指征等重要临床问题,在广泛文献调研并参考相关国际指南基础上,提出了CKD铁缺乏治疗临床实践指南,为科学合理管理CKD铁缺乏提供指导意见。
1. 铁剂的种类:铁剂分为口服铁剂和静脉铁剂两大类。常用口服铁剂主要为二价铁(亚铁)盐,包括多糖铁复合物胶囊、琥珀酸亚铁、硫酸亚铁、乳酸亚铁、富马酸亚铁等,磷结合剂枸橼酸为三价铁盐,长期服用在控制高磷血症的同时,也可以改善铁缺乏[44,154]。常用静脉铁剂包括蔗糖铁、右旋糖酐铁和葡萄糖酸铁。
2. 口服铁剂与静脉铁剂的特点:口服铁剂对机体铁代谢状态的影响更接近于生理状态,治疗安全且便捷,发生过敏反应和增加感染风险低,无需频繁往返医院就诊。枸橼酸铁不仅显著改善CKD 3~5期非透析肾性贫血患者SF、TSAT以及Hb水平[44,155, 156],而且可作为磷结合剂治疗高磷血症。但是,口服铁剂纠正贫血速度较慢,适合于肾性贫血程度较轻以及贫血纠正后维持治疗的CKD患者[155, 156]。口服铁剂主要缺点是引起胃肠道不良反应,慢性炎症状态可上调铁调素表达抑制胃肠道对铁剂的吸收;此外,一些药物和食物可降低铁剂吸收和疗效,如碱性药物、质子泵抑制剂、H2阻断剂以及富含鞣酸和钙、磷的食物等[35]。
静脉铁剂纠正肾性贫血的有效性和安全性已得到系列循证医学研究的证实。荟萃分析结果显示,静脉铁剂可高效地升高Hb并维持达标水平,同时减少EPO剂量和输血需求[35,71]。此外,静脉铁剂可以避免口服铁剂的胃肠道不良反应和口服药物对铁剂吸收的影响。尽管临床实践证明在多数情况下静脉铁剂治疗安全有效,但仍存在可能引起过敏反应,严重过敏反应可危及生命。并且,持续大剂量静脉铁剂治疗可增加心血管事件和感染风险,但也有相反的研究结果[71,76, 77]。静脉铁剂不规范应用可造成铁超载,引起肝脏、心脏等重要器官的损害[75]。
3. 铁剂的选择:血液透析患者每年因透析造成的铁损失约为1 g或更多,包括透析管路或透析器中的残留血液以及血液采样;因此给予静脉铁剂补充可以更有效满足Hb合成的铁需求且确保ESAs治疗充分获益。CKD非透析和腹膜透析与血液透析患者不同,无血液透析引起的失血等问题,并且由于静脉补铁需要患者频繁就诊,非透析和腹膜透析患者静脉补铁较血液透析患者困难。因此,普遍认为非透析和腹膜透析患者优先选择口服补铁治疗。REVCOKE及FIND-CKD研究显示,对于CKD 3~4期铁缺乏贫血患者口服和静脉铁剂治疗均可以升高Hb水平、延缓开始ESAs治疗时间、减少ESAs剂量;但高剂量(1 000 mg/月)静脉铁剂治疗升高Hb的平均水平明显高于低剂量静脉铁剂和口服铁剂组,且Hb升高速度更快;口服铁剂及静脉铁剂治疗患者的SF-36生活质量评价、不良反应及严重不良反应差异无统计学意义[45,79]。24项随机对照研究的荟萃分析结果表明,无论CKD非透析患者还是CKD 5D患者,静脉铁剂治疗比口服铁剂更有助于提升Hb水平,改善ESAs治疗的反应性,减少ESAs的剂量[71]。尽管目前国际指南仍推荐血液透析患者优先选择静脉铁剂治疗,非透析和腹膜透析患者可选择口服铁剂治疗[157];但在临床实践中应结合患者贫血和铁缺乏严重程度、治疗依从性以及静脉通路等因素,综合考量决定透析前CKD和腹膜透析患者铁剂治疗选择口服或静脉途径。
元素铁是骨髓成红细胞向成熟红细胞分化过程中合成Hb的必要原料物质。一般认为,CKD透析前和腹透患者SF<100 μg/L和(或)TSAT<20%,血液透析患者SF<200 μg/L和(或)TSAT<20%,存在绝对缺铁,不能满足成熟红细胞生成的需求[18]。因此,存在绝对铁缺乏的CKD贫血患者,无论是否接受ESAs治疗,均应开始铁剂治疗,以满足红细胞生成的需求并防止铁缺乏加重。血液透析患者的前瞻性观察研究中,当TSAT<20%且SF<200 μg/L时给予静脉补铁,并依据Hb水平调整ESAs剂量,8个月随访期间Hb保持稳定,并且平均补充铁剂量从(77.8±87.6) mg/周降至(24.4±52.9) mg/周[78]。
功能性铁缺乏的患者由于存在铁元素的转运和利用障碍,因此即使充足剂量的ESAs治疗,也不能有效纠正贫血或引起对ESAs低反应性。对于功能性铁缺乏的CKD贫血患者铁剂治疗的时机,目前普遍认为,在未接受ESAs治疗的患者,补充铁剂可以避免或推迟ESAs治疗;在ESAs治疗的患者中,它可以提高Hb水平或减少Hb达标所需要的ESAs剂量[158]。
多项国际临床实践指南推荐了CKD患者铁剂治疗的适应证和治疗时机。2012年KDIGO指南推荐:CKD患者TSAT≤30%且SF≤500 μg/L时,无论是否接受ESAs治疗,为提高Hb水平或减少ESAs剂量,建议补充铁剂治疗;CKD贫血患者SF>500 μg/L原则上不常规应用静脉补铁治疗,但当患者排除急性炎症状态等情况,高剂量ESAs仍不能改善贫血时,可试用铁剂治疗[159]。2013年欧洲肾脏最佳临床实践(ERBP)指南推荐:在未接受ESAs治疗时,对绝对铁缺乏的患者进行铁剂治疗,或者仅在TSAT<25%并且SF<200 μg/L(透析患者<300 μg/L)给予铁剂治疗;对于已经接受ESAs治疗的患者,如果TSAT<30%且SF<300 μg/L,也建议铁剂治疗;血液透析患者SF水平较高但存在ESAs低反应性时,如增加ESAs剂量的风险大于获益,则可以考虑给予静脉铁剂治疗[160]。2015年日本透析医学会(JSDT)肾性贫血指南推荐:对未实施ESAs和铁剂治疗的CKD贫血患者,SF≤50 μg/L时,建议ESAs治疗前先补充铁剂治疗;ESAs治疗不能维持Hb目标值的患者,同时SF≤100 μg/L且TSAT≤20%,也无引起铁利用率低下的病理生理状态,推荐补充铁剂治疗[161]。尽管在日本开始铁剂治疗的水平较西方国家低,但日本CKD患者补铁的频率和剂量远低于西方国家,而Hb达标率和ESAs剂量反而明显优于西方国家。2015年NICE指南首次提出,建议CKD贫血患者HRC%>6%或CHr<29 pg/红细胞,给予铁剂治疗[21]。2015年JSDT指南推荐,CKD贫血患者,HRC%>10%,CHr<32.2 pg或sTfR>1 200 μg/L为功能性铁缺乏[161]。近年认为,对于铁蛋白显著升高的CKD贫血患者,可计算铁蛋白指数(sTfR/logSF)>2则提示炎症相关的功能性铁缺乏,以此作为是否继续静脉补铁治疗的参考指标[78]。
1. 口服铁剂治疗:口服铁剂剂量为150~200 mg/d(元素铁),治疗1~3个月后再次评价铁状态。如果SF、TAST等铁代谢指标以及Hb没有达到目标值(每周ESAs 100~150 U/Kg治疗下)或口服铁剂不能耐受者,可改用静脉补铁治疗[155, 156,162, 163]。
2. 静脉铁剂治疗:(1)初始治疗阶段剂量:每月800~1 000 mg,1次或多次静脉滴注;若SF<500 μg/L和TAST<30%,可重复治疗1个疗程[159, 160,162, 163]。(2)维持治疗阶段:每1~2周100 mg,原则上SF>500 μg/L应暂停治疗[159, 160,162, 163]。(3)青壮年血液透析贫血患者可选择铁剂静脉给药每月400 mg,但应避免SF≥700 μg/L且TSAT≥40%[163]。(4)老年血液透析患者采取限制性静脉铁剂治疗。在血液透析结束后给予静脉铁剂40~50 mg/次,兼顾基线Hb水平,给药频率为每周1次,连续3个月;或者连续每次透析1次,累计13次[161,164]。
研究显示,CKD血液透析患者静脉铁剂治疗剂量超过2~3 g/年,腹膜透析患者静脉铁剂治疗剂量超过1~2 g/年,可能超过机体实际铁需求引起正铁平衡[76]。因此,日本透析治疗学会指南建议:除非存在明显铁缺乏的情况,CKD贫血患者应给予低剂量铁剂(100~200 mg/月)治疗;存在ESAs反应低下时,应考虑除铁缺乏以外的其他状况,并处理这些状况以提高铁的利用率,而不是单纯增加铁剂治疗剂量[164]。有研究观察老年血液透析患者对铁元素利用的变化特点,发现患者铁转运蛋白减少,铁转运蛋白受体增加[165]。因此,在大剂量静脉铁剂治疗时,铁元素不能有效利用,使血液游离铁增多,导致铁调素增加,抑制铁元素利用,不利于贫血纠正,并可能增加游离铁相关不良反应,包括感染及心血管事件风险增加[164]。2008年JSDT指南强烈推荐:血液透析患者在透析结束后缓慢静脉滴注铁剂,最佳剂量为40 mg/次(蔗糖铁)或50 mg/次(cideferron,枸糖铁);根据Hb水平给药频率为每周1次,连续3个月,或者连续每次透析1次,累计13次;总量分别为520 mg(蔗糖铁)或650 mg(枸糖铁);结束铁剂治疗后1周或更长时间应重新评估铁代谢指标[161]。来自DOPPS研究的数据进一步证实,日本老年血液透析患者静脉铁剂的使用剂量明显低于欧美患者,但Hb达标率与欧美患者接近,并且EPO的使用剂量明显减少,提示老年血液透析患者采用限制性静脉铁剂治疗具有更优的疗效和安全性[76,165]。
回顾性观察研究中CKD贫血患者铁剂治疗剂量与疗效和安全性的关系未能得到一致性结果[164]。58 058例血液透析患者队列研究结果显示,静脉铁治疗剂量>400 mg/月与更高的心血管死亡率密切关联[166]。117 050例血液透析患者中,短期内(1个月)大剂量给药与短期内(3个月)感染相关住院风险和死亡率增加相关,尤其是合并导管和近期感染史的患者风险最高,而维持给药或者低剂量给药感染相关住院或全因死亡的风险与未使用铁剂者无明显差异[167]。但Kshirsagar等[168, 169]同年发表的研究则得出相反的结果。13 249例老年[(76±7)岁]血液透析贫血患者的回顾性研究结果显示,SF>500 μg/L患者,2周内右旋糖酐铁剂量>500 mg增加感染和心血管死亡风险[170]。一项纳入了136例受试者,旨在对比口服铁剂与静脉铁剂治疗CKD 3~4期伴贫血患者eGFR下降速率的随机对照研究(REVOKE研究),由于观测到静脉铁剂应用组发生严重不良事件的风险升高而提前终止了试验[171]。2 141例SF<400 μg/L且TSAT<30%的年轻血液透析患者中位随访时间2年的多中心、随机、开放标签(PIVOTAL)研究发现,高剂量静脉铁剂(蔗糖铁400 mg/月,铁指标安全范围为SF 700 μg/L或TSAT 40%,超过则停药)纠正贫血疗效更优,而心血管事件及死亡、感染事件等严重不良反应与低剂量静脉铁剂治疗(蔗糖铁0~400 mg/月,治疗靶目标SF 200 μg/L且TSAT 20%)无明显差异[163]。同时,纳入了616例患者的FIND-CKD研究提示,静脉铁剂治疗组与口服铁剂治疗组之间,严重不良事件发生率无明显差异[164]。迄今为止,在观察性研究中静脉铁剂应用于CKD贫血患者的安全性仍然没有得到一致结论[172]。2019年公布结果的PIVOTAL研究揭示,对于血液透析伴随贫血的患者,预防性应用高剂量静脉铁剂相较于低剂量静脉铁剂,能够明显降低非致死心肌梗死等不良事件的发生率,感染以及住院发生率在两组间差异无统计学意义[163]。
过度铁剂治疗可引起机体铁代谢正平衡甚至铁超载。文献报道,血液透析患者铁超载发生率13.0%~37.5%[173, 174]。过多铁剂治疗后铁元素不能被完全利用合成Hb,而被肝脏网状内皮系统和骨骼肌细胞摄取后与铁蛋白结合成为储存铁,进而促进细胞内活性氧(ROS)的产生并导致细胞损伤。铁元素沉积在肝脏、脾脏等组织器官可造成不可逆损害[173, 174]。
基于多项国际指南,CKD患者SF<800 μg/L和TSAT<50%时,铁剂和ESAs治疗即可以保持Hb水平在110~120 g/L[175, 176]。观察性研究表明,SF水平相对较高的情况下,持续静脉铁剂治疗可以导致铁超负荷,增加静脉铁剂治疗的不良事件[177, 178, 179]。58 058例血液透析患者的队列研究结果显示,SF≥800 μg/L与高死亡率有关,但受到营养不良、炎症综合征等混杂因素的影响[166]。13 249例血液透析患者的回顾性研究表明,SF中高水平(500~800 μg/L)患者积极铁治疗增加感染和心血管死亡风险;与SF≥1 200 μg/L停药相比,SF<500~800 μg/L时停止静脉铁剂治疗心血管死亡风险较低[170]。
2001年NKF-KDOQI指南建议,铁剂治疗时铁代谢指标上限TSAT<50%和SF<800 μg/L[174]。KDIGO指南推荐,SF 500 μg/L且TSAT 35%作为铁剂治疗安全阈值上限[155]。NICE指南推荐,SF≥500 μg/L时,应减少铁剂治疗剂量,以避免SF>800 μg/L[21]。JSDT指南建议,铁超载指标水平为TSAT>50%,SF>800 μg/L;HRC%<10%,CHr>33 pg/红细胞,sTfR<1 000 μg/L[21]。KDOQI指南中提出,尚无充分证据确定停止铁剂治疗的SF上限水平,建议以权衡铁剂治疗的风险与获益来决定个体化铁剂治疗方案[174]。
口服铁剂的不良反应主要为不同程度的消化道症状,发生率约为60%[179]。最常见为便秘及恶心,通常比较轻微,因此铁剂应在饭后服用。口服铁剂过敏反应少见,表现为气短、胸痛、血管性水肿和荨麻疹等,严重过敏反应极少见,通常停止口服铁剂,对症处理即可恢复[35]。静脉铁剂不良反应及处理措施如下。
1. 过敏反应:严重过敏反应将危及生命。葡萄糖酸铁、蔗糖铁以及小分子右旋糖酐铁过敏反应发生率分别为0.9/百万、0.6/百万及3.3/百万[166,179]。
预防措施:迄今为止,尚无有效方法来预测超敏反应。故应在静脉铁剂输注前明确患者是否存在发生过敏反应的危险因素。出现以下临床特征的患者提示高危可能:既往存在对任何剂型的静脉铁剂出现过不良反应;中重度哮喘病史;已有对多种药物超敏或过敏史;存在自身免疫性疾病;肥大细胞激活相关疾病。高TSAT或低血浆转铁蛋白水平患者,若铁剂输注速度较快,引起循环中不稳定铁(二价铁)水平快速升高,激活氧自由基产生增加。若患者存在发生过敏反应的高危因素,则充分考虑静脉铁剂治疗潜在的风险,并应在输注时给予密切监测生命体征[166]。此外,静脉铁剂入血后,右旋糖酐铁释放铁的速度比其他分子小的剂型慢,因此建议蔗糖铁及葡萄糖酸铁单次输注剂量要小,以避免不稳定铁水平过高及潜在不良反应的风险[166,179]。
发生过敏反应处置:一旦出现过敏反应,视过敏反应的轻重程度决定处理措施。轻度过敏反应患者,2019年KDIGO肾性贫血指南建议,可停用一段时间后(通常至少15 min),在适当监测下尝试给予其他剂型的静脉铁剂治疗。再次给予静脉铁剂治疗时输液速度应减慢,若减慢输注过敏症状再现,必须停止输注并使用糖皮质激素及补液治疗[166]。重度过敏反应患者,必须立即停止输注;使用肾上腺素0.5 mg肌内注射或0.1 mg静脉注射,同时使用糖皮质激素;如出现气道水肿痉挛引起呼吸困难或哮喘症状,可同时给予雾化吸入β2受体兴奋剂、补液及面罩吸氧,严重者气管插管。上述处理后仍无好转需及时转入重症监护病房(ICU)[166,179](图2)。
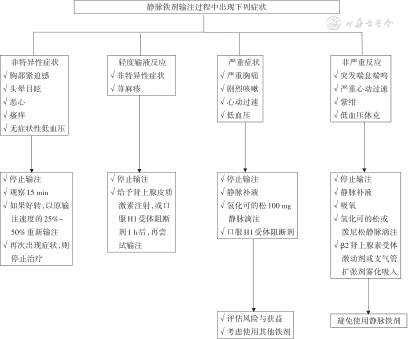

2. 轻微输液反应:轻微输液反应并不少见,一般表现为皮肤潮红、轻度胸部不适、头晕、恶心、瘙痒等。偶尔也会有无症状性低血压,但通常认为是非特异性反应而非过敏反应,除非既往已明确铁剂过敏。部分患者会出现肌痛或者关节痛(Fishbane反应),但通常为自限性,不需要抗组胺或者肾上腺素治疗。如果上述症状在暂停输注或减慢输注速度后得到缓解,即可判定为轻微输液反应,一般不需中止治疗[35,166,179]。
3. 低血压反应:输注铁剂可出现低血压,可能与输注过快、预防性使用抗组胺药如苯海拉明有关,通常无需特殊处理;如果不恰当地给予升血压药反而会引起血流动力学异常[35]。
4. 静脉铁剂外渗可导致局部皮肤反应:铁剂渗漏至输液处局部组织可引起疼痛、炎症反应、局部褐色变,严重时发生坏死。通常不需要特殊处理,严重时需要外科干预[35]。
1. 口服铁剂治疗:(1)口服铁剂应餐后服用,以减轻对胃肠道刺激作用[35]。(2)避免与降低胃液酸度的药物同时服用,降低口服铁剂的吸收,包括碳酸氢钠、氢氧化铝等碱性药物,以及抑制胃酸分泌的质子泵抑制剂和H2受体阻断剂类药物。(3)某些抗菌药物和中成药可以与铁剂发生化学反应,形成难以吸收或溶解度降低的复合物而影响口服铁剂的疗效。不宜与铁剂合用的药物包括四环素、氯霉素;含雄黄的中成药如六神丸、清热解毒丸等;含石膏、明矾、滑石的中成药如牛黄上清丸、明目上清丸等。(4)避免与影响铁剂吸收的食物或饮料同时服用,包括富含鞣酸的茶叶,含钙、磷丰富的食物如牛奶、花生仁等[35]。
2. 静脉铁剂治疗:(1)由于静脉铁剂治疗存在发生危及生命的超敏反应的风险。因此,静脉输注铁剂前应常规评估患者是否存在高危因素。(2)国际指南一致建议,首次使用静脉铁剂治疗,应对患者进行生命体征监护,并配备必要的急救药物[35,166,179]。此外,由于未与转铁蛋白结合的游离铁可增加铁剂输注不良反应的风险,建议单次透析静脉输注葡萄糖酸铁或蔗糖铁剂量分别不超过125 mg或200 mg[35,179]。(3)多数病原体代谢都需要铁元素。静脉铁剂输注可能使循环游离铁更容易被细菌和其他微生物所利用,促进细菌生长。过量铁元素还可以抑制中性粒细胞和T淋巴细胞功能,降低机体对病原菌的防御能力[180]。因此,建议在急性感染期间不使用静脉铁剂治疗,特别是当存在菌血症时。63例血液透析患者的研究结果显示,无论蔗糖铁或葡萄糖酸铁均增加患者发生菌血症风险[181]。559例血液透析患者研究结果显示,导管相关感染的患者静脉铁剂平均剂量高于无导管感染者[182]。尽管静脉铁剂治疗与感染风险相关性的证据并不充分,但KDIGO等多项指南的提出慎重推荐意见:静脉铁剂治疗需平衡潜在益处及风险,同时建议有活动性系统感染患者不使用静脉铁剂治疗[155,162, 163,183]。(4)过度静脉铁剂输注,可引起氧化应激损伤和机体铁超载导致肝脏、心脏、脾脏等重要脏器损害。故在铁剂治疗过程中,应动态监测铁代谢指标,避免过度铁剂治疗的作用[155,173]。
HIF-PHI有效治疗肾性贫血,包括非透析与透析CKD患者(1A);口服治疗可增加非透析CKD患者和腹膜透析患者治疗便利性(2,未分级)。
患者Hb<100 g/L,可考虑给予HIF-PHI治疗(2,未分级)。
HIF-PHI治疗肾性贫血应监测铁代谢状态,需要时联合铁剂治疗;口服铁剂治疗在多数患者达到和静脉铁剂同样的效果(2B)。
HIF-PHI治疗的Hb靶目标参考ESAs,维持Hb≥110 g/L,但不超过130 g/L(2,未分级)。
HIF-PHI起始剂量按照患者体重,并结合患者既往使用ESAs剂量以及基础Hb水平、铁代谢等多种因素确定(2C)。
HIF-PHI治疗期间应定期监测Hb,根据Hb水平调整剂量,维持Hb稳定在靶目标范围内(1B)。
HIF-PHI是一种新型治疗肾性贫血的小分子口服药物,通过抑制HIF脯氨酰羟化酶,稳定体内HIF水平,进而调控HIF信号通路下游靶基因的转录及表达。HIF-PHI通过促进机体内源性生理浓度的EPO生成及受体表达,促进与铁代谢相关蛋白的表达,同时降低铁调素水平,综合调控机体促进红细胞的生成[184, 185]。目前HIF-PHI中罗沙司他(Roxadustat,FG-4592,FibroGen,Astellas,AstraZeneca)已经在中国和日本上市,Vadadustat (AKB-6548,Akebia)、Daprodustat(GSK-1278863,GlaxoSmithKline)和Enarodustat已经在日本上市。Molidustat(BAY 85-3934,Bayer)正在临床研发阶段。罗沙司他是中国国家药品监督管理局批准上市的全球第一个HIF-PHI类药物,为肾性贫血患者提供了一种全新的治疗选择。
1. HIF的结构及分子生物学:HIF是由α和β亚单位组成的具有转录活性的异源二聚体,是调控机体应对氧浓度改变生理反应的关键转录因子。HIF-α亚单位受氧浓度调控,是调节亚单位,而β亚单位则呈持续性表达。HIF α亚单位存在3种亚型,分别为HIF-1α、HIF-2α、和HIF-3α。HIF-1α在人组织中普遍存在,参与能量代谢;HIF-2α的分布具有一定组织特异性,主要分布在肾脏(肾间质和肾小球细胞)、肝脏、肺、心肌、胰腺和小肠中,参与红细胞生成;HIF-3α亦广泛表达于各种组织,其功能未十分明确。HIFα和β亚单位在细胞核内形成功能二聚体,通过HIF-α C末端的转录激活区域(C-TAD)诱导辅激活蛋白p300/CBP 招募入核,与之形成DNA结合复合体,并结合于缺氧反应元件(hypoxia response element,HRE)的5′-TACGTG-3′位点,介导靶基因的转录和表达,引起细胞对低氧的一系列适应性反应,如红细胞生成、糖酵解、血管生成等[186, 187, 188, 189]。
HIF受脯氨酰羟化酶(prolyl hydroxylase,PHD)家族调控,PHD是Fe2+、2-酮戊二酸依赖的双加氧酶超家族成员,需要分子氧、2-酮戊二酸和Fe2+来催化其活化,PHD主要通过感受细胞内氧分压的变化发挥调节HIF作用。在常氧状态下,HIF-α处于不断合成和降解的动态过程中,HIF-α亚单位的两个脯氨酸残基通常被PHD家族的酶识别并羟基化,被羟基化后的HIF-α可被冯西佩尔林道肿瘤抑制蛋白(von Hippel-Lindau tumor suppressor protein,pVHL)识别,进而募集泛素连接酶E3,最终使HIF-α快速泛素化并被蛋白酶体降解。在低氧状态下,由于缺少氧分子作为协同底物,PHD活性减弱,PHD对HIF-α亚基的羟基化作用减弱,从而HIF-α免于经泛素化蛋白酶体途径降解,故HIF-α蛋白能稳定表达,并转移入细胞核与HIF-β结合形成二聚体,进一步与HRE结合介导靶基因转录与表达,发挥其转录因子的调控作用[190, 191]。
2. HIF-PHI药理机制:HIF-PHI药物主要是通过取代PHD必需的协同底物,或者是通过阻断酶催化位点干扰与PHD底物连接,减弱PHD对HIF-α的羟基化,减少常氧条件下HIF的降解,从而使HIF稳定表达,调控下游多个靶基因,主要包括上调EPO、EPO受体和铁调控相关基因表达发挥红细胞生成作用。
一方面,进入细胞核中的HIF与肾脏EPO基因5′端启动子上游或肝脏EPO基因3′端增强子中的HIF结合位点特异性相结合,促进机体EPO的表达,进而促进骨髓成熟红细胞的生成。另一方面,HIF也可上调十二指肠细胞色素B(DCytB)和二价金属离子转运体(DMT1)增加小肠对铁的吸收;上调转铁蛋白、TfR与胞质铜蓝蛋白促进铁的转运与利用;同时下调铁调素水平,减轻其抑制膜铁转运蛋白的作用,促进肝细胞和巨噬细胞释放铁,增加机体可利用的铁,改善铁代谢紊乱,促进机体红细胞的生成[192, 193, 194]。
在中国上市的罗沙司他(FG-4592)是一种小分子物质,可通过模拟机体低氧环境,可逆性抑制PHD活性,短暂性诱导HIF稳定表达,导致功能性HIF转录反应,从而调控下游基因,进而促进红细胞生成,改善肾性贫血。罗沙司他间歇性给药方式可以长期维持治疗效果,不会导致治疗敏感性下降。
HIF-PHI是肾性贫血治疗领域最新研发的一种小分子口服药物,可促进生理范围内EPO生成,同时下调铁调素水平,增加机体对铁的吸收、转运和利用,减少铁剂用量。另外,口服剂型的药物使患者用药更加便利。
中国透析患者的多中心、前瞻、随机对照研究结果显示,罗沙司他和阿法依泊汀均能有效提升血液透析与腹膜透析患者的Hb水平;但微炎症(基线CRP>4.9 mg/L)亚组分析中,基线Hb水平升高幅度,罗沙司他组大于阿法依泊汀组[(9±10) g/L比(3±11) g/L],并且罗沙司他的药物剂量未增加[195]。日本透析人群的随机、双盲、阳性对照研究也证实了相似的结果,罗沙司他组在伴有微炎症的血液透析患者中应用不需要增加剂量,但达依泊汀需要更高剂量来维持目标Hb水平[196]。透析患者多中心、开放标签研究汇总分析结果显示,无论既往是否接受过ESAs治疗,转换至罗沙司他的治疗后均可有效纠正肾性贫血,并维持Hb稳定[197]。
中国非透析CKD患者的多中心、前瞻、随机对照研究结果显示,罗沙司他组Hb水平相对于基线平均增加(19±12) g/L,而安慰剂组Hb水平较基线降低(4±8) g/L,证实罗沙司他可有效提升非透析CKD患者Hb水平[198]。此外,欧美的多项多中心、随机对照Ⅲ期临床研究也同样显示罗沙司他在非透析、腹膜透析和血液透析肾性贫血患者中治疗有效[199, 200, 201]。目前为止,尚未见罗沙司他与ESAs联合应用治疗肾性贫血的研究报道。
1. 治疗时机:中国CKD患者的罗沙司他Ⅲ期临床研究中,非透析CKD患者的Hb基线水平:70 g/L≤Hb<100 g/L,平均89 g/L[198];透析患者因已接受ESAs稳定治疗,转换成罗沙司他治疗时Hb基线水平9~12 g/L,平均为10.4 g/L[195]。日本一项在既往接受过ESAs治疗或尚未接受ESAs治疗的血液透析贫血患者的研究中,以Hb<100 g/L为纳入标准[196]。目前没有针对HIF-PHI起始治疗时机的研究,参考罗沙司他临床试验及结合ESAs治疗时机,建议HIF-PHI类药物治疗时机为Hb<100 g/L。
2. 起始剂量:基于中国患者的罗沙司他2项Ⅲ期临床研究结果,建议透析患者为每次100 mg(<60 kg体重)或120 mg(≥60 kg体重),非透析患者为每次70 mg(<60 kg体重)或100 mg(≥60 kg体重),口服给药,每周3次[195,198]。但需要结合患者体重、既往使用ESAs剂量以及基础Hb值、铁代谢以及营养状态等多种因素,个体化并以较小的起始剂量开始使用。
3. 剂量调整:基于中国患者的罗沙司他2项Ⅲ期临床研究结果,建议起始治疗阶段每2周进行1次Hb检测;根据患者当前的Hb水平及过去4周内Hb的变化,每4周进行1次剂量阶梯调整。若患者Hb在2周内增加>20 g/L且Hb值>90 g/L,则提早降低一个阶梯治疗。剂量阶梯包括20、40、50、70、100、120、150、200 mg;建议最大剂量为2.5 mg/kg,剂量调整方法见表4。

罗沙司他剂量阶梯调整方案
罗沙司他剂量阶梯调整方案
过去4周 Hb变化 (g/L) | 剂量调整时Hb水平(g/L) | |||
|---|---|---|---|---|
| <105 | 105~<120 | 120~<130 | ≥130 | |
| <-10 | 增加 | 增加 | 无变化 | 暂停给药,监测Hb;当 Hb<120 g/L,降低一 个阶梯剂量,恢复 给药 |
| -10~10 | 增加 | 无变化 | 降低 | |
| >10 | 无变化 | 降低 | 降低 | |
注:Hb为血红蛋白
包括6项RCT研究1 001例非透析CKD患者和透析患者的荟萃分析结果显示,在非透析CKD患者中,与安慰剂组相比,罗沙司他组铁调素水平降低38.5 ng/dl,铁蛋白水平降低52.2 μmol/L,TIBC增加14.1 μmol/L,TSAT降低2.07%;在透析患者中,与ESAs组相比,罗沙司他组铁调素水平降低27.7 ng/dl,铁蛋白水平降低7.3 μmol/L,TIBC增加13.6 μmol/L,TSAT升高3.7%[202]。
血液透析和腹膜透析患者中的随机开放标签研究结果显示,罗沙司他治疗期间,口服铁剂与静脉铁剂具有相同的升高Hb疗效。中国患者试验数据显示应用罗沙司他联合口服铁剂可有效治疗肾性贫血[195,198]。众多研究证实HIF-PHI可降低铁调素与铁蛋白水平,升高转铁蛋白与TIBC[184,195,198],提示罗沙司他治疗可增加铁利用而降低铁储备,同样需要铁剂治疗。但是,目前HIF-PHI治疗时铁剂的治疗时机、铁状态指标的监测时机与频率、合适的铁剂治疗靶目标仍尚未明确。建议参照ESAs治疗肾性贫血的相关建议执行。
目前肾性贫血治疗的Hb靶目标是基于ESAs类的相关研究推荐。但是,HIF-PHI类药物是在生理范围内提高EPO水平,不存在大剂量ESAs时体内EPO水平的过度升高。因此,HIF-PHI治疗肾性贫血的Hb靶目标能否提高?获得进一步的获益还有待于深入研究。目前建议HIF-PHI治疗肾性贫血的Hb靶目标参考ESAs,维持Hb≥110 g/L,但不超过130 g/L。
1. 老年患者:65岁以上患者无需调整起始剂量。
2. 儿童患者:18岁以下患者中使用罗沙司他的安全性和有效性尚未确立。
3. 肝功能损害患者:轻度或中度肝功能损害患者无需调整起始剂量;对于严重肝功能损害患者,罗沙司他的安全性与有效性目前尚无使用经验。
4. 孕妇与哺乳期女性禁用罗沙司他。
目前罗沙司他已经在20余个国家开展了20项临床研究,接受罗沙司他治疗的患者超过1万人。但是,由于受HIF调控的下游靶基因众多,并且作为新上市的药物,HIF-PHI安全性尚需要更长时间和更多受试者应用后来确定[184,195, 196, 197, 198,203]。
基于中国患者的罗沙司他2项Ⅲ期临床研究结果,发生率>5%的不良事件包括上呼吸道感染、高血压、高钾血症、外周水肿、代谢性酸中毒、恶心、虚弱及转氨酶异常。
1. 血压异常:在中国CKD患者罗沙司他的Ⅲ期临床试验中,罗沙司他治疗期间高血压发生率,非透析患者为6%,透析患者为12.3%;透析患者低血压发生率为4.9%。基础研究中HIF-PHI(Molidustat)显示出降低血压的作用[204],但其药理机制尚不明确。同样,罗沙司他引发高血压的药理机制也不清楚。罗沙司他是否与ESAs一样,通过升高红细胞,改善末梢小动脉缺氧而增加血管收缩,引发血压升高?也有待进一步研究。因此,罗沙司他治疗前、治疗开始和治疗期间应对血压进行监测。
2. 高钾血症:在中国CKD患者的罗沙司他的Ⅲ期临床试验中,罗沙司他治疗期间高钾血症发生率,非透析患者为16%(安慰剂对照组为8%),透析患者为7.4%(阿法依泊汀组为1%)。罗沙司他治疗期间高钾血症的发生机制尚不明确。但建议HIF-PHI类药物治疗期间定期检测血钾水平。
3. HIF-PHI心血管安全性[205]:2 781例非透析CKD患者的多中心、随机、双盲、安慰剂对照研究结果显示,罗沙司他组与安慰剂组的心血管不良事件发生率分别为22.8%和21.3%,充血性心力衰竭、急性心肌梗死等严重心血管不良事件发生率分别为12.6%和11.4%,两组间无明显差异。提示罗沙司他治疗非透析CKD患者,未增加心血管事件的风险。
4. 肿瘤风险:基础实验中,HIF-PHI治疗对NeuYD乳腺癌小鼠的肿瘤发生和现有肿瘤表型没有影响;CD-1小鼠(免疫缺陷小鼠)和SD大鼠的长期暴露于罗沙司他(104周)后肿瘤风险没有增加[206, 207]。多中心、单臂、随机对照试验中,非透析 CKD 3~5期和透析CKD 5期肾性贫血患者,每天1次GSK1278863 (10或25 mg)28 d,血管内皮生长因子(VEGF)水平在治疗过程中无明显变化,但组间变异较大[208]。
1. Hb水平监测:在CKD患者中,建议Hb水平稳定在靶目标内。过高Hb水平可能增加血栓栓塞、血管通路血栓形成的风险。
2. 严重肝损害的患者:罗沙司他在重度肝功能受损的患者(Child Pugh C级)中的有效性和安全性尚未确立。对于重度肝功能受损的患者,治疗需在仔细评估患者的风险/获益后进行。在剂量调整期间应对患者严密监测。
3. 运动员慎用。
4. 药物与药物相互作用:与他汀类药物联用时可导致他汀类药物曲线下面积(AUC)和峰浓度(Cmax)增加。建议与罗沙司他合并用药时应考虑减少他汀类药物剂量并监测他汀类药物的不良反应。与碳酸司维拉姆、醋酸钙联用时,使用前后至少间隔1 h服用罗沙司他。
基于体重计算的合适剂量ESAs治疗1个月后,Hb较基线值未增加定义为ESAs初始治疗低反应性;为维持Hb稳定需要2次增加ESAs 剂量且增加的剂量超过稳定剂量的50%定义为获得性ESAs低反应(2D)。
对于肾性贫血治疗低反应的患者,应评估是否存在加重肾性贫血的危险因素及是否合并其他导致贫血的疾病,并针对病因治疗(1,未分级)。
ESAs低反应的患者应避免ESAs使用剂量超过起始剂量或稳定剂量的2倍(2D)。
对于纠正肾性贫血治疗低反应病因后仍存在ESAs低反应的患者,应权衡高剂量ESAs或输血治疗的获益和风险,个体化选择治疗(2,未分级)。
肾性贫血治疗低反应是指合适剂量的ESAs/HIF-PHI治疗后,不能达到和(或)稳定维持Hb靶目标。其中,ESAs低反应性定义:按照患者体重计算的适量ESAs治疗1个月后,Hb水平较基线值无明显增加;或稳定剂量的ESAs维持治疗期间,为维持Hb稳定需要2次增加ESAs剂量且增加的剂量超过稳定剂量的50%[35]。HIF-PHI低反应定义目前尚不清楚;并且,由于HIF-PHI初始剂量与最大剂量之间的差距较小,难以参照ESAs低反应性定义HIF-PHI低反应性。
肾性贫血治疗低反应最主要的原因是铁缺乏和ESAs低反应性。但也包括慢性炎症状态、恶性肿瘤、免疫性疾病的活跃、透析不充分、继发性甲状旁腺功能亢进、铝中毒、营养不良、叶酸或维生素B12缺乏、血液系统肿瘤(如多发性骨髓瘤和骨髓增生异常综合征等)、地中海贫血、骨髓纤维化、rHuEPO抗体引起PRCA、脾亢进、左卡尼汀缺乏、容量负荷过重、药物相互反应等加重肾性贫血的危险因素及合并其他贫血性疾病。
依据铁状态评估结果,对于存在绝对铁缺乏的患者,静脉或口服铁剂治疗,具体治疗详见前述“铁剂治疗”;对于SF 500~800 μg/L、存在功能性铁缺乏的患者,可尝试HIF-PHI治疗,通过下调铁调素,提高铁剂的利用,详见前述“HIF-PHI治疗”。
1. ESAs低反应性定义及类型:EPO低反应性指皮下注射rHuEPO达到每周300 U/kg(20 000 U/周)或静脉注射rHuEPO达到每周500 U/kg(30 000 U/周),治疗4个月后,Hb仍不能达到或维持靶目标值。
1 872例CKD患者的TREAT研究中,起始给予基于体重计算的2倍达依泊汀α剂量后,Hb升高<2%定义为达依泊汀α起始低反应性[209]。
按照患者体重计算的适量ESAs治疗1个月后,Hb水平与基线值相比无增加,为ESAs初始治疗低反应。稳定剂量的ESAs治疗后,为维持Hb稳定需要2次增加ESAs剂量且增加的剂量超过稳定剂量的50%,为获得性ESAs低反应[35]。
2. ESAs低反应性的病因:最常见病因为铁缺乏,其他病因包括合并炎性疾病、慢性失血、甲状旁腺功能亢进、纤维性骨炎、铝中毒、Hb病、恶性肿瘤、营养不良、溶血、透析不充分、应用血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、脾功能亢进、rHuEPO抗体介导的PRCA、左卡尼汀缺乏等情况。对ESAs治疗反应低下患者不应简单增加ESAs剂量,而应对上述病因进行排查和诊断,并针对性给予处理或治疗。
3. ESAs低反应性的处理:(1)评估患者ESAs低反应性的类型,筛查潜在病因,针对ESAs低反应性的特定病因进行治疗。(2)对于处理和治疗病因疾病后仍存在ESAs低反应性的患者,建议采用个体化方案进行治疗,并评估Hb下降、继续ESAs治疗和输血治疗的风险。(3)ESAs治疗初始和获得性治疗反应低下患者,最大剂量不应高于初始剂量或稳定剂量(基于体重计算)的2倍。(4)评估ESAs冷链运输和保存的规范性:rHuEPO-β注射液(罗可曼)的说明书建议储存于2~8 ℃。运输时冷藏温度如遭间断,时间不可超过5 d及温度不可超过25 ℃。而大多数ESAs建议2~8 ℃保存,不允许冷链中断,或未提及运输时冷藏温度如遭间断的时间和温度的安全范围。故血液透析中心在ESAs的冷链运输和储存中,应特别留意温度的控制。(5)酌情考虑换用rHuEPO-β注射液:rHuEPO-α和β均能有效促进红细胞的生成,但两者也存在一些细微的差异。以rHuEPO-β(罗可曼)为例,在生物学特征中罗可曼的基本异构体的比例更高,并显示出更高的生物活性。在药物动力学方面,罗可曼的糖基含有的唾液酸残基比较多,具有更长的半衰期,并且能产生明显的血清浓度和网状细胞反应[210]。(6)酌情纠正左卡尼汀缺乏:左卡尼汀可以改善EPO抵抗,使透析患者贫血治疗额外获益。血液透析患者随机对照试验证实,左卡尼汀20 mg·kg-1·d-1口服治疗1年,与对照组比较,EPO反应性指数(rHuEPO/Hb)明显降低(6.9±3.5比对照组8.9±3.3)[211, 212]。目前尚无口服左卡尼汀或经腹膜透析液补充左卡尼汀使透析患者贫血治疗获益的证据[213]。(7)酌情考虑HIF-PHI治疗:罗沙司他治疗中国血液透析患者肾性贫血的ESAs抵抗人群亚组分析中,入组前接受稳定剂量ESAs治疗,但基线Hb<100 g/L的患者中,在罗沙司他治疗26周后,94.4%的患者Hb≥100 g/L,83.3% 的患者达到Hb≥110 g/L[195]。在日本血液透析患者肾性贫血的ESAs抵抗人群亚组分析中也获得了相似的结果[196]。但是,由于亚组时候分析的患者数量较少,基线不一致,尚待进一步的大样本随机对照研究来证实[214]。
炎症性贫血也被称为慢性病贫血,是老年人和慢性病患者最常见的贫血原因之一。炎症性贫血发病率居贫血发病原因的第2位,仅次于缺铁性贫血。炎症性贫血与慢性感染、风湿病和癌症等有关,也包括慢性肾性贫血、充血性心力衰竭以及器官移植引起的贫血[154,215]。
炎症性贫血的诊断可依据sTfR/logSF水平[53,216],sTfR/logSF<1 提示炎症性贫血,sTfR/logSF>2提示缺铁性贫血合并炎症性贫血,即功能性铁缺乏[217]。
炎症性贫血治疗的主要原则是治疗原发基础疾病。然而当炎症反应呈慢性、很难控制或诊断不明时,输血、静脉补铁和ESAs可以改善病情。轻度贫血一般不需治疗,Hb<90 g/L时需要治疗。新的治疗策略也有可能用于炎症性贫血的治疗,抑制白细胞介素6(IL-6)活性和调节Erythroferrone-铁调素轴以及HIF-PHI下调铁调素,可提高铁剂的利用。在中国透析患者的罗沙司他Ⅲ期临床试验的炎症亚组分析中,以CRP 4.9 mg/L为截点,罗沙司他对CRP>4.9 mg/L者也能有效升高和维持Hb水平[195]。
以网织红细胞百分数升高和Coombs试验阳性为诊断主要依据。明确自身免疫溶血性贫血的患者,可行激素和(或)免疫抑制剂治疗,但需要防治急性感染加重或消化道出血等激素和免疫抑制剂的不良反应。
对于ESAs治疗过程中出现进行性严重贫血的患者,如满足Hb每周5~10 g/L的速度下降,伴网织红细胞计数<10×109/L,而外周血的血小板和白细胞计数正常,骨髓幼红细胞系列显著减少,甚至完全缺乏,粒细胞和巨核细胞系列增生正常,血清抗EPO抗体检测阳性,则可确诊EPO抗体介导PRCA。确诊后应停用所有的ESAs制剂,必要时输血纠正严重贫血,也可试用免疫抑制剂、雄激素、大剂量静脉丙种球蛋白或血浆置换治疗,最有效的治疗是肾移植。
对伴有重度脾功能亢进的血液透析重度贫血患者,可以考虑行微创介入治疗——部分脾动脉栓塞术,可改善红细胞、白细胞和血小板数量减少。
骨髓增生异常综合征一组异质性恶性造血干细胞疾病,特征包括血细胞异型增生、无效造血以及程度不一的急性白血病转化风险。骨髓增生异常综合征患者的红细胞、血小板和成熟粒细胞有不同程度的生成减少,还会出现功能缺陷;这些异常通常会引起贫血、出血和感染风险升高。在其难治性贫血的亚型中,其原始细胞<5%。结合骨髓活检和患者临床表现可诊断骨髓增生异常综合征,可通过免疫抑制剂治疗获得缓解。
针对透析不充分、继发性甲状旁腺功能亢进[218]、铝中毒、营养不良、叶酸或维生素B12缺乏、血液系统肿瘤/多发性骨髓瘤、地中海贫血、骨髓纤维化、容量负荷过重、药物相互反应等进行病因和对症治疗。临床研究结果提示,使用高通量透析器的高容量在线血液透析滤过可有效降低铁调素,改善EPO抵抗[219]。
对于纠正肾性贫血治疗低反应病因后仍存在ESAs低反应的患者,应根据患者的临床状况决定是否ESAs或输血治疗,同时权衡高剂量ESAs或输血治疗的获益和风险。
PTA治疗Hb目标值为125~130 g/L(2B)。
PTA的铁剂治疗参照CKD贫血患者(2,未分级)。
移植早期PTA不建议使用ESAs治疗(2C)。
除了紧急情况下,不建议肾移植患者输血治疗(2C)。
应关注药物诱发的PTA,并依据患者病情合理选择药物(1D)。
PTA分为:(1)移植早期PTA:肾移植术后6个月之内合并的贫血;(2)移植后期PTA:移植术后6个月之后发生的贫血。移植早期PTA发病率约50%,最常见的原因为铁缺乏,围手术期的血液丢失以及营养不良;移植后期PTA发病率25%~35%[220, 221, 222],主要与肾功能减退相关。
CAPRIT 研究[223]将Hb分为正常组(130~150 g/L)和部分纠正组(105~115 g/L)。正常组移植术后肾功能的保存及心血管事件均优于部分纠正组。尽管该研究样本量较小(n=125),随访时间较短(2年),但其为目前唯一一项评估PTA治疗靶目标的临床随机对照研究。因此建议PTA的治疗靶目标高于其他CKD患者。
肾移植后24 h之内患者血清EPO立即升高9倍;随后下降,在术后4~6 d达到低点,此后再次升高,16周达到峰点[226]。一般移植后数周,体内EPO水平即能达到正常水平。研究显示,移植后早期使用ESAs不能改善贫血情况以及保护肾功能[225,227]。
研究显示[228],肾移植1年内进行过输血治疗的患者,供体特异性抗体(DSA)明显高于非输血患者,且术后抗体介导的排斥反应(AMR)亦高于非输血组。因此,除非紧急情况下,如移植术后大出血,一般不建议肾移植患者进行输血治疗。
AKI合并贫血患者应作全面检查和系统评估,明确贫血的病因诊断以及影响贫血程度与治疗反应的各种因素(1,未分类)。
AKI合并贫血患者应针对不同原发病和病因给予相应的治疗(1,未分类)。
AKI合并肾性贫血时,可使用ESAs治疗,具体治疗方案同CKD肾性贫血(2D)。
基于目前循征证据,不支持ESAs预防和治疗AKI(1A)。
建议开展HIF-PHI预防和治疗AKI以及AKI合并肾性贫血的临床研究(2,未分类)。
AKI患者常常合并贫血,约90%的院内获得性AKI患者发生贫血[231, 232]。AKI患者贫血的病因可根据是否由肾功能损伤引起分为2类:(1)肾功能损伤引起的肾性贫血,贫血的发病机制同CKD患者的肾性贫血;(2)非肾功能损伤引起的贫血,包括发生AKI存在的慢性贫血和(或)大出血、溶血、药物、严重感染、骨髓移植、多发性骨髓瘤等血液系统肿瘤等导致AKI的疾病和病因直接引起的贫血。肾性贫血发病机制为EPO产生减少、毒素潴留导致的红细胞寿命缩短等,发病需要一定的时间和潜伏期,故一般出现在较长AKI病程的患者。
贫血的诊断标准同CKD肾性贫血。首先应诊断贫血是否为引起AKI的病因或疾病所致,仔细排查有无大出血、溶血、严重感染、药物等所致骨髓抑制、多发性骨髓瘤等血液系统肿瘤;其次应诊断是否存在AKI发病前的慢性贫血,包括缺铁等营养性贫血、地中海贫血和镰状红细胞性贫血等遗传性疾病、再生障碍性贫血等骨髓增生异常疾病等;排除上述疾病引起的贫血,可初步诊断为肾性贫血。AKI合并贫血时尤应全面检查和系统评估各种贫血的可能病因和影响贫血程度与治疗反应的各种因素。
206例接受透析治疗的AKI前瞻性观察队列研究结果显示,危重AKI患者的贫血与死亡率增加相关[233];但211例AKI患者的回顾性研究提示贫血与肾脏恢复和死亡率无明显相关性[231];210例危重患者的回顾性研究也提示贫血并不增加AKI进展风险[234]。上述研究均通过输血治疗贫血,随后未有相关研究。
AKI患者的贫血治疗首先是针对不同原发病和病因给予相应的治疗,包括及时有效止血,积极控制感染和溶血,及时停用有骨髓抑制作用的药物,适时规范补充铁剂等。AKI病程较长且肾功能未恢复或AKI病程难以确定但可明确排除其他非肾性贫血患者,可应用ESAs治疗[235]。ESAs治疗方案同CKD肾性贫血。
ESAs除改善贫血外,体内和体外研究显示具有潜在抗凋亡、促增殖、抗氧化、减轻炎症反应和促血管新生作用,可能具有预防和治疗AKI作用[217,236, 237, 238, 239, 240]。在啮齿类动物构建的肾脏缺血/再灌注损伤、脓毒症和横纹肌溶解AKI模型中发现ESAs可改善肾功能[217,237,240]。但是EARLYARF试验结果显示,ESAs治疗未改善AKI患者的预后[241]。心脏术后ESAs治疗的临床研究中,也未证实ESAs的肾脏保护作用和抗炎作用[242]。2012年KDIGO指南建议对ESAs预防AKI开展随机对照研究,包括EPRICS试验在内的5项心血管手术前使用ESAs的临床研究,初步证实其术前使用的安全性,但对其肾脏保护有效性结论尚存在较大争议,大多数研究结果提示ESAs并不降低心脏手术患者的AKI风险和改善患者预后。同时研究还发现ESAs对心脏术后Hb的影响较小[243, 244, 245, 246, 247]。
体内和体外研究均证实HIF-PHI通过稳定HIF-1α、激活HIF下游靶基因,从而减轻缺血再灌注损伤,具有肾脏保护作用[248, 249]。此外,Roxadustat通过上调HIF-1α,减少细胞凋亡和炎症反应,减轻顺铂诱导的肾脏损伤[250]。最新研究提示HIF-PHI对缺血性肾脏的保护作用与其上调糖原合成有关[251],然而目前尚未有HIF-PHI应用于AKI的临床研究。
儿童肾性贫血的诊断标准:0.5~5.0岁,Hb<110 g/L;>5.0~12.0岁,Hb<115 g/L;>12.0~15.0岁,Hb<120 g/L;15岁以上男性Hb<130 g/L,女性Hb<120 g/L(1,未分级)。
儿童肾性贫血治疗时机:Hb<110 g/L(2D)。
儿童肾性贫血治疗的靶目标:Hb 110~130 g/L(2,未分类)。
铁剂治疗时机:无论是否应用ESAs,SF<100 μg/L且TSAT<20%,应给予铁剂补充(1D)。
铁剂治疗途径:非透析和腹膜透析的肾性贫血CKD患儿优先选择口服铁剂;血液透析患儿建议静脉铁剂(2,未分类)。
铁剂治疗的靶目标:非透析和腹膜透析CKD患儿SF维持在100~500 μg/L,血液透析患儿维持SF 200~500 μg/L(2,未分类)。
静脉铁剂停止治疗时机:SF>300 μg/L,TSAT>50%(2,未分类)。
ESAs治疗时机:开始ESAs治疗的Hb水平应个体化,并评估治疗利弊(2D)。
ESAs治疗剂量:单位体重剂量略高于成人(2,未分类)。
符合器官移植要求的CKD贫血患儿,应尽可能避免红细胞输注(1C)。
CKD贫血患儿,应根据临床表现,而非Hb水平决定是否输血(2,未分类)。
贫血是CKD患儿常见并发症,与儿童智力发育、体格发育迟滞、心血管并发症、住院率和死亡率增加密切相关。与成人相比,儿童肾性贫血发生较早,进展速度快。对儿童肾性贫血的管理是CKD一体化治疗的重要组成部分,具有非常重要的临床意义。虽然铁剂及EPO的治疗已广泛用于儿童肾性贫血的治疗,但是一些新药如HIF稳定剂和铁调素调节剂尚在研究中,还未在儿童CKD中应用。由于儿童生长发育的特点,儿童肾性贫血的诊断标准因年龄而异,启动贫血治疗的时机和靶目标与成人略有不同。本章节将重点阐述儿童肾性贫血的诊治特点。
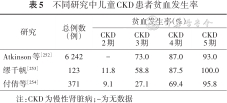
贫血是儿童CKD最常见并发症之一。2010年北美小儿肾移植协作组(NAPRTCS)数据显示,随着CKD进展贫血发生率和严重程度逐渐增加,CKD患儿贫血发生率:3期73%、4期87%、5期>93%[252];中国数据显示,CKD患儿贫血发生率:2期9.09~11.80%、3期27.12~58.50%、4期69.35~87.50%、5期95.82~100%[253, 254](表5)。值得注意的是,根据国际儿童腹膜透析协作网(IPPN)数据,即使90%以上CKD患儿使用ESAs治疗,但仍有1/4的腹膜透析患儿Hb仍低于目标水平[255]。因此,中国儿童CKD患者肾性贫血的防治工作有待进一步加强和重视。
1. 儿童肾性贫血的诊断标准:儿童贫血的定义为Hb水平低于正常同年龄同性别儿童的第5百分位数。Hb水平参照2008年世界卫生组织(WHO)颁布的儿童贫血标准[256]:0.5~5岁,Hb<110 g/L;5~12岁,<115 g/L;12 ~15岁,<120 g/L;15~18岁,男性<130 g/L,女性<120 g/L。
儿童肾性贫血的诊断流程及检测项目与成人一致。明确贫血诊断后应评估是否存在肾性贫血之外的贫血性疾病,除外营养不良性贫血、溶血性贫血、出血性贫血及血液系统疾病等,才能诊断肾性贫血;并应进一步评估是否存在加重肾性贫血的危险因素。
2. 儿童肾性贫血的监测:儿童肾性贫血同样应定期监测血常规、网织红细胞和铁代谢指标,具体指标同成人。CKD患儿的Hb检测频率建议依据有无贫血史、CKD分期及是否行腹膜透析或血液透析治疗[257, 258](表6)。
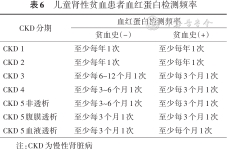
儿童肾性贫血患者血红蛋白检测频率
儿童肾性贫血患者血红蛋白检测频率
| CKD分期 | 血红蛋白检测频率 | |
|---|---|---|
| 贫血史(-) | 贫血史(+) | |
| CKD 1 | 至少每年1次 | 至少每年1次 |
| CKD 2 | 至少每年1次 | 至少每年1次 |
| CKD 3 | 至少每6~12个月1次 | 至少每3个月1次 |
| CKD 4 | 至少每3~6个月1次 | 至少每3个月1次 |
| CKD 5非透析 | 至少每3~6个月1次 | 至少每3个月1次 |
| CKD 5腹膜透析 | 至少每3个月1次 | 至少每3个月1次 |
| CKD 5血液透析 | 至少每3个月1次 | 至少每个月1次 |
注:CKD为慢性肾脏病
1. 治疗时机:儿童CKD贫血发生早、进展快,如延误治疗可增加输血风险[252]。研究显示,与Hb≥110 g/L组CKD患儿相比,Hb<110 g/L组患儿左心室肥厚发生率高[259],透析后1年的住院风险、死亡风险明显增加[260],而且生活质量也明显降低[261]。因此,建议儿童肾性贫血治疗时机为Hb<110 g/L,要早于成人CKD患者。
2. 治疗Hb靶目标:儿童肾性贫血治疗的靶目标低限为Hb正常值下限(110 g/L),靶目标上限尚不明确,缺乏高质量循证医学数据支持。与成人相比,儿童合并动脉粥样硬化、高血压等基础疾病相对较少,并且儿童处于生长发育期,因此较高Hb水平可能具有更好的获益。研究发现Hb≥120 g/L组腹膜透析患儿的生活质量优于Hb<110 g/L组和110~120 g/L组[255]。因此,建议儿童肾性贫血Hb靶目标上限为120~130 g/L。
3. 铁剂治疗:对于儿童肾性贫血治疗,无论是否应用ESAs,均应首先保证体内铁充足,避免绝对铁缺乏或功能性铁缺乏。体内铁充足的定义:HRC%<6%,或CHr>29 pg,或SF>100 μg/L且TSAT>20%[256,262]。
铁剂补充的途径包括口服和静脉。非透析和腹膜透析的CKD贫血患儿建议优先选择口服途径补充铁剂,口服铁元素的剂量为2~3 mg·kg-1·d-1,最大剂量为6 mg·kg-1·d-1,单日最大剂量为150~300 mg,单次或分2~3次给药[258];也可根据贫血程度、铁剂治疗反应和不良反应、建立静脉通路的可行性以及是否ESAs治疗选择口服或静脉铁剂治疗。如果使用静脉铁剂,一般采用大剂量、低频次的治疗方式,同时也应考虑建立CKD患儿及其家属的意愿、护理和治疗成本、当地静脉铁剂的价格以及急救设施的配备等情况。血液透析的贫血患儿建议选择静脉铁剂[256,258,262]。每次1~2 mg/kg,单次最大剂量<100 mg,每2周1次,1个疗程累计总量不超过1 g[258]。对于重度贫血、铁储备严重缺乏的患儿,可以考虑给予负荷量的静脉铁剂6 mg·kg-1·d-1,单次最大量<200 mg,2周之后给予维持量每次1~2 mg/kg[263]。
对于口服铁剂的CKD患儿,建议每3个月评估1次铁代谢指标。对于静脉铁补充的CKD患儿,建议每个月测定铁代谢指标,避免铁中毒。SF和TSAT同时明显升高提示CKD患儿铁超负荷。SF持续超过800 μg/L,并排除炎症(CRP正常),提示可能存在铁超负荷。建议非透析和腹膜透析CKD患儿SF维持在100~500 μg/L,血液透析患儿SF维持在200~500 μg/L[44];SF>300 μg/L且TSAT>50%应停用静脉补铁[161,258]。
4. ESAs治疗:ESAs主要包括短效的rHuEPO(α或β)和长效的达依泊汀α(Darbepoetin-α)和CERA,目前中国CKD贫血患儿大多使用rHuEPO-α。
ESAs治疗前首先应纠正铁缺乏和机体炎症状态。存在绝对铁缺乏(SF<100 μg/L)时,不应开始ESAs治疗;存在功能性铁缺乏时,可以先给予铁剂治疗或ESAs与铁剂同时治疗。ESAs治疗前需评估治疗获益和潜在危害。一方面ESAs可以减少输血,改善患儿贫血症状、生活质量,但另一方面ESAs具有高血压、促进肿瘤进展等不良反应。
ESAs治疗剂量:儿童与成人相比,具有较高的代谢清除率;因此儿童ESAs单位体重治疗剂量高于成人。ESAs起始治疗剂量应根据CKD患儿的Hb水平、体重和临床情况决定。rHuEPO初始剂量一般为每周80~120 U/kg,分2~3次给药;对于5岁以下儿童或透析患儿,常需要较高剂量rHuEPO。建议达依泊汀α初始剂量为0.45 μg/kg,每周1次或0.75 μg/kg,每2周1次[260]。目前研究证实了CERA治疗腹膜透析患儿贫血的安全性和有效性[264],但在中国尚未进入临床。
ESAs治疗途径:根据CKD分期、治疗模式、有效性、安全性和ESAs种类,选择ESAs的给药途径。非血液透析的CKD患儿适宜皮下注射,而血液透析患儿可皮下或静脉注射[256,262]。
ESAs治疗频率:根据CKD分期、治疗模式、疗效、患儿耐受程度及意愿和ESAs种类,决定ESAs治疗频率。血液透析患儿使用短效ESAs应每周3次给药[256]。
ESAs用药注意事项:ESAs治疗期间需定期监测贫血指标,评估ESAs治疗反应。在开始治疗或改变剂量后,每1~2周检测1次Hb水平。Hb水平达标且稳定后,非透析CKD患儿应至少每3个月检测1次Hb水平,透析患儿应至少每月检测1次Hb水平[256,258]。
ESAs治疗低反应,根据ESAs初始治疗期和维持期的疗效分为ESAs初始治疗低反应和获得性低反应。ESAs治疗低反应的定义:每周皮下注射EPO(epoetin)>300 U/kg或每周静脉注射EPO 450 U时,Hb仍不能达标。出现ESAs治疗低反应时,应进一步评估铁缺乏等加重贫血的危险因素以及其他非肾性贫血的贫血性疾病。
ESAs治疗期间需注意ESAs相关性高血压。合并肿瘤病史者需慎用ESAs。
ESAs引起PRCA是ESAs低反应的罕见原因,因此不需要常规对接受ESAs治疗的CKD患儿进行抗EPO抗体检测。但CKD患儿接受8周以上ESAs治疗并出现以下情况时,需考虑ESAs引起的PRCA:(1)突然发生Hb每周下降5~10 g/L或每1~2周需要输血1次;(2)外周血白细胞和血小板计数正常;(3)网织红细胞绝对计数<10 000/μl。出现ESAs引起的PRCA时,应停用所有的ESAs治疗。当停用ESAs治疗后患儿仍需输血支持时,应根据抗EPO抗体的滴度决策免疫抑制剂的治疗[256,262]。
5. 输血治疗:CKD患儿输血需慎重。对于CKD患儿尤其等待肾移植者,应尽量避免输血以减少同种致敏的风险,只有权衡利大于弊时才考虑输血治疗。对于慢性贫血,不应盲目追求Hb靶目标,而因根据患儿是否有贫血症状再决定是否需要输血;对于ESAs低反应,或存在肿瘤病史等慎用ESAs治疗时,也应在权衡利弊后决定是否输血。对于急性失血、急性溶血、脓毒症等严重感染,或需要在手术前迅速提升Hb水平患儿,在权衡利弊后决定是否输血[256,262]。
老年肾性贫血的诊断标准参照成人标准,男性Hb<130 g/L或女性 Hb<120 g/L(2,未分级)。
老年肾性贫血治疗时机:Hb<100 g/L(1,未分级)。
老年肾性贫血治疗的靶目标参照成人标准:Hb 110~130 g/L,但需个体化调整(1D)。
铁剂与ESAs治疗时机、途径、靶目标参照成人标准(2,未分级)。
老年发生ESAs低反应率高。Hb<70 g/L且有贫血症状需考虑输血(2,未分级)。
老年人是贫血的高发人群。65岁以上普通人群贫血患病率约10%~11%,并且年龄越大,贫血患病率越高,85岁以上普通人群贫血患病率20%。CKD是导致老年贫血的重要原因。老年CKD贫血与多种并发症密切相关,增加心绞痛、心衰等心血管疾病的发生风险,加重认知功能障碍,增加住院率和死亡率,增加摔倒和骨折风险,影响生活质量[265]。
老年CKD贫血缺少明确定义,目前采用的标准为男性Hb<130 g/L或女性Hb<120 g/L。老年CKD贫血主要原因为肾性贫血,但需要排除营养性贫血、失血、溶血和其他疾病引发的贫血,常见疾病包括存在营养不良(缺乏铁、叶酸、维生素B12、其他维生素和微量元素)、消化道慢性失血(萎缩性胃炎、胃溃疡、炎症性肠病、消化道肿瘤、非甾体抗炎药、抗凝药物等)、慢性炎症(关节炎、类风湿)、骨髓造血功能下降,性激素(睾酮和雌激素)分泌减少导致铁调素增加[266]。
铁代谢状态评估:因SF随着年龄增长而上升,老年患者SF水平正常并不一定能排除铁缺乏。血清sTfR是功能性铁状态的一项特异性检测指标,不受各种干扰因素的影响。但目前缺少正常参考值。
因老年CKD患者的共患疾病、日常活动情况具有特殊性,需根据老年个人情况权衡治疗的获益。应用ESAs治疗的获益是显著减少对输血的需求,并改善贫血相关症状,而潜在的风险为增加脑卒中、血管通路阻塞和高血压,并且发生ESAs不良反应的风险更高。老年CKD患者对于有活动性恶性肿瘤或近期恶性肿瘤病史的老年患者,特别是有望治愈的患者,不建议使用ESAs。对于有脑卒中史的老年患者也不建议使用ESAs。
老年CKD贫血的Hb治疗靶目标尚不清楚,Hb<100 g/L需要进行治疗,但高Hb并未显示对老年患者生活质量的改善作用,因此需要以患者为中心进行个体化处理[267]。每周ESAs剂量/Hb比值升高和铁负荷过多均增加老年CKD的不良事件,使用铁剂之前需要评估SF、TSAT、铁调素等铁代谢指标。对口服铁不耐受、吸收差或者存在胃肠道失血患者需要应用静脉铁剂。
老年CKD发生ESAs低反应率高,这与营养不良、炎症、铁缺乏、合并用药有关。检测CRP、红细胞沉降率(ESR)、IL-6、纤维蛋白原等评估其炎症状态。Hb<70 g/L且合并贫血症状以及血液动力学不稳定的患者需要考虑输血。有基础心血管疾病和需要大手术的患者,输血指征可提高至Hb<80 g/L。存在ESAs抵抗、无肾移植计划者,可以放宽输血标准[268]。
糖尿病肾病患者在CKD 2期开始筛查Hb,评估铁、叶酸、维生素B12等营养状态以及SF、转铁蛋白等铁代谢等指标(2B)。
糖尿病肾病患者合并贫血或铁代谢异常应立即启动治疗(2B)。
糖尿病肾病患者贫血要注意是否与血糖控制不良等糖尿病治疗相关(2C)。
糖尿病肾病患者贫血治疗Hb靶目标,ESAs/HIF-PHI和铁剂治疗方案,可参照非糖尿病肾病患者的贫血治疗方案(1D)。
与其他CKD患者比较,糖尿病肾病患者贫血不仅发生早,而且程度重。2型糖尿病患者贫血的患病率接近非糖尿病患者贫血患病率的2倍,糖尿病肾病患者贫血发生率为67%,其中中重度贫血发生比例为60%;而同期非糖尿病肾病患者贫血发生率为39%,中重度贫血患者比例为20%;其中女性患者贫血患病率和贫血程度较男性高,年长者比年轻者高[269]。在糖尿病患者中,血糖控制良好者贫血患病率显著低于血糖控制不佳者[19,270]。除了直接的高血糖毒性,多种因素参与导致糖尿病患者出现贫血(图3)[271, 272, 273]。
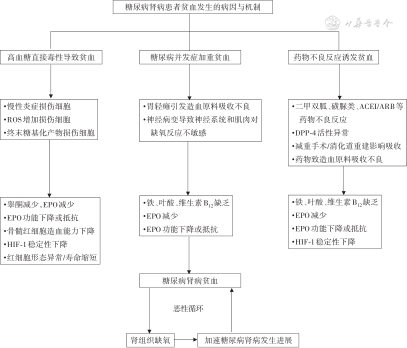

注:ROS为活性氧;EPO为红细胞生成素;HIF为低氧诱导因子;ACEI为血管紧张素转化酶抑制剂;ARB为血管紧张素Ⅱ受体拮抗剂;DPP-4为二肽基肽酶4
贫血不仅是加速糖尿病患者病情进展的独立因素,也是诱发心血管疾病、糖尿病视网膜病变的重要危险因素,可加重糖尿病神经病变和糖尿病足,降低生活质量[19]。
对糖尿病患者合并肾性贫血需早期识别并及时治疗以降低病死率。建议糖尿病肾病患者应在CKD 2期即开始筛查Hb,评估铁、叶酸、维生素B12等营养状态以及SF、转铁蛋白等铁代谢等指标,发现异常立即启动贫血治疗[270, 271, 272]。在诊治过程中若发现贫血,同样需要明确是否为营养不良性贫血,注意排除溶血性、失血性和血液系统恶性疾病,尤其要注意贫血是否和既有的糖尿病相关治疗相关,是否和血糖控制不佳或药物不良反应密切相关,以便及时调整血糖控制策略和改善贫血[273, 274]。
由于目前缺乏糖尿病肾病肾性贫血治疗的循证医学证据,肾性贫血治疗时机和Hb靶目标,以及ESAs/HIF-PHI和铁剂治疗方案参照前述肾性贫血治疗[19]。
中国CKD贫血发病率高,但知晓率、治疗率与达标率均较低;透析患者贫血治疗达标率仅为60%。过去30年间,治疗肾性贫血的主要药物是ESAs和铁剂。ESAs以各种rHuEPO为主,需要皮下或静脉注射;并且感染和炎症状态极易引起ESAs治疗低反应,而大剂量ESAs治疗可能增加心脑血管事件、血栓形成、血压升高、脑卒中及促进肿瘤生长等风险。大剂量静脉铁剂应用可能诱发严重过敏反应、氧化应激、心血管疾病及感染等不良事件,并且频繁注射时患者的依从性不佳。
肾性贫血治疗的发展方向是研发长效ESAs和持续性、高选择性EPO受体激动剂以及内源性EPO诱导剂;减少注射次数,并研发口服剂型。HIF-PHI作为一种具有全新作用机制的口服药物,具有与ESAs相似的治疗肾性贫血的效果;可通过激活HIF通路,促进内源性EPO生成,改善铁的吸收、转运和利用;下调铁调素水平,疗效受炎症状态影响较小,将为肾性贫血开辟全新的途径。应进一步研发铁调素拮抗剂及生成抑制剂,改善铁剂吸收与利用,提高ESAs敏感性与有效性。这些新型药物的研发与应用,都将有望提高CKD贫血的治疗效果。
指南制定组长:陈香美(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
执笔专家组
组长:陈香美(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
主要成员(按姓氏笔画排序):丁小强(复旦大学附属中山医院肾内科);付平(四川大学华西医院肾内科);林洪丽(大连医科大学附属第一医院肾内科);孙世仁(空军军医大学第一附属医院肾内科);孙雪峰(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心);刘文虎(首都医科大学附属北京友谊医院肾内科);何强(浙江省人民医院肾内科);何娅妮(陆军军医大学第一附属医院肾内科);汪年松(上海市第六人民医院肾内科);杨琼琼(中山大学孙逸仙纪念医院肾内科);倪兆慧(上海交通大学医学院附属仁济医院肾内科);郭志勇(海军军医大学第一附属医院肾内科);徐虹(复旦大学附属儿科医院肾内科);蔡广研(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
统稿组
组长:孙雪峰(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
主要成员:李平、朱凤阁(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
讨论专家组(按姓氏笔画排序):王彩丽(内蒙古科技大学包头医学院第一附属医院肾内科);邓跃毅(上海中医药大学附属龙华医院肾内科);林珊(天津医科大学总医院肾脏内科);孙林(中南大学湘雅二医院肾内科);李平(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心);李赟(江西省人民医院肾内科);陈意志(解放军总医院海南医院);张景红(解放军第八五医院肾脏病专科中心);苗里宁(吉林大学第二医院肾病内科);邵凤民(河南省人民医院肾内科);胡昭(山东大学齐鲁医院肾内科);胡文博(青海省人民医院肾内科);赵旭冉(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心);蒋更如(上海交通大学医学院附属新华医院肾脏风湿免疫科);查艳(贵州省人民医院肾内科 贵州省肾脏泌尿疾病研究所);焦军东(哈尔滨医科大学附属第二医院肾内科);谢院生(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心);廖蕴华(广西医科大学第一附属医院肾内科)
秘书:朱凤阁(解放军总医院肾脏病医学部 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心)
所有作者均声明不存在利益冲突