
睡眠生理监测及疾病诊断在过去几乎全部依赖于睡眠中心内的多导睡眠监测(PSG),但其复杂性、可及性及对受试者舒适度的影响均是其进一步发展应用的桎梏。随着新兴技术的出现,旨在监测自然环境下睡眠情况的可穿戴设备逐步应用于临床及研究中,对准确性及可靠性的验证也在不断进行。本文对可穿戴设备在临床评估的方法流程进行了简要说明,并对多种可穿戴设备在各型睡眠障碍临床应用时使用的信号、可监测指标及可靠性等相关研究的进展进行了汇总。

国内外学术组织推荐,18~60岁的成年人应保证每晚7 h以上的睡眠时间,以促进最佳健康状态[1]。然而根据世界卫生组织调查,全球范围内27%的人群存在睡眠问题。以往对睡眠障碍的监测、诊疗几乎全部基于睡眠中心内睡眠监测,而睡眠环境及睡眠舒适度的改变都会引起睡眠状况的改变,因此,在睡眠中心外对睡眠及生理周期进行准确定量分析尤为重要。可穿戴设备可以在相对自然的环境中对睡眠进行连续定量监测,无需繁琐、专业化的监测流程,因而在睡眠医学临床实践中引起了广泛关注。
可穿戴设备自2010年初期出现后即迅速打入消费市场,迄今为止,可穿戴设备在现代生活中几乎无处不在。据估计,2020年世界范围内市场销售的可穿戴设备将由2018年的2.2亿台增加至3.5亿台[2]。由于可穿戴设备监测信号种类繁多、监测目的多样,在睡眠及周期节律研究中,确定可穿戴设备合适、可靠的监测信号至关重要;而对于睡眠障碍的临床实践,明确可穿戴设备的诊断敏感度、特异度等具有重要意义。
近期发表于《睡眠》(Sleep)杂志上的《可穿戴技术在睡眠与周期节律测量中的应用》白皮书对可穿戴设备进行了定义,广义上的可穿戴设备包括了(1)穿戴式设备:是指佩戴或贴附于受试者身体上的设备(如腕式体动仪和简易脑电图头带);(2)近置式设备:可以近距离安置于受试者旁边用来监测患者呼吸和运动信息以及环境情况的设备(包括电磁波/雷达波反射接收器、床垫传感器、麦克风、智能手机+App等等);(3)吞服式设备:可以被受试者如药片般吞服后用于监测体核温度的设备[1]。除常规睡眠研究中所监测的信息外,可穿戴设备还可以进行诸如地理位置、体温、心率、皮肤导电性、血氧水平及情绪评估等的一系列监测。
该白皮书还同时强调,可穿戴设备应用于睡眠领域需要具备评价睡眠连续性相关参数(如总睡眠时间及睡眠效率等)的能力,有些可穿戴设备也可以监测如呼吸或神经活动等的其他生理信号;可穿戴设备应用于周期节律评估领域时需具备估测清醒/睡眠不同时相的周期节律标志物以及授时因子对其影响的能力。
多导睡眠监测(polysomnography,PSG)在研究和量化睡眠的领域中最为可靠和有效,因此是目前睡眠研究和睡眠障碍诊断的金标准,也是任何其他睡眠监测设备对比的金指标。此外,PSG的某些导联[如脉搏血氧饱和度和(或)脑电图]具有应用于可穿戴设备中的潜能。在睡眠中心之外,体动仪是公认的PSG替代方法,它通过加速度计识别身体运动,监测指标通常包括上床时间、唤醒时间,也有设备可以监测睡眠潜伏期、睡眠后清醒时间及睡眠效率等,进而了解受试者睡眠/清醒的规律性。
很多睡眠可穿戴设备以商业化为目的投放到消费者市场,尽管从监测技术层面看,它们理论上可以应用于睡眠评估,但每一种可穿戴设备应用于临床之前,均需要与PSG进行对比,以确认其能否为正确的临床决策提供数据支持。评估的过程通常需要以下步骤[3](图1):
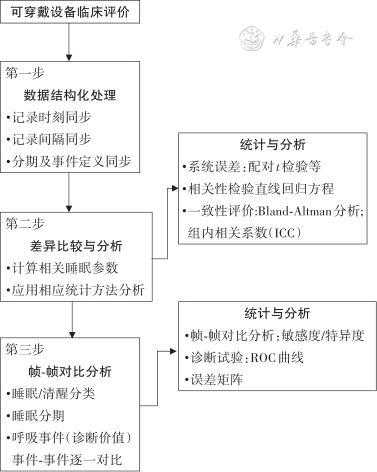

第一步为数据结构化处理。首先应同步测试设备与PSG的睡眠记录时间,其次两种设备记录的每帧时长应一致,最后对提供的每帧数据进行同步,以便进行帧-帧对比。此步骤中,应使用相同的定义系统进行睡眠分期和呼吸事件命名。
第二步为差异比较与分析。包括误差和一致性界限。此步骤中需要计算睡眠相关参数、比较个体水平差异和群组水平差异(即系统误差)。
第三步为帧-帧对比分析。评估睡眠、清醒分类的准确性,确定敏感度和特异度;还应评估对各个睡眠分期的敏感度和特异度。对于评估睡眠呼吸暂停的设备,则应进行事件-事件的逐一对比评估,以确定该设备的临床价值。
经上述步骤完成了相关评估内容的可穿戴设备才可以应用于临床和科研;反之则不具备诊断疾病的功能,不能应用于临床。
目前,可穿戴设备应用于睡眠领域进行相关研究,可以量化睡眠持续时间、睡眠效率、睡眠质量、睡眠规律、睡眠满意度及中枢/自主神经系统状态等特征。表1列举了可通过可穿戴设备进行量化的睡眠指标。

可穿戴设备的睡眠相关指标
可穿戴设备的睡眠相关指标
| 睡眠持续时间 | 睡眠质量 | EEG | 生理 | 呼吸 |
|---|---|---|---|---|
总睡眠时间(TST) 就寝时间(“关灯”到“开灯”) | 睡眠起始后清醒(WASO) 睡眠潜伏期 睡眠效率(%) REM延迟(R期延迟) 周期性肢体活动 | 睡眠阶段 睡眠轴 慢波活动 慢震荡 | 心率 心率变异度 血压 体位 | 血氧饱和度 AHI 呼吸频率和用力 鼾声 鼻道压力 气流 |
注:REM为快速眼球运动;EEG为脑电图;AHI为呼吸暂停低通气指数
可穿戴设备可用于探测睡眠中的运动、呼吸、心跳及鼾声等生理信号,可以根据以上监测数据判定睡眠中发生的呼吸暂停等呼吸事件。在睡眠呼吸事件的识别方面,目前已有研究主要聚焦于可穿戴设备应用于阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)诊断时的可靠性(表2),对于其他睡眠呼吸障碍尚缺少相关研究。
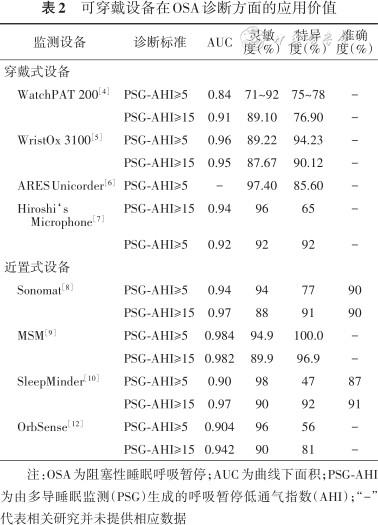
可穿戴设备在OSA诊断方面的应用价值
可穿戴设备在OSA诊断方面的应用价值
| 监测设备 | 诊断标准 | AUC | 灵敏 度(%) | 特异 度(%) | 准确 度(%) |
|---|---|---|---|---|---|
| 穿戴式设备 | |||||
WatchPAT 200[4] | PSG-AHI≥5 | 0.84 | 71~92 | 75~78 | - |
| PSG-AHI≥15 | 0.91 | 89.10 | 76.90 | - | |
WristOx 3100[5] | PSG-AHI≥5 | 0.96 | 89.22 | 94.23 | - |
| PSG-AHI≥15 | 0.95 | 87.67 | 90.12 | - | |
ARES Unicorder[6] | PSG-AHI≥5 | - | 97.40 | 85.60 | - |
Hiroshi‘s Microphone[7] | PSG-AHI≥15 | 0.94 | 96 | 65 | - |
| PSG-AHI≥5 | 0.92 | 92 | 92 | - | |
| 近置式设备 | |||||
Sonomat[8] | PSG-AHI≥5 | 0.94 | 94 | 77 | 90 |
| PSG-AHI≥15 | 0.97 | 88 | 91 | 90 | |
MSM[9] | PSG-AHI≥5 | 0.984 | 94.9 | 100.0 | - |
| PSG-AHI≥15 | 0.982 | 89.9 | 96.9 | - | |
SleepMinder[10] | PSG-AHI≥5 | 0.90 | 98 | 47 | 87 |
| PSG-AHI≥15 | 0.97 | 90 | 92 | 91 | |
OrbSense[12] | PSG-AHI≥5 | 0.904 | 96 | 56 | - |
| PSG-AHI≥15 | 0.942 | 90 | 81 | - |
注:OSA为阻塞性睡眠呼吸暂停;AUC为曲线下面积;PSG-AHI为由多导睡眠监测(PSG)生成的呼吸暂停低通气指数(AHI);“-”代表相关研究并未提供相应数据
1.穿戴式设备:Yuceege等[4]同时将腕式监测设备WatchPAT 200与PSG应用于同夜监测,其呼吸紊乱指数(respiratory disturbance index,RDI)与PSG的RDI具有较高的一致性[差异为(-1.43±7.26)次/h,P>0.05],对OSA及中重度OSA均有很高的诊断价值[曲线下面积(AUC)分别为0.84及0.91]。腕式监测设备WristOx 3100单独通过对血氧饱和度的监测应用于OSA的诊断。Nigro等[5]的研究结果显示,其在与PSG同步监测时表现出对OSA较高的诊断价值。ARES Unicorder是一种头带式睡眠监测设备,将麦克风、加速度计和血氧饱和度监测仪集成在头带上以监测受试者鼾声、头部运动及体位、心率、脉搏血氧饱和度情况,并利用与鼻压力传感器相连接的鼻导管对患者鼻气流进行监测。Westbrook等[6]将该头带式监测设备与PSG进行同步监测,结果显示该设备RDI与PSG-AHI相关性较高(r=0.96,P<0.001)及一致性。Nakano等[7]研究了一种贴附于患者甲状软骨的麦克风,其利用自动分析系统对气管内相应频率的声音进行分析得出气管声音呼吸紊乱指数(tracheal sound-respiratory disturbance index,TS-RDI);与PSG的同步监测结果表明TS-RDI与PSG-AHI具有高度相关性(r=0.945),但TS-RDI与PSG-AHI间差异有统计学意义(P<0.05),TS-RDI会低估相应患者AHI (2.9±16.4)次/h;ROC曲线显示其诊断价值尚可。
2.近置式设备:Norman等[8]的研究发现睡眠床垫(Sonomat)可以识别93%由PSG确定的睡眠呼吸事件,而PSG确认了94%由睡眠床垫判断的睡眠呼吸事件,其AHI与PSG-AHI相关(r=0.968)且有较高的一致性[差异仅为1.4(95%CI:-1.3,4.1)次/h],对OSA诊断的灵敏度及特异度也较高。Meng等[9]将另一种床垫式监测设备(MSM)与PSG进行同步监测,结果显示两者AHI相关(r=0.97,P<0.01),一致性较好。Zaffaroni等[10]对于一款使用雷达波反射接收器的床旁监测设备(SleepMinder)的研究显示,该设备对OSA诊断的准确度为87%,灵敏度和特异度分别为98%和47%,且其对严重程度分类的准确度为66%;此外,也有研究表明:SleepMinder也可用于对睡眠周期性肢体运动的除外诊断[11]。基于超宽带雷达系统的新型监测设备(OrbSense)也在PSG的同步监测中显示出较高的应用价值,Zhao等[12]的研究显示,该设备与PSG具有较高的相关性(r=0.92,P<0.001)及一致性[差值为1.5(95CI:-18.6,21.5)],其诊断价值也比较高。
尽管当下有许多针对各类非接触式设备的研究,但能否使其成为睡眠分析及OSA的诊断工具尚需要严谨、完整的验证。
可穿戴设备在睡眠/清醒及判定方面具有较高的敏感度(90%以上)和准确度(80%以上),但其特异度参差不齐(35.00%~80.40%),主要与各设备所采用的监测方式不同有关。可靠性及可检测的指标也各有差异(表3)。总体来讲,基于脑电和运动探测者,特别是专门设计的体动仪能够动态评测清醒与睡眠时长,在生物节律相关睡眠障碍及失眠的评估中有较大应用价值;除针对脑电信号者,可穿戴设备对睡眠分期的价值尚待进一步验证。
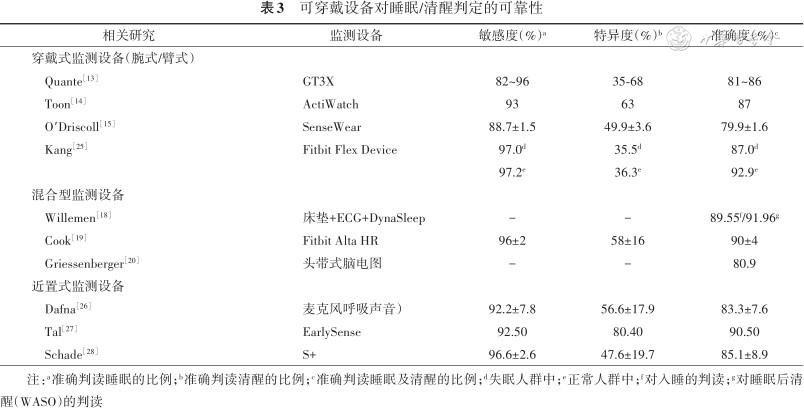
可穿戴设备对睡眠/清醒判定的可靠性
可穿戴设备对睡眠/清醒判定的可靠性
| 相关研究 | 监测设备 | 敏感度(%)a | 特异度(%)b | 准确度(%)c |
|---|---|---|---|---|
| 穿戴式监测设备(腕式/臂式) | ||||
Quante[13] | GT3X | 82~96 | 35-68 | 81~86 |
Toon[14] | ActiWatch | 93 | 63 | 87 |
O′Driscoll[15] | SenseWear | 88.7±1.5 | 49.9±3.6 | 79.9±1.6 |
Kang[25] | Fitbit Flex Device | 97.0d | 35.5d | 87.0d |
| 97.2e | 36.3e | 92.9e | ||
| 混合型监测设备 | ||||
Willemen[18] | 床垫+ECG+DynaSleep | - | - | 89.55f/91.96g |
Cook[19] | Fitbit Alta HR | 96±2 | 58±16 | 90±4 |
Griessenberger[20] | 头带式脑电图 | - | - | 80.9 |
| 近置式监测设备 | ||||
Dafna[26] | 麦克风呼吸声音) | 92.2±7.8 | 56.6±17.9 | 83.3±7.6 |
Tal[27] | EarlySense | 92.50 | 80.40 | 90.50 |
Schade[28] | S+ | 96.6±2.6 | 47.6±19.7 | 85.1±8.9 |
注:a准确判读睡眠的比例;b准确判读清醒的比例;c准确判读睡眠及清醒的比例;d失眠人群中;e正常人群中;f对入睡的判读;g对睡眠后清醒(WASO)的判读
1.穿戴式设备:(1)体动仪:腕式设备最为常见。Quante等[13]应用PSG评估了两种腕式体动仪对睡眠-清醒时间测量的准确性,结果显示在正常的青少年和成年人中,两者均可较为准确地估算睡眠时间,其准确度达到81%~86%,但对睡眠起始后清醒(WASO)的估算并不准确。Toon等[14]将ActiWatch与PSG进行对比,发现该设备报告的总睡眠时间(TST)、WASO、睡眠效率(sleep efficiency,SE)与PSG差异无统计学意义,其敏感度(准确判读睡眠)达到93%,准确度(准确判读睡眠及清醒)为87%,但特异度(准确判读清醒)较低(63%)。其他穿戴式体动设备多佩戴于上肢,还可将加速度计数据与皮肤电反应传感器相结合以估算能量消耗。O′Driscoll等[15]对比了臂式体动仪联合能量消耗对睡眠-清醒时间的检测效能,结果发现,与PSG相比其帧-帧一致性比例为(79.9±1.6)%;检测睡眠较准确,灵敏度达到(88.7±1.5)%,但检测清醒的能力较差,特异度仅为(49.9±3.6)%。佩戴在其他部位如计步器、胸部传感器、指环传感器等,也可用于判定睡眠/清醒状态,但尚缺乏高水平的临床验证研究。(2) 新型的多传感穿戴式设备:该设备整合了心率、皮肤电导、皮肤温度和血氧饱和度等其他指标,可以作为对加速度计数据的补充。此外,动态电生理学技术的发展还带来了通过脑电图量化睡眠的商用设备[16, 17]。Willemen等[18]研究显示,通过将心率、呼吸频率和运动信号结合分析,可将清醒-快速眼动期-非快速眼动期(WAKE-REM-NREM)分期的准确度提高至86%。Cook等[19]使用Fitbit Alta心率监测分析整夜睡眠,并将结果与PSG相对比,其N1、N2期与PSG的一致性为73%,N3期的一致性为67%,REM期的一致性为74%。Griessenberger等[20]研究了一种头带式睡眠监测设备,利用头带固定三个前额脑电图电极对患者脑电活动进行监测和评估;其对浅睡眠及深睡眠的判读较好(r=0.480及0.695,P<0.001),与人工判读的符合程度也较高(80.9%)。这些设备将依赖于睡眠阶段的不同生物信号与运动信号相结合,提高了睡眠跟踪系统的准确性,可以增强对睡眠/清醒状态及睡眠阶段的判定能力。整体而言,穿戴式设备通过体动减少对睡眠、清醒进行估测,但大多数均会低估睡眠潜伏期[21],且目前研究多集中于正常人群或者OSA等,应用于失眠的研究较少,而且结果并不一致。Taibi等[22]将ActiWatch用于对失眠人群的睡眠监测,其结果显示该设备在监测期间会受到众多因素(包括但不限于无体动觉醒、床伴活动及周期性肢体运动等)的影响,因而其对睡眠潜伏期等以及失眠诊断的应用价值有限;Sivertsen等[23]将ActiWatch用于老年慢性失眠患者的研究也得出了类似的结论,并且它未能显示失眠治疗前后的睡眠改善情况。而McCall和McCall[24]将ActiWatch用于失眠合并抑郁发作患者的睡眠监测中,则发现与同步PSG相比,两者SE、WASO、TST差异无统计学意义,对这类患者睡眠情况的反映较睡眠日记更为准确。Kang等[25]将另一种腕式体动仪(Fitbit Flex Device,FF)用于对失眠人群的监测,结果显示在失眠人群中,FF的TST、SE、睡眠潜伏期与同步监测PSG间一致性较好(组内相关系数分别为0.886,0.570及0.673),帧-帧对比结果显示FF在失眠及正常人群中对睡眠/觉醒的判定情况均较好。
2.近置式设备(nearables):目前已有研究将此类设备与PSG进行对比以评估其用于睡眠分期可靠性。Dafna等[26]评价了应用呼吸声音监测对睡眠-清醒时间评估的准确性,与PSG帧-帧对比显示该设备对睡眠判定的敏感度为92.2%,特异度为56.6%,kappa相关指数为0.508,对睡眠时间的估算差值为35.8 min。Tal等[27]对比了EarlySense与PSG的睡眠相关参数,结果显示其TST与PSG呈线性相关(r=0.87)。Schade等[28]对于另一款使用雷达波反射接收器的床旁监测设备(S+)的研究表明,S+对于睡眠/清醒分期的准确率为87%,对于各睡眠分期的准确率均为超过68%。
随着科学技术的发展,睡眠可穿戴设备日益受到关注;目前可穿戴设备所面临的最大挑战,仍是如何评估此类设备的临床实用价值,使其在睡眠疾病、特别是睡眠呼吸疾病的诊治中发挥更大的作用。同时,设备未正确佩戴以及佩戴不舒适也易导致数据缺失,从而影响监测结果[29]。因此,未来研究的主要部分仍应是临床工作者对现有可穿戴设备的可靠性进行深入的研究。此外,将工程学、基础医学及临床医学紧密结合并进一步开发新型可穿戴设备,或是对已有可穿戴设备进行升级并与其他远程医疗系统进行整合都将是未来研究的重要方向。
所有作者均声明不存在利益冲突



























