
探讨孕期睡眠时点与小于胎龄儿(small for gestation age,SGA)的关系,并分析糖脂代谢在其中的作用。
选择2015年3月至2019年4月在合肥市第一人民医院、安徽省妇幼保健院和安徽医科大学第一附属医院产科门诊产检的6 821例孕中期孕妇,通过面对面问卷调查收集一般人口特征、饮食和生活行为等指标。通过孕妇自评获得其近1个月就寝时点、晨起时点、睡眠时长等睡眠信息,并于孕晚期再次调查,分娩时收集母婴妊娠结局,最终获得5 488对母婴健康资料。采用限制性立方样条回归模型探索睡眠时点与SGA风险的非线性关系,采用基于Bootstrap法的中介模型探索糖脂代谢在睡眠时点与SGA关联中的作用。
SGA发生率为8.4%(459/5 488)。多因素logistic回归模型结果显示,与21∶00前就寝相比,23∶00后就寝孕妇的SGA发生风险显著增加(OR=1.54,95%CI:1.01~2.34);与8∶00前晨起相比,8∶00后晨起孕妇的SGA发生风险显著增加(OR=1.31,95%CI:1.05~1.62)。睡眠时长与SGA的关联无统计学意义(P>0.05)。限制性立方样条回归结果显示,睡眠中点从凌晨02∶45开始,SGA风险逐渐增加(P<0.05)。进一步的中介模型结果显示,孕中期睡眠中点迟(即晚睡晚起的睡眠模式)对SGA的负性影响可能部分通过糖脂代谢通路实现(均P<0.05)。
孕中期可能是影响SGA的关键期,睡眠中点迟可能是SGA风险增加的潜在危险因素,且可能通过改变糖脂代谢水平,进而影响SGA的发生。

中国小于胎龄儿(small for gestational age,SGA)出生率为6%~15%[1, 2, 3],SGA成年后伴有更高的血糖水平以及胰岛素抵抗,是在生命早期阶段影响成年后多种慢性疾病发生发展的重要危险因素[4]。有研究表明,存在睡眠问题的孕妇发生SGA等不良出生结局的风险更高[5, 6, 7]。随着睡眠生物钟对健康的巨大影响逐渐被认识[8, 9],提示孕期不良睡眠时点可能是母婴健康的潜在危险因素,然而孕期相关的既往研究多关注睡眠时长、睡眠质量等指标,而对睡眠时点(如就寝时点、起床时点、睡眠中点等)关注较少[10]。此外,糖脂代谢的紊乱对不良出生结局的负性效应已被大量研究所发现[11, 12],迄今为止未发现对孕期睡眠时点-糖脂代谢-母婴健康三者间关系探索的研究。故本研究旨在探讨孕中/晚期睡眠时点与SGA发生风险的关系,并进一步探究这种影响是否会通过糖脂代谢实现。
本研究为队列研究,研究方案得到安徽医科大学生物医学伦理委员会批准(编号:2015002)。选择2015年3月至2019年4月在合肥市第一人民医院、安徽省妇幼保健院和安徽医科大学第一附属医院产科门诊进行产检的孕中期孕妇。纳入标准:(1)孕中期孕妇(18~27周);(2)无严重精神疾患;(3)能清晰对答问卷题目;(4)自然受孕;(5)单胎孕妇。研究共纳入6 821例孕妇,在孕晚期(30~36周)和分娩时分别随访母婴健康情况。排除死胎死产(9例,0.16%)、失访(1 324例,19.41%)孕妇,最终获得5 488对母婴健康资料(孕中期和分娩时均有调查,且有睡眠指标和胎龄儿指标的研究对象)。所有研究对象均签署知情同意书。
采用自制问卷调查孕中期孕妇的一般特征,包括妊娠年龄、身高、孕前1个月体重、受教育年限、配偶月收入等,从《安徽省孕产妇保健手册》中抄录孕前体质指数(BMI)、孕次等,通过面对面询问的方式获得近1个月睡眠状况和近1周膳食摄入情况,通过孕中期口服葡萄糖耐量试验(OGTT)检查结果获得血糖指标;通过检测孕中期所收集的空腹静脉血获得血脂四项数据。随访至孕晚期并通过问卷调查方式获得近1个月睡眠状况,随访至分娩并通过产科住院部电子病历获得母婴健康资料(如孕妇孕期总增重、分娩孕周以及新生儿性别、出生体重等)。
1.BMI:依据WHO的BMI分类标准计算孕前BMI,并将其分为低BMI(<18.5 kg/m2)、正常BMI(18.5~23.9 kg/m2)、超重及肥胖(≥24.0 kg/m2)[13]。
2.孕期增重:美国国家科学院医学研究所(IOM)基于孕前BMI推荐的孕期增重建议为:(1)BMI<18.5 kg/m2:孕妇整个孕期增重12.5~18.0 kg;(2)18.5 kg/m2≤BMI<25.0 kg/m2:孕妇整个孕期增重11.5~16.0 kg;(3)25.0 kg/m2≤BMI<30.0 kg/m2:孕妇整个孕期增重7.0~11.5 kg;(4)BMI≥30.0 kg/m2:孕妇整个孕期增重5.0~9.0 kg;本研究定义孕期增重在推荐范围内为增重正常,低于推荐范围为增重不足,高于推荐范围为增重过多[14]。
3.体力活动与饮食摄入:通过面对面询问方式获得孕妇体力活动与饮食摄入情况。(1)近3个月10 min以上体力运动的次数:将结果划分成是否≥3次/周;(2)近3个月日平均躺坐时长:将结果划分成是否≥6 h/d;(3)近1周进食奶类、红肉等饮食的次数:将结果划分成是否≥3次/周。
4.孕期睡眠指标定义:截选匹兹堡睡眠量表(PSQI)前4条项目,通过孕妇主观报告的形式获得近1个月总体睡眠情况,包括就寝时点、晨起时点、睡眠时长等指标。考虑到睡眠指标暂无统一划分标准,结合本研究的数据分布特点和整刻度时点比较的便利性,将就寝时点划分为<21∶00组(10.7%,588/5 488)、21∶00~<22∶00组(39.6%,2 091/5 488)、22∶00~<23∶00组(38.1%,636/5 488)和≥23∶00组(11.6%,588/5 488);晨起时点划分为<8∶00组(71.3%,3 934/5 488)和≥8∶00组(28.3%,1 554/5 488);睡眠时长划分为两类:孕中期睡眠时长(<7、7~<8、8~<9、9~<10、≥10 h)和孕晚期睡眠时长(<7、7~<8、8~<9、≥9 h,未发现孕晚期睡眠时长≥10 h的孕妇)。结合相关睡眠文献,计算睡眠中点:自入睡到起床的整个睡眠过程的中间时点,将此变量升序并均分为4类,分别用Q1、Q2、Q3、Q4命名百分比位置从小到大的4个组别。
5.糖脂代谢:妊娠期糖尿病(gestational diabetes mellitus,GDM)诊断标准[15]:妊娠24~28周,进行75 g口服葡萄糖耐量试验,空腹、服葡萄糖后1 h和2 h血糖诊断界值分别为5.1、10.0和8.5 mmo/L,3项中的任1项值达到或超过上述标准,即诊断为GDM;血脂指标分别为总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDLC)和低密度脂蛋白(LDLC)。
6.SGA:采用Mikolajczyk等[16]创建的方法,本研究中SGA的判定标准为同胎龄中出生体重<第10百分位数的新生儿。
使用EpiData3.0建立数据库,资料经审查无误后双录入,使用R 4.0.1版本软件进行统计分析。使用表示连续性计量资料,使用频数及百分率(%)表示分类资料,采用单因素logistic回归模型探讨一般人口特征、健康状况、饮食习惯等与SGA的关系;采用线性回归模型和logistic回归模型分别分析孕中期糖脂代谢水平与睡眠和SGA的关系。通过多因素logistic回归模型初步分析孕期睡眠时点与SGA发生风险的关系。考虑到暂无睡眠时点的参考分类标准,为避免本研究数据分析时对睡眠时点的主观性错误分类,故进一步采用限制性立方样条回归模型探索睡眠时点与SGA发生风险的非线性关系。使用基于Bootstrap法的中介模型分析睡眠时点、糖脂代谢和SGA的中介效应,基于Bootstrap法的中介效应已被证明较其他方法检验效力更高[17]。双侧检验,检验水准α=0.05。
1. 孕产妇及婴儿健康特征的分布:孕妇年龄为(29±4)岁,受教育年限为(13.8±2.6)年,配偶月收入为(5 997±2 694)元,孕前BMI为(21.5±2.9) kg/m2。孕妇孕周为(39.0±1.4)周,婴儿出生体重为(3 410±455) g,SGA发生率为8.4%(459/5 488)。
2. 孕产妇基本特征与SGA的关系:单因素logistic回归模型结果显示,年龄<25岁、配偶月收入<4 000元、孕前BMI<18.5 kg/m2、孕期增重低、首次怀孕和秋冬季与SGA风险增加显著相关。结果 见表1。
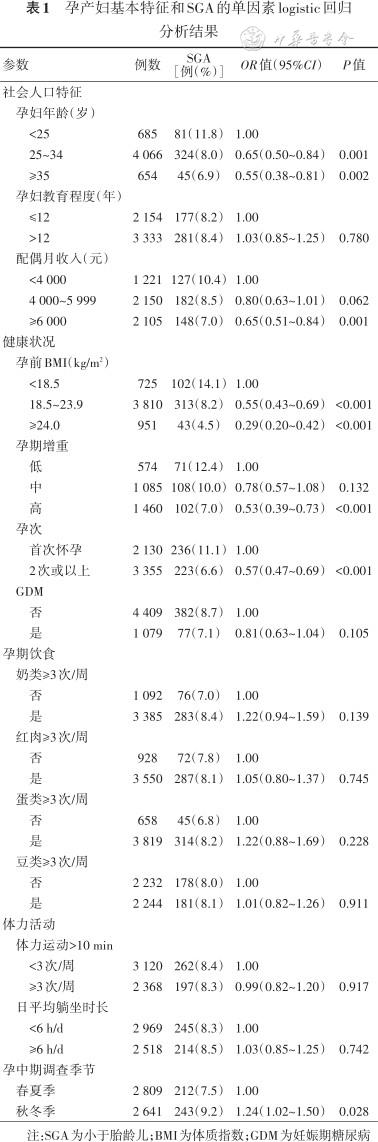
孕产妇基本特征和SGA的单因素logistic回归分析结果
孕产妇基本特征和SGA的单因素logistic回归分析结果
| 参数 | 例数 | SGA [例(%)] | OR值(95%CI) | P值 | |
|---|---|---|---|---|---|
| 社会人口特征 | |||||
孕妇年龄(岁) | |||||
| <25 | 685 | 81(11.8) | 1.00 | ||
| 25~34 | 4 066 | 324(8.0) | 0.65(0.50~0.84) | 0.001 | |
| ≥35 | 654 | 45(6.9) | 0.55(0.38~0.81) | 0.002 | |
孕妇教育程度(年) | |||||
| ≤12 | 2 154 | 177(8.2) | 1.00 | ||
| >12 | 3 333 | 281(8.4) | 1.03(0.85~1.25) | 0.780 | |
配偶月收入(元) | |||||
| <4 000 | 1 221 | 127(10.4) | 1.00 | ||
| 4 000~5 999 | 2 150 | 182(8.5) | 0.80(0.63~1.01) | 0.062 | |
| ≥6 000 | 2 105 | 148(7.0) | 0.65(0.51~0.84) | 0.001 | |
| 健康状况 | |||||
孕前BMI(kg/m2) | |||||
| <18.5 | 725 | 102(14.1) | 1.00 | ||
| 18.5~23.9 | 3 810 | 313(8.2) | 0.55(0.43~0.69) | <0.001 | |
| ≥24.0 | 951 | 43(4.5) | 0.29(0.20~0.42) | <0.001 | |
孕期增重 | |||||
| 低 | 574 | 71(12.4) | 1.00 | ||
| 中 | 1 085 | 108(10.0) | 0.78(0.57~1.08) | 0.132 | |
| 高 | 1 460 | 102(7.0) | 0.53(0.39~0.73) | <0.001 | |
孕次 | |||||
| 首次怀孕 | 2 130 | 236(11.1) | 1.00 | ||
| 2次或以上 | 3 355 | 223(6.6) | 0.57(0.47~0.69) | <0.001 | |
GDM | |||||
| 否 | 4 409 | 382(8.7) | 1.00 | ||
| 是 | 1 079 | 77(7.1) | 0.81(0.63~1.04) | 0.105 | |
| 孕期饮食 | |||||
奶类≥3次/周 | |||||
| 否 | 1 092 | 76(7.0) | 1.00 | ||
| 是 | 3 385 | 283(8.4) | 1.22(0.94~1.59) | 0.139 | |
红肉≥3次/周 | |||||
| 否 | 928 | 72(7.8) | 1.00 | ||
| 是 | 3 550 | 287(8.1) | 1.05(0.80~1.37) | 0.745 | |
蛋类≥3次/周 | |||||
| 否 | 658 | 45(6.8) | 1.00 | ||
| 是 | 3 819 | 314(8.2) | 1.22(0.88~1.69) | 0.228 | |
豆类≥3次/周 | |||||
| 否 | 2 232 | 178(8.0) | 1.00 | ||
| 是 | 2 244 | 181(8.1) | 1.01(0.82~1.26) | 0.911 | |
| 体力活动 | |||||
体力运动>10 min | |||||
| <3次/周 | 3 120 | 262(8.4) | 1.00 | ||
| ≥3次/周 | 2 368 | 197(8.3) | 0.99(0.82~1.20) | 0.917 | |
日平均躺坐时长 | |||||
| <6 h/d | 2 969 | 245(8.3) | 1.00 | ||
| ≥6 h/d | 2 518 | 214(8.5) | 1.03(0.85~1.25) | 0.742 | |
| 孕中期调查季节 | |||||
春夏季 | 2 809 | 212(7.5) | 1.00 | ||
秋冬季 | 2 641 | 243(9.2) | 1.24(1.02~1.50) | 0.028 | |
注:SGA为小于胎龄儿;BMI为体质指数;GDM为妊娠期糖尿病
3. 孕期睡眠与SGA发生风险的关系:多因素logistic回归模型显示,孕中期睡眠模型中,与21∶00前就寝组相比,21:00~22∶00就寝组(OR=1.75,95%CI:1.04~2.94)、22∶00~23∶00就寝组(OR=1.93,95%CI:1.14~3.24)和23∶00后就寝组(OR=2.61,95%CI:1.46~4.67)的孕妇分娩SGA的风险逐渐增加。与<8∶00晨起组相比,≥8∶00晨起组的孕妇分娩SGA风险增加(OR=1.32,95%CI:1.01~1.74)。与7~<8 h睡眠时长组相比,睡眠时长越长的孕妇,其分娩SGA的比例越高,但多因素分析结果显示其不再具备统计学意义(P>0.05)。孕晚期睡眠模型中,与21∶00前就寝组相比,23∶00后就寝组的孕妇分娩SGA风险逐渐增加(OR=2.53,95%CI:1.24~5.16)。其他孕晚期睡眠状态与SGA的关联无统计学意义。结果见表2。
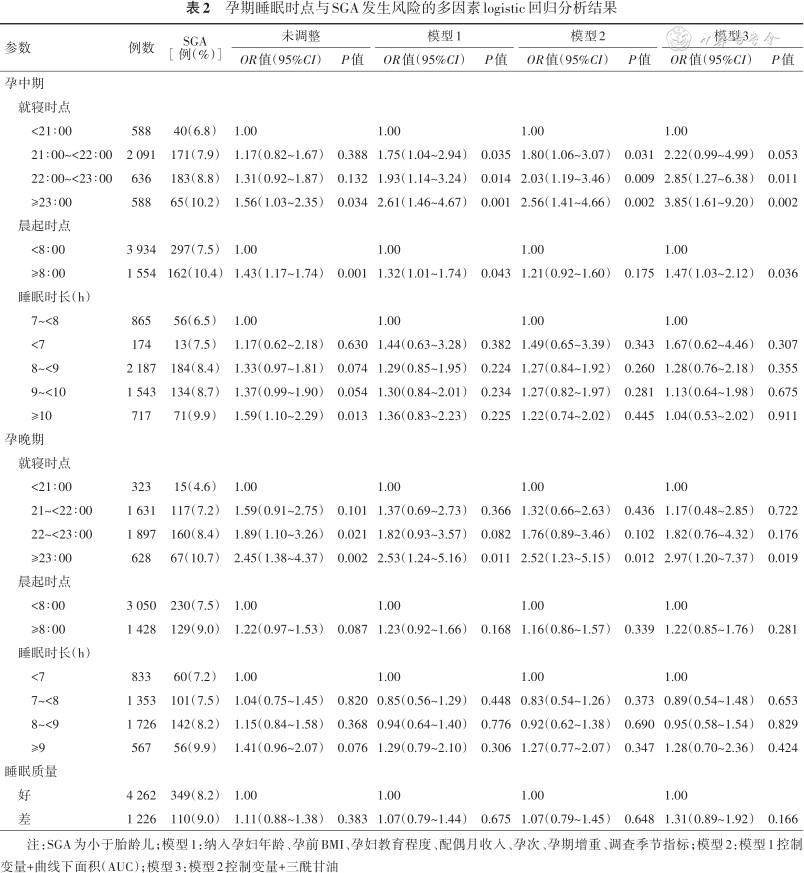
孕期睡眠时点与SGA发生风险的多因素logistic回归分析结果
孕期睡眠时点与SGA发生风险的多因素logistic回归分析结果
| 参数 | 例数 | SGA [ 例(%)] | 未调整 | 模型1 | 模型2 | 模型3 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | OR值(95%CI) | P值 | OR值(95%CI) | P值 | ||||
| 孕中期 | |||||||||||
就寝时点 | |||||||||||
| <21∶00 | 588 | 40(6.8) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| 21∶00~<22∶00 | 2 091 | 171(7.9) | 1.17(0.82~1.67) | 0.388 | 1.75(1.04~2.94) | 0.035 | 1.80(1.06~3.07) | 0.031 | 2.22(0.99~4.99) | 0.053 | |
| 22∶00~<23∶00 | 636 | 183(8.8) | 1.31(0.92~1.87) | 0.132 | 1.93(1.14~3.24) | 0.014 | 2.03(1.19~3.46) | 0.009 | 2.85(1.27~6.38) | 0.011 | |
| ≥23∶00 | 588 | 65(10.2) | 1.56(1.03~2.35) | 0.034 | 2.61(1.46~4.67) | 0.001 | 2.56(1.41~4.66) | 0.002 | 3.85(1.61~9.20) | 0.002 | |
晨起时点 | |||||||||||
| <8∶00 | 3 934 | 297(7.5) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| ≥8∶00 | 1 554 | 162(10.4) | 1.43(1.17~1.74) | 0.001 | 1.32(1.01~1.74) | 0.043 | 1.21(0.92~1.60) | 0.175 | 1.47(1.03~2.12) | 0.036 | |
睡眠时长(h) | |||||||||||
| 7~<8 | 865 | 56(6.5) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| <7 | 174 | 13(7.5) | 1.17(0.62~2.18) | 0.630 | 1.44(0.63~3.28) | 0.382 | 1.49(0.65~3.39) | 0.343 | 1.67(0.62~4.46) | 0.307 | |
| 8~<9 | 2 187 | 184(8.4) | 1.33(0.97~1.81) | 0.074 | 1.29(0.85~1.95) | 0.224 | 1.27(0.84~1.92) | 0.260 | 1.28(0.76~2.18) | 0.355 | |
| 9~<10 | 1 543 | 134(8.7) | 1.37(0.99~1.90) | 0.054 | 1.30(0.84~2.01) | 0.234 | 1.27(0.82~1.97) | 0.281 | 1.13(0.64~1.98) | 0.675 | |
| ≥10 | 717 | 71(9.9) | 1.59(1.10~2.29) | 0.013 | 1.36(0.83~2.23) | 0.225 | 1.22(0.74~2.02) | 0.445 | 1.04(0.53~2.02) | 0.911 | |
| 孕晚期 | |||||||||||
就寝时点 | |||||||||||
| <21∶00 | 323 | 15(4.6) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| 21~<22∶00 | 1 631 | 117(7.2) | 1.59(0.91~2.75) | 0.101 | 1.37(0.69~2.73) | 0.366 | 1.32(0.66~2.63) | 0.436 | 1.17(0.48~2.85) | 0.722 | |
| 22~<23∶00 | 1 897 | 160(8.4) | 1.89(1.10~3.26) | 0.021 | 1.82(0.93~3.57) | 0.082 | 1.76(0.89~3.46) | 0.102 | 1.82(0.76~4.32) | 0.176 | |
| ≥23∶00 | 628 | 67(10.7) | 2.45(1.38~4.37) | 0.002 | 2.53(1.24~5.16) | 0.011 | 2.52(1.23~5.15) | 0.012 | 2.97(1.20~7.37) | 0.019 | |
晨起时点 | |||||||||||
| <8∶00 | 3 050 | 230(7.5) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| ≥8∶00 | 1 428 | 129(9.0) | 1.22(0.97~1.53) | 0.087 | 1.23(0.92~1.66) | 0.168 | 1.16(0.86~1.57) | 0.339 | 1.22(0.85~1.76) | 0.281 | |
睡眠时长(h) | |||||||||||
| <7 | 833 | 60(7.2) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
| 7~<8 | 1 353 | 101(7.5) | 1.04(0.75~1.45) | 0.820 | 0.85(0.56~1.29) | 0.448 | 0.83(0.54~1.26) | 0.373 | 0.89(0.54~1.48) | 0.653 | |
| 8~<9 | 1 726 | 142(8.2) | 1.15(0.84~1.58) | 0.368 | 0.94(0.64~1.40) | 0.776 | 0.92(0.62~1.38) | 0.690 | 0.95(0.58~1.54) | 0.829 | |
| ≥9 | 567 | 56(9.9) | 1.41(0.96~2.07) | 0.076 | 1.29(0.79~2.10) | 0.306 | 1.27(0.77~2.07) | 0.347 | 1.28(0.70~2.36) | 0.424 | |
| 睡眠质量 | |||||||||||
好 | 4 262 | 349(8.2) | 1.00 | 1.00 | 1.00 | 1.00 | |||||
差 | 1 226 | 110(9.0) | 1.11(0.88~1.38) | 0.383 | 1.07(0.79~1.44) | 0.675 | 1.07(0.79~1.45) | 0.648 | 1.31(0.89~1.92) | 0.166 | |
注:SGA为小于胎龄儿;模型1:纳入孕妇年龄、孕前BMI、孕妇教育程度、配偶月收入、孕次、孕期增重、调查季节指标;模型2:模型1控制变量+曲线下面积(AUC);模型3:模型2控制变量+三酰甘油
4. 孕中期睡眠时点模式与SGA发生风险的关系:将就寝和晨起指标相结合的多因素logistic分析结果显示,与23∶00前就寝且8∶00前晨起的这种睡眠模式孕妇相比,23∶00后就寝且8∶00后晨起的睡眠模式孕妇发生SGA风险显著增加(OR=1.79,95%CI:1.28~2.51);以睡眠中点Q1为对照组,Q4组睡眠模式孕妇发生SGA风险显著增加(OR=1.51,95%CI:1.13~2.01),结果见表3、4。限制性立方样条回归结果显示,睡眠中点从凌晨02∶45开始,SGA风险逐渐增加,结果见图1。
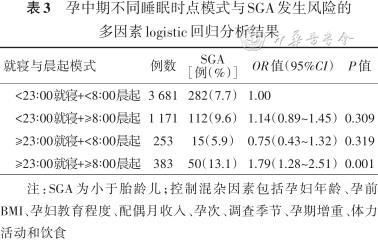
孕中期不同睡眠时点模式与SGA发生风险的多因素logistic回归分析结果
孕中期不同睡眠时点模式与SGA发生风险的多因素logistic回归分析结果
| 就寝与晨起模式 | 例数 | SGA [例(%)] | OR值(95%CI) | P值 |
|---|---|---|---|---|
| <23∶00就寝+<8∶00晨起 | 3 681 | 282(7.7) | 1.00 | |
| <23∶00就寝+≥8∶00晨起 | 1 171 | 112(9.6) | 1.14(0.89~1.45) | 0.309 |
| ≥23∶00就寝+<8∶00晨起 | 253 | 15(5.9) | 0.75(0.43~1.32) | 0.319 |
| ≥23∶00就寝+≥8∶00晨起 | 383 | 50(13.1) | 1.79(1.28~2.51) | 0.001 |
注:SGA为小于胎龄儿;控制混杂因素包括孕妇年龄、孕前BMI、孕妇教育程度、配偶月收入、孕次、调查季节、孕期增重、体力活动和饮食
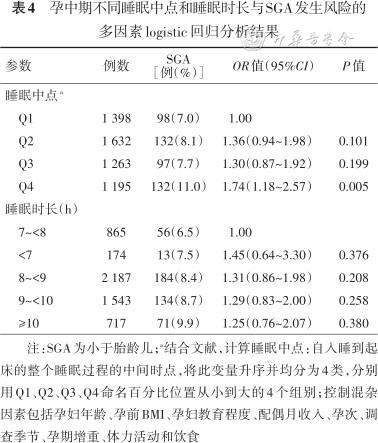
孕中期不同睡眠中点和睡眠时长与SGA发生风险的多因素logistic回归分析结果
孕中期不同睡眠中点和睡眠时长与SGA发生风险的多因素logistic回归分析结果
| 参数 | 例数 | SGA [例(%)] | OR值(95%CI) | P值 |
|---|---|---|---|---|
| 睡眠中点a | ||||
Q1 | 1 398 | 98(7.0) | 1.00 | |
Q2 | 1 632 | 132(8.1) | 1.36(0.94~1.98) | 0.101 |
Q3 | 1 263 | 97(7.7) | 1.30(0.87~1.92) | 0.199 |
Q4 | 1 195 | 132(11.0) | 1.74(1.18~2.57) | 0.005 |
| 睡眠时长(h) | ||||
7~<8 | 865 | 56(6.5) | 1.00 | |
<7 | 174 | 13(7.5) | 1.45(0.64~3.30) | 0.376 |
8~<9 | 2 187 | 184(8.4) | 1.31(0.86~1.98) | 0.208 |
9~<10 | 1 543 | 134(8.7) | 1.29(0.83~2.00) | 0.258 |
≥10 | 717 | 71(9.9) | 1.25(0.76~2.07) | 0.380 |
注:SGA为小于胎龄儿;a结合文献,计算睡眠中点:自入睡到起床的整个睡眠过程的中间时点,将此变量升序并均分为4类,分别用Q1、Q2、Q3、Q4命名百分比位置从小到大的4个组别;控制混杂因素包括孕妇年龄、孕前BMI、孕妇教育程度、配偶月收入、孕次、调查季节、孕期增重、体力活动和饮食
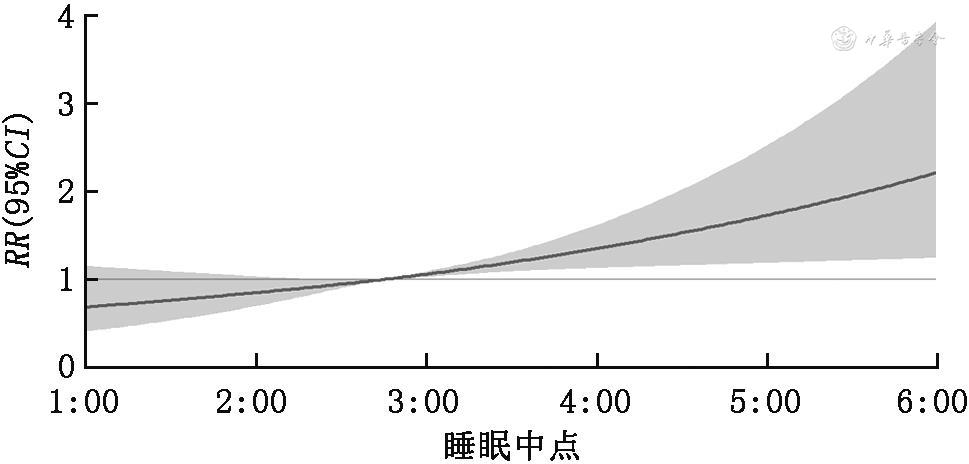

5. 孕产妇糖脂代谢与睡眠时点和SGA的关系:以睡眠中点为自变量,糖脂代谢指标为因变量构建单因素线性回归模型。结果显示,睡眠中点越迟,空腹血糖、1 h餐后血糖、2 h餐后血糖和曲线下面积(AUC)均越小(P均<0.05)。以糖脂代谢指标为自变量,SGA为因变量构建单因素logistic回归模型,结果显示,空腹血糖、1 h餐后血糖、2 h餐后血糖、AUC、TG与SGA呈负相关(P均<0.05)。结果 见表5、6。
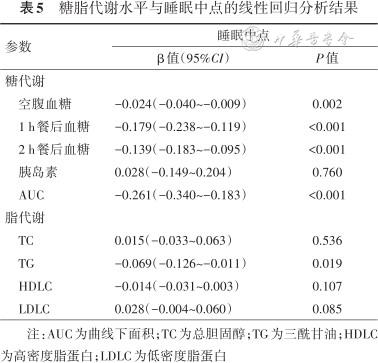
糖脂代谢水平与睡眠中点的线性回归分析结果
糖脂代谢水平与睡眠中点的线性回归分析结果
| 参数 | 睡眠中点 | |
|---|---|---|
| β值(95%CI) | P值 | |
| 糖代谢 | ||
| 空腹血糖 | -0.024(-0.040~-0.009) | 0.002 |
1 h餐后血糖 | -0.179(-0.238~-0.119) | <0.001 |
2 h餐后血糖 | -0.139(-0.183~-0.095) | <0.001 |
胰岛素 | 0.028(-0.149~0.204) | 0.760 |
AUC | -0.261(-0.340~-0.183) | <0.001 |
| 脂代谢 | ||
TC | 0.015(-0.033~0.063) | 0.536 |
TG | -0.069(-0.126~-0.011) | 0.019 |
HDLC | -0.014(-0.031~0.003) | 0.107 |
LDLC | 0.028(-0.004~0.060) | 0.085 |
注:AUC为曲线下面积;TC为总胆固醇;TG为三酰甘油;HDLC为高密度脂蛋白;LDLC为低密度脂蛋白
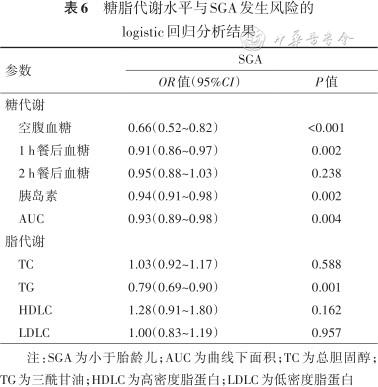
糖脂代谢水平与SGA发生风险的logistic回归分析结果
糖脂代谢水平与SGA发生风险的logistic回归分析结果
| 参数 | SGA | |
|---|---|---|
| OR值(95%CI) | P值 | |
| 糖代谢 | ||
空腹血糖 | 0.66(0.52~0.82) | <0.001 |
1 h餐后血糖 | 0.91(0.86~0.97) | 0.002 |
2 h餐后血糖 | 0.95(0.88~1.03) | 0.238 |
胰岛素 | 0.94(0.91~0.98) | 0.002 |
AUC | 0.93(0.89~0.98) | 0.004 |
| 脂代谢 | ||
TC | 1.03(0.92~1.17) | 0.588 |
TG | 0.79(0.69~0.90) | 0.001 |
HDLC | 1.28(0.91~1.80) | 0.162 |
LDLC | 1.00(0.83~1.19) | 0.957 |
注:SGA为小于胎龄儿;AUC为曲线下面积;TC为总胆固醇;TG为三酰甘油;HDLC为高密度脂蛋白;LDLC为低密度脂蛋白
6. 糖脂代谢在睡眠时点对SGA影响中的作用:以睡眠中点为自变量,糖脂代谢指标为中介变量,SGA为因变量,构建基于Bootstrap法的中介模型。结果显示,糖代谢模型中,空腹血糖(间接效应量为7.23×10-5,P<0.001)、餐后1 h血糖(间接效应量为1.01×10-3,P<0.001)和AUC(间接效应量为2.00×10-3,P<0.001)的中介效应均成立;脂代谢模型中,TG(间接效应量为8.97×10-4,P<0.001)的中介效应成立。未发现餐后2 h血糖在睡眠中点对SGA影响中的中介效应(间接效应量为3.49×10-4,P=0.300)。
本研究结果显示,睡眠中点越迟(从凌晨02∶45开始),SGA发生风险越高,未发现基于多因素模型睡眠时长与SGA的统计学关联。在此基础上增加糖脂代谢分析,中介模型结果显示,睡眠中点对SGA的负性作用可能存在糖/脂代谢这2种途径。
既往研究中,睡眠时长与SGA的统计学关联仅在部分结果中体现[18, 19],本研究结合除睡眠时长以外的就寝/晨起指标来探索其与SGA的关系,新发现的结果或许为这种不一致的原因找到了部分解释。睡眠时长反映的是就寝时点和晨起时点的差值,睡眠中点为睡眠时长这种相对量指标提供了固定的时刻点,其与SGA的多因素分析中仍然显示出统计学关联,这提示SGA或许并非受睡眠时长影响,而是受睡眠时点所影响,将就寝和晨起时点结合起来分析的结果也证明了这一点。补觉行为不仅不能保护健康,反而会显著增加SGA发生风险。“二次打击”理论可能部分解释了本研究观察到的这种效应:就寝时点紊乱(第一次打击)后的起床时间进一步紊乱(第二次打击),可能加剧了生物节律紊乱,产生更为严重的健康危害。类似研究也证明了这一点[9]。
睡眠时点对不良妊娠结局负性影响的具体机制尚不清楚。本研究发现,睡眠中点迟的孕妇空腹血糖、餐后1 h血糖、餐后2 h血糖和TG水平均更低,且分娩时的SGA率更高。既往研究显示,晚睡型人群入睡时间更长,睡眠中点随之相应推迟,血糖水平降低,瘦素、胰岛素、生长激素等分泌不足[20, 21],母体本身的营养失调使其供给胎儿的子宫胎盘血流灌注不足,为适应宫内环境,胎儿的原有发育进程将被适应性重编程[22],胰岛素抵抗随之增强[23],由此带来的生长发育受限最终引起SGA等不良出生结局[23]。然而,匹兹堡大学的一项研究显示,短睡眠时长和睡眠中点迟均与较高的GDM率有关[10],本研究结果与其在睡眠时长上一致,在睡眠时点上相矛盾。鉴于睡眠时点与孕期糖代谢的相关文献仍尚少,更多的研究证据有待发现。
本研究在方法学上具有以下三方面优势:(1)前瞻性研究设计,能够更为准确地获得研究信息,并能从时间顺序上提供更为有效的因果关联论证;(2)样本量较大,且设定了严格的纳入和排除标准,并控制了多种重要混杂因素(如饮食摄入、体力活动等),统计分析结果更为可靠;(3)使用限制性立方样条回归模型,为探索睡眠时点与SGA风险的全局关系提供了更全面准确的科学证据。本研究尚存在以下不足:(1)睡眠行为信息由孕妇主观自评,可能受到孕妇身心健康因素的影响;(2)睡眠质量缺乏评价,这可能对本研究结论产生一定影响。同时,SGA影响因素广泛,尽管本研究控制了大量混杂因素,但仍缺失对一些因素的控制,如孕期心理情绪、遗传等因素;(3)研究人群仅限于中国的一个城市,在结论外推至不同社会经济状况的地区时可能会受一定的限制;(4)数据资料未涉及孕早期的分析,然而影响SGA的孕期增重、糖脂代谢等重要因素的改变幅度在孕中期及以后更明显[24],故睡眠模式对SGA影响的关键期可能从孕中期开始。有关全孕期睡眠模式与SGA的高质量研究有待开展。
综上所述,相比于睡眠时长,睡眠中点可能是SGA潜在的危险因素,且其部分作用可能通过干扰糖脂代谢水平来实现。孕妇应遵循正常昼夜节律,即使入睡迟也应尽量按照正常作息晨起,以避免睡眠模式进一步紊乱,减少不良妊娠结局的发生。
所有作者均声明不存在利益冲突



























