
证实新生大鼠前庭内侧核(MVN)与前庭传出(VE)神经元之间的直接投射通路并观察该通路的电生理特性。
选用新生(9±1)d的Wistar大鼠,雌雄不限。通过全细胞膜片钳记录技术,刺激MVN,记录VE的突触后电流;逆行刺激脑干面神经膝部(g7)内侧VE的分布区,记录MVN区域传入神经元的动作电位,并使用生物胞素染色方法明确被记录的神经元的位置和形态。
在电流钳记录中,位于g7内侧的VE神经元静息膜电位范围为-70~-55 mV。单脉冲电流(0.08 mA,0.1 Hz,100 μs)刺激MVN前庭传入神经元,在同侧g7内侧的VE神经元可记录到兴奋性突触后电流,其幅度和持续时间分别为(195.6±23.7)pA和(23.9±5.9)ms。电刺激g7内侧VE神经元分布区后,MVN神经元可记录到逆行动作电位,幅度为(62.0±4.3)mV,持续时间为(94.9±4.7)ms。生物胞素染色标记也显示投射到g7内侧VE分布区的神经元胞体位于MVN内。
MVN的前庭传入神经元存在直接投射到g7内侧VE神经元的兴奋性通路,其生理功能可能与前庭中枢对外周前庭传入的反馈调节有关。

哺乳动物前庭系统解剖结构复杂,其功能和作用仍不完全清楚[1]。位于内耳的前庭感受器接受刺激后将信息经初级前庭神经元传递至位于脑干的前庭核团,在此将前庭觉与视觉、本体觉等信息进一步整合后,通过传出将信号送达各处有功能联系的神经核团,引起各种前庭反射,也可以进一步投射至更高级的中枢区域进行精细调节。前庭传出(vestibular efferent,VE)神经元主要分布在脑干面神经膝背外侧、背内侧、脑桥尾侧网状核区[2, 3, 4]。有研究表明VE可以影响前庭传入系统的兴奋性、修饰前庭终末器官输出的传入信号[5, 6, 7, 8]。本课题组之前的研究中通过向前庭注射不能跨突触的逆行神经示踪剂确定了大鼠VE神经元的位置并观察到其与前庭内侧核(medial vestibular nucleus,MVN)传入神经元之间存在突触联系[9]。本研究试图通过验证脑干层面MVN的传入神经元与VE神经元之间的电生理联系,推测该通路可能具有的调节功能。
选用新生(9±1)d的无特定病原体(SPF)级Wistar大鼠,雌雄不限。动物由复旦大学上海医学院动物中心(中国上海)提供。
1. 配制人工脑脊液(ACSF):pH为7.40~7.45,成分为124 mmol/L NaCl,3.0 mmol/L KCl,1.2 mmol/L KH2PO4,2.4 mmol/L CaCl2,1.3 mmol/L MgSO4,26 mmol/L NaHCO3,10 mmol/L葡萄糖。
2. 脑组织切片:新生大鼠腹腔注射1%的戊巴比妥钠(美国Sigma公司)50 mg/kg,深麻醉后处死大鼠并迅速取脑;将剥离出的脑干置于4 ℃低温处理的ACSF中,并不断向该溶液中通入95%氧气和5%二氧化碳组成的混合气体;使用振动切片机(德国徕卡公司)制作g7区域脑干组织的冠状面振动切片,片厚500 μm。
3. 组织孵育:在电生理记录前,将切片置于ACSF中,通入95%氧气和5%二氧化碳组成的混合气体,在(32±1)℃的温度下孵育至少1 h。
将培养的切片转移到膜片钳记录槽中,使用铂金丝网压住固定。以2 ml/min的恒定速率向槽中灌流ACSF,温度保持在20~25 ℃。在正置显微镜下(×4/×40水浸物镜,BX50W1型,日本Olympus公司),参考Paxinos和Watson大鼠脑立体定位图谱,定位g7位置[10]。显微镜下可看到g7对称地分布于第四脑室底偏外侧,为均质的椭圆形结构,没有成群的神经元胞体存在。根据神经元的位置和特点确定MVN和VE神经元的分布区域[11],并在可视状态下将刺激电极(日本光电公司)放置在MVN。
选用胞体丰满、边界清晰的g7内侧VE神经元作为实验对象,将含有电极内液的玻璃电极(内阻4~8 MΩ)缓慢推进至与刺激电极同侧的VE神经元胞体处,使电极尖端与细胞膜之间形成>1 GΩ的高阻封接。刺激电极和记录电极的位置如图1所示。给予小而短促的负压使电极尖端下的小片细胞膜破裂,调至电流钳模式,通过全细胞膜片钳模式记录细胞的静息膜电位。在电压钳模式下将VE神经元钳制在-70 mV处,刺激同侧MVN(刺激电流参数:0.8 mA,0.1 Hz,100 μs),记录VE神经元突触后电流。电极内液pH为7.2,以氢氧化钾调配,成分包括130 mmol/L葡萄糖酸钾,10 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES),10 mmol/L乙二醇双氨乙基醚四乙酸(EGTA),0.1 mmol/L CaCl2,2 mmol/L ATP-K2,1 mmol/LMgCl2。信号放大器为AXON-200B(美国AXON公司),数据采集系统为Digidata 1200(美国Synaptosft公司)。
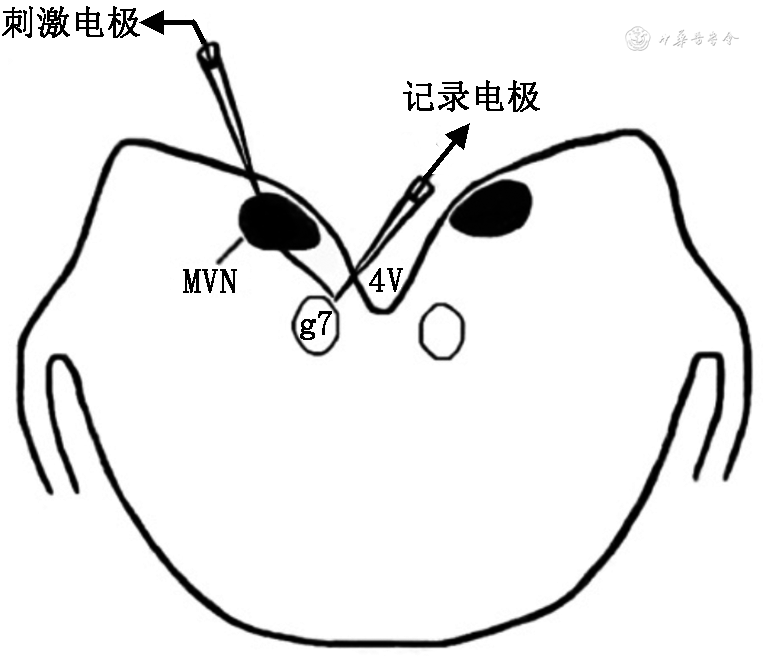

注:MVN为前庭内侧核;g7为面神经膝;VE为前庭传出;4V为第四脑室
完成全细胞记录后,将刺激电极电流增加至 +0.25 mA×10 s进行烧灼,造成直径约50 μm的损毁区。切片移至4 ℃的4%多聚甲醛溶液中固定24 h后,先后浸入20%和30%蔗糖溶液中各24 h,用冰冻切片机(德国徕卡公司)制作冷冻切片,片厚50 μm。0.1 mmol/L磷酸盐缓冲液(pH 7.4)漂洗3次,每次10 min。置于载玻片上并用盖玻片覆盖,在显微镜下观察(德国徕卡公司),确定刺激电极位置。
将刺激电极置于g7内侧的VE神经元分布区,记录电极内加入1 mg的生物胞素(美国Sigma公司),并置于同侧的MVN内行膜片钳全细胞记录。刺激VE神经元分布区(刺激电流参数:4 mA,0.1 Hz,100 μs)后,记录MVN神经元的逆行动作电位,之后用去极化电流(500 ms,5 nA,1 Hz,10 min)将生物胞素导入MVN神经元。切片固定后制作冰冻切片(同上),在显微镜下观察标记的神经元。
使用Mini Analysis Program 6.0.3(美国Synaptosft公司)分析电生理数据。并采用Stata 13.0(美国StataCorp公司)统计软件进行描述性统计分析,符合正态分布的计量资料采用表示。
g7内侧的VE神经元呈梭形,胞体较小,为10~15 μm。本研究用电流钳成功地记录了10个饱满的VE神经元。这些神经元的静息膜电位范围为-70~-55(-62.2±4.7) mV。
使用单脉冲电流(0.08 mA,0.1 Hz,100 μs)刺激MVN的传入神经元,在同侧g7内侧的VE神经元可记录到有稳定潜伏期的诱发性兴奋性突触后电流,其峰值潜伏期为(15.45±2.02) ms,幅度和持续时间分别为(195.6±23.7) pA和(23.9±5.9) ms。记录电极的位置见图2A,细胞的形态见图2B,电刺激的位置见图2C,记录到的突触后电流如图2D所示。
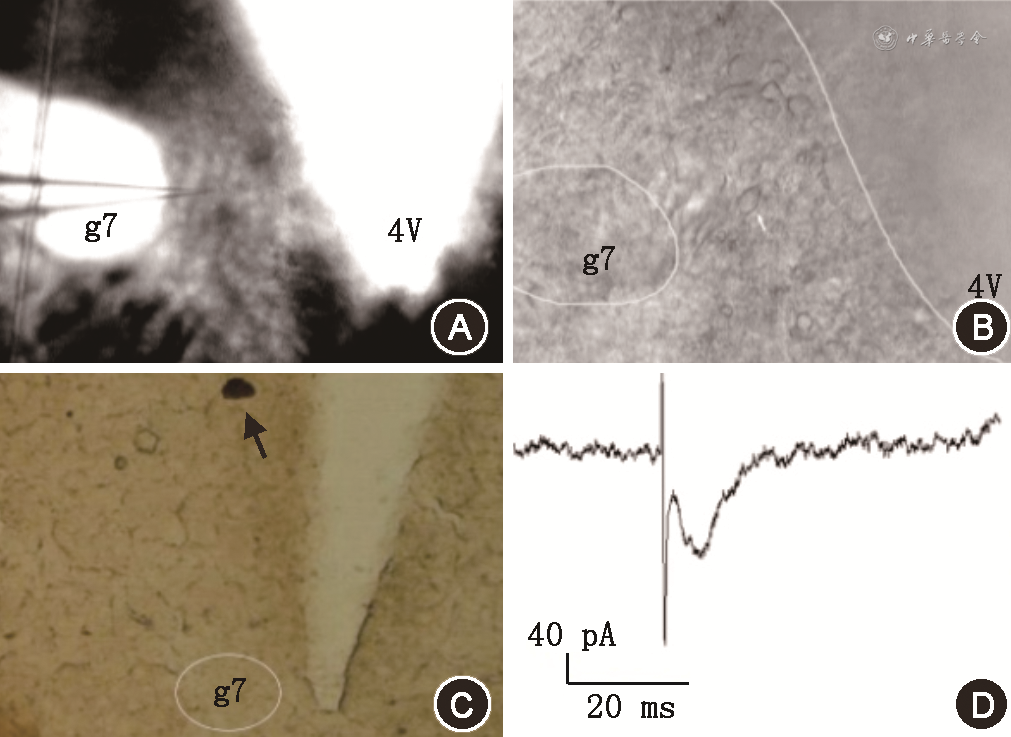

注:D图左下角为比例尺图示,水平线段长度代表时间为20 ms,垂直线段长度代表电流幅值为40 pA;MVN为前庭内侧核;4V为第四脑室;g7为面神经膝
刺激VE神经元分布区后,在MVN神经元记录到诱发性逆行动作电位,其有稳定的潜伏期(6.84±1.02) ms,能跟随200 Hz以上的高频刺激。其波形表现为A类神经元的特点[12],幅度为(62.0±4.3) mV,持续时间为(94.9±4.7) ms。生物胞素标记进一步定位所记录的神经元位于MVN内,胞体外形呈梭形或椭圆形,有3~4个树突(图3)。
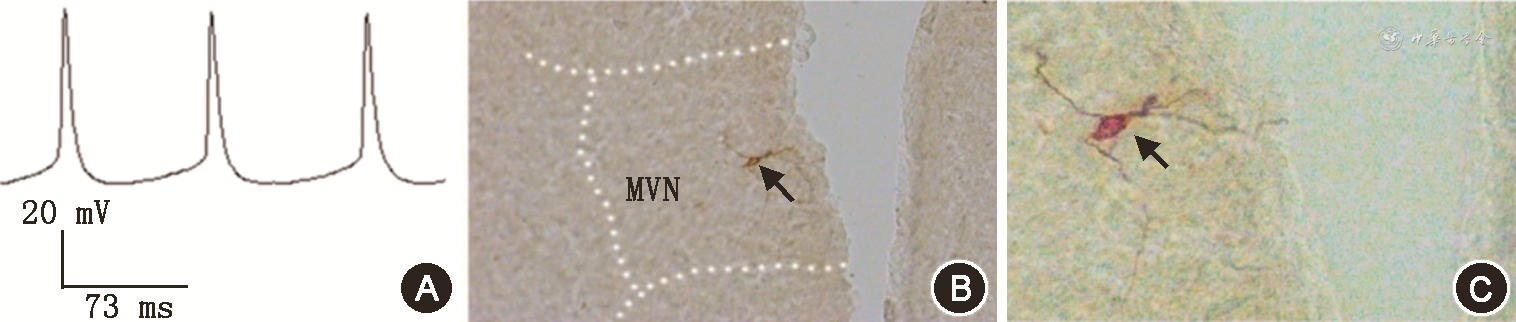

注:g7为面神经膝;MVN为前庭内侧核
根据Demêmes等[13]报道,大鼠出生时感觉上皮下即可检测到少量传出纤维,到出生后第8天,传出神经系统的大部分纤维通路已建立突触联系。新生(9±1)d大鼠的传出神经系统已基本发育,具备研究传出通路所需的解剖结构。与成年大鼠相比,振动切片机处理新生大鼠的脑组织相对容易,并且新生大鼠的大脑对缺氧有很强的耐受力,其中的神经元可以在健康状态下存活更长时间[14]。因此,出生后8~10 d的新生大鼠非常适合本研究。
在本研究中,g7内侧的VE神经元体积小,呈梭形,静息膜电位为(-62.2±4.7) mV。Leijon和Magnusson[5]报道转基因小鼠位于第四脑室附近脑干背侧的VE神经元的静息膜电位为(-76.49±2.68) mV。Mathews等[15]报道小鼠位于g7背外侧自发放电的VE神经元的静息膜电位为(-58.2±6.2) mV,非自发放电的VE神经元的静息膜电位为(-55.8±7.1) mV。这些实验结果和本研究记录到的VE神经元的平均静息膜电位略有不同,可能与动物种类不同,以及VE神经元的位置和状态有关。
本课题组在前期研究中将逆行神经示踪剂(美国Thermo Fisher公司FluoSpheres®,carboxylate-modified microspheres,molecular probes F-8793)注射到大鼠g7外侧的VE神经元区域后,发现被标记的神经元主要分布在前庭核(尤其是MVN、外侧核和上核)与网状核内[4],提示前庭核神经元可以向VE神经元发出投射,前庭核与VE神经元之间存在着密切的关系。随后,通过激光共聚焦技术进一步在形态学上验证了g7内侧和外侧的VE神经元均与来自MVN的传入神经之间有突触连接[9]。为了解该通路的电生理功能和特点,在本研究中,刺激MVN神经元,并记录同侧g7内侧的VE神经元的突触后电流,发现该通路主要为兴奋性成分。这不仅提供了MVN的前庭传入神经元和VE神经元之间存在直接神经投射通路的电生理证据,还证实了脑干MVN传入神经元对VE神经元的调节主要为兴奋性作用。同时,通过静息膜电位的记录描述了g7内侧VE神经元的生理特点。
为了进一步明确调节g7内侧VE神经元的前庭传入神经元是否位于MVN,本研究将刺激电极放置在g7内侧的VE神经元分布区,逆行记录MVN区域传入神经元的动作电位,同时用生物胞素标记记录的神经元。结果显示,记录到的神经元分布于MVN,呈梭形或椭圆形,多具有3~4个树突。
本研究运用膜片钳电生理技术,验证了MVN传入神经元与VE神经元之间存在直接的投射通路。该通路主要以兴奋性调节为主,其生理功能可能与前庭中枢对外周传入的反馈调节有关。本课题组前期研究发现,VE神经元投射到双侧的外周前庭,以对侧为主[9]。有研究证实VE神经元可兴奋外周Ⅰ型和Ⅱ型前庭毛细胞的传入神经末梢,并可直接对Ⅱ型毛细胞产生抑制作用[5]。Goldberg和Fernández[6]报道,电刺激VE系统后,大部分传入神经元的电活动增强,而<1%的前庭传入神经元被抑制。这说明VE系统不仅可以兴奋前庭传入系统,还可抑制前庭传入系统。VE系统可以修饰前庭终末器官输出的传入信号[7, 8]。据此可提出假设,当一侧外周前庭受刺激导致传入信息发生兴奋性变化后,可通过该通路直接将变化的信息传递给VE神经元。如果刺激信号过强,则通过VE神经元对对侧外周前庭的兴奋性作用以及对同侧外周前庭的抑制性作用进行反馈调节,防止双侧外周前庭过度不对称而诱发眩晕症状;如果刺激信号太弱,则通过VE神经元对对侧外周前庭的抑制性作用以及对同侧外周前庭的兴奋性作用进行反馈调节,使双侧外周前庭的传入信号对比更加精确。本课题组通过电刺激及毁损破坏MVN,改变前庭传入的兴奋性,发现ChAT阳性的VE神经元分别在干预后的6 h及5 d数目有增多[16],提示了VE神经元确实会对前庭传入信号的改变作出反应。也有临床研究发现增加外周前庭信息输入的训练有助于改善眩晕症状[17],推测可能与该通路的调节有关。本研究为进一步了解前庭功能的生理调节及今后代偿机制的研究提供了解剖学和电生理学基础,其具体的调节机制尚待于深入探讨。
所有作者均声明不存在利益冲突



























