
回顾性分析2016年6月至2018年1月北京协和医院神经科的18例Lambert-Eaton肌无力综合征(LEMS)患者的临床资料并应用放射免疫沉淀法检测其P/Q型电压门控钙离子通道(VGCC)抗体。抗体阳性率15/18,抗体阳性和阴性组性别、年龄、病情严重程度、肿瘤患病率比较差异均无统计学意义。抗体阳性组病程较短(1.9年比7.6年,P=0.04),高VGCC抗体滴度的临床表现更丰富,抗体滴度与复发具有显著相关性(τ=0.48,P=0.02)。

Lambert-Eaton肌无力综合征(LEMS)是一种发病率较低的自身免疫性神经肌肉接头疾病,由Eaton和Lambert等[1]在1957年第一次描述,文献报道患病率3.4/10万[2],临床表现为肌无力、自主神经障碍及腱反射消失三主征。本病根据合并肿瘤分为两种情况,肿瘤相关的LEMS(T-LEMS)和非肿瘤相关的LEMS(NT-LEMS),前者发病年龄更晚,最常见为小细胞肺癌(SCLC),后者更容易合并其他自身免疫性疾病[3]。80%~100%的LEMS外周血中可出现P/Q型电压门控钙离子通道抗体(VGCC-Ab)[4],该抗体作用于突触前膜的钙通道,影响运动神经末梢递质的传递,导致肌肉接头的功能障碍。本研究拟描述LEMS外周血中VGCC-Ab的阳性率及滴度范围,探讨抗体阳性的LEMS临床特点,分析与高抗体滴度相关的临床因素。
1. 对象:对2016年6月至2018年1月在北京协和医院神经科临床LEMS队列中18例患者的临床资料进行回顾性分析,所有入组的患者均需要满足以下条件:具有典型的临床症状[5]且电生理检查结果符合LEMS。临床表现包括:(1)肢体近端为主的进行性无力,伴或不伴眼外肌、颅面肌、躯干肌受累;(2)自主神经功能障碍:如口干、便秘、阳痿和(或)直立性低血压;(3)腱反射显著减低或消失。电生理检查包括低频电刺激和高频电刺激:(1)采用2~5 Hz低频电流刺激运动神经,复合肌肉动作电位(CMAP)波幅下降15%提示低频递减;(2)采用20~50 Hz高频电流刺激尺神经,CMAP波幅递增100%提示高频递增。应用重症肌无力复合量表(MGC)评估入组时病情严重程度。本研究符合《赫尔辛基宣言》中对伦理的要求。
2. 方法:应用横断面研究的方法分析LEMS临床资料,应用放射免疫沉淀法(RIA)对LEMS血清进行VGCC-Ab检测,商业试剂盒采购于英国RSR公司,按照说明书方法检测,结果以沉淀I125-ω-芋螺肽浓度(pmol/L)表示[6],>30 pmol/L认为阳性,反之阴性。同时定量检测抗乙酰胆碱受体抗体(AChR-Ab)和骨骼肌特异性酪氨酸激酶抗体(MuSK-Ab)的浓度,半定量检测抗核抗体(ANA)、抗副肿瘤抗体(抗Hu抗体和抗Amphiphysin抗体)的浓度。
3. 统计学方法:采用Empower stats软件对数据进行统计学分析(http://www.empowerstats.com,X&Y solutions,Inc.,Boston MA和http://www.Rproject.org)。年龄、抗体滴度、MGC符合正态分布的计数资料用表示,组间比较应用t检验;病程、随访时长不符合正态分布按M(Q1,Q3)表示,组间比较应用Mann-Whitney U检验;分类变量如性别、肿瘤患病率、复发按例(%)表示,组间比较应用χ2检验。抗体与年龄、病程、MGC的相关性分析用Pearson相关性检验,与性别、肿瘤、复发的相关性检验应用Kendall相关性检验。双侧检验,α=0.05。
1. 基本资料及临床表现:18例LEMS患者中,男女比例11∶7,发病年龄60.0(48.5,68.0)岁,检测抗体时病程为2.7(1.6,3.7)年,MGC评分(10.0±5.2)分。17例(17/18)以下肢无力起病,17例(17/18)腱反射显著减低或消失。8例(8/18)有下肢肌肉疼痛,多为运动时出现。7例(7/18)有口干、眼干和便秘等自主神经异常症状,5例有运动迟缓、走路不稳的锥体外系症状,1例出现睡眠增多和精神行为异常,1例有不安腿综合征,1例双侧锥体束征阳性。无一例AChR-Ab或MuSK-Ab阳性,有7例(7/18)合并至少一种ANA或副肿瘤抗体。15例(15/18)有CMAP波幅显著下降,出现运动后易化现象4例。针极肌电图检查9例有肌源性损害,无一例有神经源性损害。7例单纤维肌电图(SFEMG)可见棘波增多、Jitter增宽或阻滞。
2. 病理结果:8例(8/18)因影像学异常进行组织学病理检查,小细胞肺癌4例,肺腺癌1例,胸腺瘤1例,肺内神经内分泌癌1例,1例CT和PET-CT提示肺内占位,外院活检提示恶性肿瘤,病理类型不详。
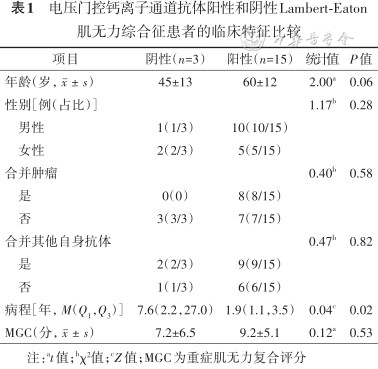
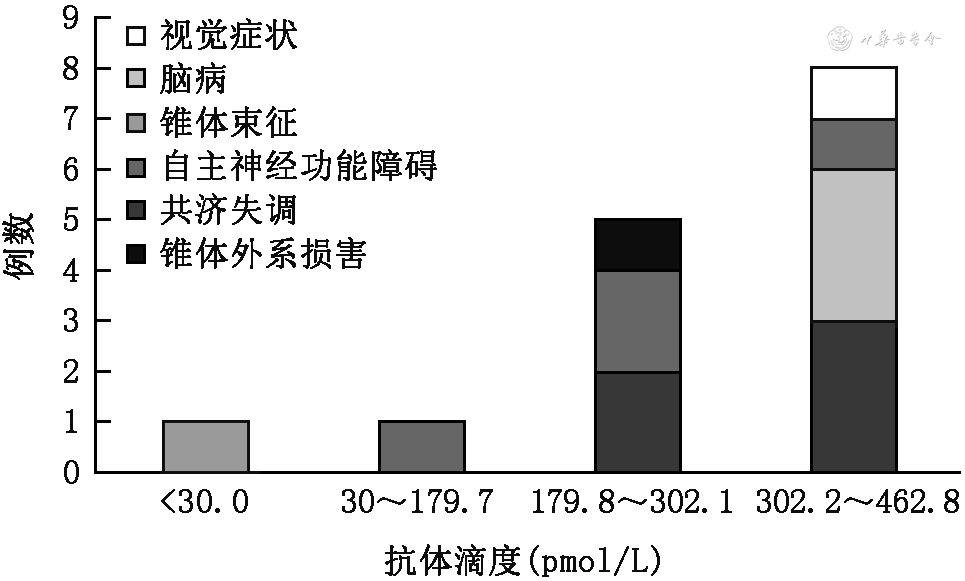
3. VGCC-Ab阳性LEMS的临床特征:VGCC-Ab阳性的LEMS共15例(15/18),抗体阳性率15/18,抗体浓度(260±139)pmol/L。抗体阳性和阴性组性别、年龄、MGC和肿瘤患病率比较差异均无统计学意义(表1)。抗体阴性组发病时程更长(7.6年比1.9年,Z=0.02,P=0.04)。根据VGCC-Ab滴度值均分为四组,VGCC-Ab较高时临床表现最丰富(图1)。
电压门控钙离子通道抗体阳性和阴性Lambert-Eaton肌无力综合征患者的临床特征比较
电压门控钙离子通道抗体阳性和阴性Lambert-Eaton肌无力综合征患者的临床特征比较
| 项目 | 阴性(n=3) | 阳性(n=15) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 45±13 | 60±12 | 2.00a | 0.06 |
| 性别[例(占比)] | 1.17b | 0.28 | ||
男性 | 1(1/3) | 10(10/15) | ||
女性 | 2(2/3) | 5(5/15) | ||
| 合并肿瘤 | 0.40b | 0.58 | ||
是 | 0(0) | 8(8/15) | ||
否 | 3(3/3) | 7(7/15) | ||
| 合并其他自身抗体 | 0.47b | 0.82 | ||
是 | 2(2/3) | 9(9/15) | ||
否 | 1(1/3) | 6(6/15) | ||
| 病程[年,M(Q1,Q3)] | 7.6(2.2,27.0) | 1.9(1.1,3.5) | 0.04c | 0.02 |
| MGC(分,) | 7.2±6.5 | 9.2±5.1 | 0.12a | 0.53 |
注:at值;bχ²值;cZ值;MGC为重症肌无力复合评分

4. 治疗和随访:将治疗后MGC较前下降≥3分为改善,病情加重较前上升≥3分定义为复发。14例(14/17)溴吡斯的明治疗有效,14例(14/15)糖皮质激素治疗有效,6例在激素减量后症状加重。5例(5/6)接受人丙种球蛋白治疗有效,5例(5/7)应用硫唑嘌呤有效。18例患者随访时间14.5(6.0,30.0)个月,6例(6/18)经历1次以上复发。将VGCC-Ab与发病年龄、病程、MGC、复发、肿瘤进行相关性分析,发现VGCC-Ab滴度与复发存在显著相关性(τ=0.48,P=0.02),复发组抗体滴度显著高于改善组[(281±107)比(174±84)pmol/L,P=0.03]。
VGCC抗体在LEMS中的病生理机制已得到了一定的研究,例如用LEMS血清被动免疫小鼠,应用冷冻蚀刻电镜技术观察致病性的IgG抗体结合到了突触前膜的活性区[7],VGCC-Ab通过交联、受体内化作用使突触前神经末梢的钙通道表达下调[8]。本研究中LEMS的VGCC-Ab阳性率15/18,国外的报道阳性率接近90%[9],值得注意的是本研究中部分患者在抗体测定前接受了长程的免疫治疗。VGCC-Ab阳性和阴性患者在性别、年龄、MGC、肿瘤方面未体现差异,表明VGCC-Ab不能作为区分上述特征的生物标志物。抗体阴性的患者就诊时病程更长,考虑有以下原因:(1)较低的抗体水平可能与肿瘤手术经历或长程免疫治疗有关;(2)抗体阴性的患者更容易存在诊断延迟的问题。
抗体滴度与MGC无关,抗体阴性的LEMS也可出现较高的MGC评分,提示VGCC-Ab可能并非LEMS单一致病抗体。文献表明,LEMS还可合并2型抗神经元核抗体、N型VGCC-Ab、Y染色体性别决定区相关高迁移率超家族1(SOX1)抗体及抗转录中介因子1-γ(TIF1-γ)抗体[10, 11, 12]等自身抗体,预计在今后的拓展研究中进一步补充。
本研究结果表明,VGCC-Ab高者病情更复杂,文献表明抗体高者易出现小脑共济失调[13],推测高滴度抗体患者可能合并其他中枢抗体。在多表型的LEMS中本研究发现了其他自身抗体包括ANA、抗Ro抗体、抗副肿瘤抗体。此外,有研究指出抗体高者重复电刺激(RNS)阳性率可达100%,抗体低者RNS阳性率偏低[14],国内有学者认为可对抗体阴性者适当放低电生理判定标准,有助于减少对LEMS的漏诊[15]。
抗体滴度与肿瘤无关,这与文献中报道结果一致。在一项对LEMS进行的研究中,提出VGCC-Ab不能预测肿瘤,而年龄、吸烟史、体重下降等指标可协助识别潜在肺部肿瘤[16]。本研究中NT-LEMS也具有高滴度VGCC-Ab。分析可能的原因如下:(1)总体随访时间不足两年,有潜在风险,肿瘤可能还未发现;(2)有其他VGCC-Ab产生的途径。
抗体高与复发存在关联,首次发现,但干扰因素多,例如入组时未严格控制发病时间,抗体受到诸如病程、手术、免疫性药物的使用等干扰,还需要进一步探索。
LEMS患者P/Q-VGCC-Ab阳性率83.3%,抗体滴度呈正态分布,VGCC-Ab滴度越高的LEMS患者临床表型越丰富。高抗体滴度与复发存在关联,但还需进一步探讨验证。
所有作者均声明不存在利益冲突



























