
腹腔镜解剖性肾上腺切除术(LAA)是一种基于腹腔镜经腹肾上腺切除术的术式,主要用于治疗肾上腺小体积病变。本文回顾性分析接受LAA的74例患者的临床资料,所有患者术后未发现影像学复发征象。LAA具有较高的安全性和可行性,术中解剖层次清晰,空间操作性好,术后并发症低,为小体积肾上腺病变的治疗提供了更可靠的选择。

自从Gagner等[1, 2]1992年首次描述经腹腹腔镜肾上腺切除术后,腹腔镜肾上腺切除术迅速发展成为大多数外科肾上腺疾病治疗的金标准。2007年张旭等[3]提出后腹腔镜解剖性肾上腺切除术,使得腹腔镜肾上腺切除术在中国的应用更加广泛。基于腹腔镜时代的不断发展和后腹腔镜解剖性肾上腺切除术的推广,本文总结了经验,旨在介绍一种治疗肾上腺小体积病变的手术方式——腹腔镜解剖性肾上腺切除术(laparoscopic anatomical adrenalectomy,LAA),根据层面外科精准解剖原则,详细描述LAA手术步骤,同时提供相关临床证据。
1. 对象:回顾性分析2019年10月1日至2020年9月30日在贵州省人民医院接受LAA的患者的临床资料。纳入标准:(1)年龄18~80岁;(2)术前影像学提示病变≤3 cm;(3)醛固酮-肾素比值,即血浆醛固酮浓度/血浆肾素浓度(ARR)>30(ng·dl-1)/(ng·ml-1·h-1)(1 ng/dl=27.7 pmol/L,1 ng·ml-1·h-1=12.8 pmol·L-1·min-1)且卡托普利试验结果提示卡托普利试验后2 h醛固酮≥0.11 μg/L[4];(4)肾上腺静脉采血(AVS)明确单侧病变;(5)美国麻醉医师协会(ASA)分级≤Ⅲ级;(6)术前功能状态评分(KPS)评分≥70分。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
2. 术前准备:(1)根据指南[5],所有肾上腺相关疾病患者术前均应纠正高血压和低钾血症[血压≤150/90 mmHg(1 mmHg=0.133 kPa)、血钾3.5~5.5 mmol/L];(2)术前30 min静脉滴注头孢丙烯2 g预防性抗感染治疗;(3)术前不常规行肠道准备;(4)接受左侧LAA手术患者术前均留置胃管行胃肠减压;(5)除7例男性良性前列腺增生患者因明显的排尿困难症状留置导尿外,其余患者术前均无需留置导尿。手术均由同一名腹腔镜经验丰富的泌尿外科医师完成。
3. 左侧LAA手术步骤(图1):


(1)体位及trocar位置:患者右侧卧位且尽可能贴近手术床边缘,腰部对准手术床的腰桥部位,确定患者冠状面垂直于手术床长轴,使患者腹部脂肪垂下手术床;右下肢轻度屈膝,左下肢伸直,胶带固定肩部及髋部。Trocar位置分别是:观察孔位于腹直肌外侧缘平脐上方2 cm,主操作孔和第二操作孔位于左季肋缘下,由于患者个体差异,二者的位置不固定,与观察孔构成等腰三角形即可,主要操作区域指向脾脏。
(2)肾上腺手术区域游离:进入腹腔后距降结肠旁1 cm,从尾侧向头侧打开结肠旁沟显露肾筋膜及其平面,将乙状结肠推向腹中线,当手术视野中出现左生殖静脉时即达到左肾筋膜和乙状结肠间隙。在此间隙内继续向头侧游离直至发现胰腺,到达胰腺后间隙,避免进入小网膜囊。顺着胰腺后间隙向头侧游离脾脏,手术视野中会依次出现左膈下静脉、肝脏左叶和部分胃底等解剖标志,将游离后的脾脏往腹中线方向翻下,离开脾床,以便充分显示左侧肾上腺区域。
(3)制备肾上腺切除的手术空间:显露肾脏脏面:沿肾被膜分离左侧肾上腺周围脂肪与左侧肾脏,这个区域被视为无血管区,不会造成大量的出血。显露腰大肌平面:沿腰大肌膈下静脉分支及腰大肌平面之间切开,逐渐游离左肾上腺,该过程尽量沿腰大肌平面进行操作,避免损伤膈下静脉。
(4)左侧肾上腺切除:完成上述操作后左肾上腺组织轮廓已完全显露,左侧肾上腺与左侧肾动静脉之间有较多束状血管,建议使用Hem-o-lok夹闭后离断,以此保持清晰的术野,减少术后创面渗血、渗液。最后将左肾上腺中央静脉提起,Hem-o-lok夹闭后离断,完成左侧LAA。
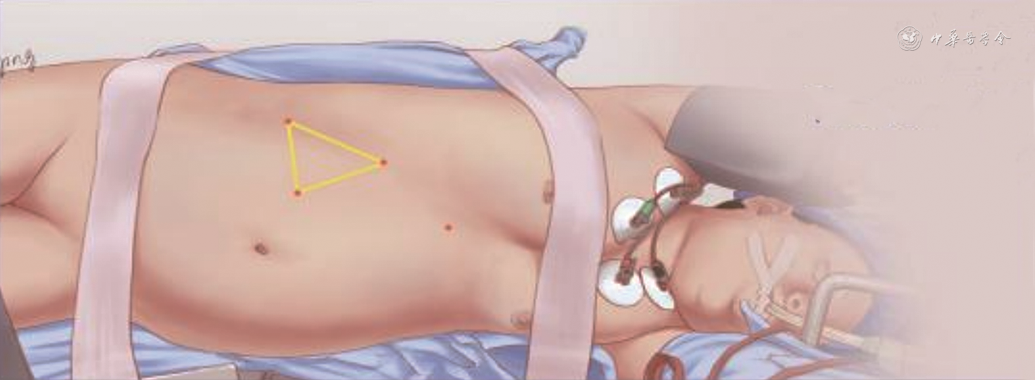



(1)体位及trocar位置:患者左侧卧位,腰患部对准手术床的腰桥部位,确定患者冠状面垂直于手术床长轴,使患者腹部脂肪垂下手术床;左下肢轻度屈膝,右下肢伸直,胶带固定肩部及髋部。Trocar位置分别如下:观察孔位于右侧腹直肌外侧缘平脐水平上方2 cm;主操作孔位于右腋前线与右侧季肋缘下的交点;第三操作孔与观察孔及主操作孔构成等边三角关系,由于个体差异,该孔大致位于右侧髂前上棘上方,平脐水平;第四操作孔位于剑突下,在整个手术过程由助手帮助抬起肝脏,暴露手术操作空间。
(2)右侧肾上腺手术区域游离:打开腔静脉鞘:在肝脏下缘、右肾筋膜外侧打开腔静脉鞘,沿该平面向上打开腔静脉鞘至肝脏下缘,向下至右肾静脉,直至显露腔静脉与右肾静脉夹角;游离肝脏周围组织:沿肝脏下缘腹膜及肾筋膜平面打开肝脏右侧三角韧带和肝肾韧带,该过程切勿进入肾周脂肪,不能接触肾上腺,直至显露右侧膈下静脉,助手借助剑突下第四操作孔置入的无损伤抓钳将肝脏向上抬起暴露手术操作空间。
(3)制备肾上腺切除的手术空间:显露肾上腺上极:在显露肾上腺上极的过程中,术者需保持肾上腺上极与肾上腺之间的空间距离,切勿损伤肾上腺导致出血,造成手术层面及视野的混乱;显露肾脏脏面:在肾静脉平面寻找肾上极被膜,切勿损伤肾动脉,紧贴右肾被膜分离右肾上极和右侧肾上腺周围脂肪,这个区域被视为无血管区,超声刀可完成无血化离断;显露腰大肌平面:左手抬高肾上极,向背侧分离肾周脂肪,显露腰大肌。显露该平面有助于快速分离肾上腺,腰大肌平面与肾上腺之间是一个无血管平面。
(4)右侧肾上腺切除术:右侧肾上腺组织在肾静脉和腔静脉侧有很多束状血管,超声刀离断有极大可能引发出血,建议使用Hem-o-lok夹闭后离断减少出血。完成上述周围组织和平面的游离后,右侧肾上腺中央静脉映入眼帘,建议使用Hem-o-lok夹闭后离断,最终完成右侧LAA。
5. 术后治疗流程:(1)术后1 h静脉注射非甾体抗炎药氟比洛芬酯300 mg,术后1 d改为口服非甾体抗炎药(塞来昔布 200 mg/次,2次/d)缓解疼痛,随后逐渐减量直至停止;(2)术后4 h即可下床活动,促进肠蠕动及胃肠功能恢复;待肛门排气后即进流质饮食,此后逐渐过渡为普通饮食;(3)若无明显并发症,术后2 d出院,嘱患者自行监测24 h血压变化情况并记录,返院复查时携带该记录本。
6. 随访情况:术后1、3和6月于门诊接受肾上腺影像学检查及相关血液指标检查,查看血压记录本,必要时安排内分泌科医师及心内科医师介入后续治疗。
7. 统计学处理:数据录入统一采用Epidata3.0 软件,应用SPSS 23.0软件对数据进行分析。手术时间(定义为皮肤切开到切口关闭的时间)、术中失血量、术后首次排气时间、术后住院时间、总住院时间为计量资料符合正态分布,以表示;术后第1天视觉模拟评分(VAS)为偏态分布,以M(Q1,Q3)表示。采用独立样本t检验进行两组间比较。双侧检验,检验水准α=0.05。
1. 一般情况:本研究共纳入74例患者的临床资料,年龄(45.7±13.3)岁,其中男性31例,术前体质指数(BMI)≤24 kg/m2的患者50例,术前影像学提示病变手术侧为左侧56例、右侧18例。
2. 围手术期情况:以BMI和手术侧作为分层指标,结果提示BMI和手术侧并不影响患者手术时间、出血量、术后疼痛程度以及住院时间(均P>0.05)(表1)。术后除7例男性患者术前因良性前列腺增生所致排尿困难留置导尿外,其余患者均未留置导尿管、胃管及腹腔引流管。74例患者术后均未出现发热、大出血、相关脏器损伤及死亡等并发症。病理组织学结果提示68例肾上腺腺瘤,6例肾上腺增生。所有患者术后1、3和6个月随访提示血压和血钾恢复正常,不需要口服药物干预,复查肾上腺CT平扫+增强未见复发征象。
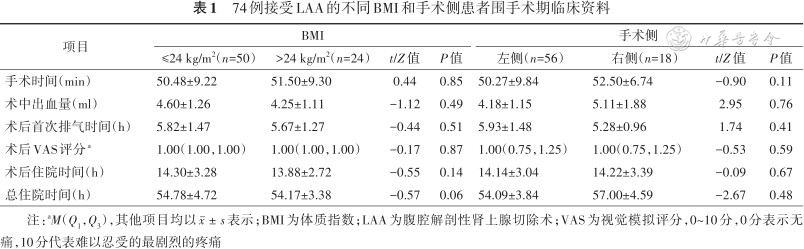
74例接受LAA的不同BMI和手术侧患者围手术期临床资料
74例接受LAA的不同BMI和手术侧患者围手术期临床资料
| 项目 | BMI | 手术侧 | ||||||
|---|---|---|---|---|---|---|---|---|
| ≤24 kg/m2(n=50) | >24 kg/m2(n=24) | t/Z值 | P值 | 左侧(n=56) | 右侧(n=18) | t/Z值 | P值 | |
| 手术时间(min) | 50.48±9.22 | 51.50±9.30 | 0.44 | 0.85 | 50.27±9.84 | 52.50±6.74 | -0.90 | 0.11 |
| 术中出血量(ml) | 4.60±1.26 | 4.25±1.11 | -1.12 | 0.49 | 4.18±1.15 | 5.11±1.88 | 2.95 | 0.76 |
| 术后首次排气时间(h) | 5.82±1.47 | 5.67±1.27 | -0.44 | 0.51 | 5.93±1.48 | 5.28±0.96 | 1.74 | 0.41 |
| 术后VAS评分a | 1.00(1.00,1.00) | 1.00(1.00,1.00) | -0.17 | 0.87 | 1.00(0.75,1.25) | 1.00(0.75,1.25) | -0.53 | 0.59 |
| 术后住院时间(h) | 14.30±3.28 | 13.88±2.72 | -0.55 | 0.14 | 14.14±3.04 | 14.22±3.39 | -0.09 | 0.67 |
| 总住院时间(h) | 54.78±4.72 | 54.17±3.38 | -0.57 | 0.06 | 54.09±3.84 | 57.00±4.59 | -2.67 | 0.48 |
注:aM(Q1,Q3),其他项目均以表示;BMI为体质指数;LAA为腹腔解剖性肾上腺切除术;VAS为视觉模拟评分,0~10分,0分表示无痛,10分代表难以忍受的最剧烈的疼痛
随着腹腔镜时代和层面外科理论的飞速发展,本团队对腹腔镜经腹肾上腺切除术有了新的思考和体会,提出了LAA手术方式。进行左侧LAA手术时,留置胃管行胃肠减压有利于减少术中胃胀气引起的干扰。明确3个trocar位置上的等腰三角关系,有助于更好地游离脾脏。沿着胰腺后间隙仔细游离,找到视野中含有肝脏左叶、膈下静脉以及部分胃底这样的解剖标志是将脾脏松解并翻到对侧的关键,术后随访未出现脾脏扭转的情况。右侧LAA手术成功的关键在于右侧肾上腺中央静脉的准确解剖和手术平面的精准游离。打开腔静脉鞘,对腔静脉鞘上下缘的充分游离是寻找右侧肾上腺中央静脉的要点,切断肝脏右侧三角韧带和肝肾韧带过程中必须紧贴肾筋膜外平面,且动作轻柔避免出血模糊手术视野。将肾上腺周围组织充分游离,使得术者在手术中能够更加准确及从容地对病变的肾上腺组织进行分离及切除。LAA手术时间短于国内外报道的经腹腹腔镜肾上腺切除术的手术时间(65.6、95.9和103.5 min)[6, 7, 8],同时左侧LAA和右侧LAA手术在手术时间上差异无统计学意义。
针对LAA手术本身而言,不论左右,对于患者体位的要求都是侧卧位,尽量靠近手术床缘,使得腹部脂肪在重力作用下下垂,有利于术中手术平面的分离。因为对体位的严格要求,BMI>24 kg/m2和BMI≤24 kg/m2两组患者的手术时间差异无统计学意义,这与Lan等[9]和Agcaoglu等[10]的研究报道相反,差异在于文中并未对患者手术体位做出类似要求。LAA手术成功的另一个关键在于使用Hem-o-lok夹闭离断肾上腺周围的束状血管,既往经验使用超声刀电凝离断束状血管对于模糊手术视野的影响较大,改良后使得术野更加清晰。
本研究所有患者围手术期管理均结合加速康复外科(enhanced recovery after surgery,ERAS)的相关理念及内容[11]。在实现围手术期“无管化”的原则下,除少数老年男性因良性前列腺增生术前留置导尿外,其余患者术后均未放置导尿管、胃管和腹腔引流管。术后正规使用非甾体镇痛药物,不论是BMI分层组还是手术侧分层组,术后第一天VAS评分均低于Zou等[12]及Chen等[13]报道的2.3分和2.6分。良好的术后镇痛有助于患者较早下床活动促进肠蠕动排气及伤口愈合,患者术后平均14 h即可出院,总住院时间平均为55 h(约2.29 d),短于Balci等[8]报道的2.8 d。
肿瘤大小通常被认为是预测肾上腺病变良恶程度和手术方式选择的一个参数,但它仍然具有相对不敏感性和非特异性[14],文献报道大约75%直径6 cm以下的肾上腺肿瘤在最终病理报告中是良性的[15]。为更准确描述LAA手术的安全性,本团队将肿瘤的纳入直径限定为≤3 cm,结果证明,74例接受LAA手术的患者术中术后未出现大出血、中转开放、感染、相关脏器损伤甚至死亡等并发症。从手术疗效性分析,术前未将双侧肾上腺病变纳入研究,且保证AVS采血后明确对侧肾上腺分泌功能正常,肾上腺全切保证术后切缘阴性、避免肾上腺微腺瘤残留等情况,术后半年内血液学及影像学未见复发征象,证明LAA手术疗效明确。
LAA手术能够完整地、安全地、有效地将小体积肾上腺病变切除,是年资较浅的泌尿外科医师系统学习肾上腺切除术的一个选择。本研究有一定的局限性,纳入标准排除了双侧病变的患者,导致会出现一定的选择性偏倚;初次筛选患者信息时,由于收集信息缺失、误差,纳入病例数目可能出现信息偏倚。未来的研究会继续增大样本量,确保LAA手术的安全性和有效性。
本文图片由医学插画师马新颖绘制
所有作者均声明不存在利益冲突



























