
原发性醛固酮增多症(PA)是以高血压和低血钾为主要临床表现的疾病,大量的PA患者未能被正确地诊断,隐藏在庞大的高血压人群中未能接受正确的治疗。本文将系统地阐述PA的精准影像学诊断进展,分析其优缺点,并提出PA精准影像学诊断的思考和建议。

原发性醛固酮增多症(primary aldosteronism,PA)的经典临床表现为高血压和低血钾,然而只有少数患者有典型的高血压和低血钾临床表现,大量的PA患者隐藏在庞大的高血压人群中未能被发现。1、2、3级高血压患者中,PA的患病率分别为1.99%、8.02%和13.20%,而在难治性高血压患者中PA的患病率更高(17%~23%)[1]。PA的5种分型中,最常见的是双侧肾上腺增生而致的特发性醛固酮增多症,主要推荐药物治疗;而肾上腺腺瘤和单侧肾上腺增生的PA患者则以手术切除为主要治疗手段。
PA的生化特点是血浆低肾素水平和高醛固酮水平。但由于醛固酮的脉冲分泌受到盐摄入和多种降压药物的影响,同时肾脏和血管对醛固酮的敏感性在种族和个体之间存在一定差异,因此在诊断PA时,血浆醛固酮水平不能确切诊断,临床需要结合醛固酮与肾素比值(aldosterone to renin ratio,ARR)和血浆醛固酮浓度(plasma aldosterone concentration,PAC)临界值对不同人群进行诊断[2],但由于缺乏统一的诊断流程和检测方法,ARR的切点值变化范围非常大,年龄、性别、饮食、体位、血钾及肌酐等都是影响ARR的重要因素。因此,单从生化指标对PA进行诊断是相当片面的。
大部分临床医生仍然认为PA非常罕见[3],在绝大多数临床医生的潜意识里,筛检PA患者就是“大海捞针”[4]。为了提高PA的诊断正确率,肾上腺静脉采血(adrenal venous sampling,AVS)已成为各大指南诊断PA的金标准。但AVS操作技术要求高,导致其尚未普及到国内各级医疗机构。
临床医生应该认识到,PA的高患病率是高血压病因筛查时的一个重要影响因素。当疾病的预测概率在10%~30%时,任何筛查测试的增量增益都是最大的[5]。因此,PA的精准影像学诊断亟待研究。
诊断PA的影像学检查中,临床应用最广泛的仍是CT,因为其不会因患者在成像过程中的不自主运动产生伪影[6]。CT在定位大体积肾上腺肿瘤时非常准确,在动态成像中通常表现出迅速的轻度增强和快速冲洗。单纯性肾上腺增生在CT上的密度和信号与正常肾上腺相同,但某些病灶在未增强成像上的密度可能低于正常肾上腺。弥漫性肾上腺增生通常表现为整个肾上腺均匀增厚,维持其整体正常的倒V或倒Y外观。结节性肾上腺增生,如果结节足够大,则可在横断面成像识别。但在诊断小体积肾上腺腺瘤和单纯性肾上腺增生时,CT的显影就不那么明显了。因此,单纯的CT平扫和增强检查已不能满足PA的诊断。
相较于普通的肾上腺CT平扫和增强而言,肾上腺CT薄层扫描具有更低的层厚和层距(1~5 mm),能够更清晰、更细致地显示病变的形态和密度,从而提高病灶检出率,避免遗漏微小病变,但同时造成伪影的可能性也增加,导致最终诊断出现假阳性的概率也相对升高。虽然薄层CT的应用提高了PA的检出率,但无功能的小体积肾上腺腺瘤及单纯性肾上腺增生并不能单从薄层CT的影像学结果上得到准确的诊断。
CT三维重建则是在薄层CT的基础上对图像进行重新处理和重建,肾上腺CT三维重建可视化能够促进AVS的成功,Chayovan等[7]的研究结果提示,三维可视化后左侧AVS的成功能率达到96%。依据肾上腺CT三维重建可视化后的影像学证据能够为外科医生在进行肾上腺手术操作时提供良好的影像学建议,确保手术顺利进行。
MRI在不使用电离辐射的基础上提供了优秀的软组织信息。在MRI采集过程中脂肪信号比水信号显像更慢,这一现象可用于识别组织或体素同一区域的脂质和水。大多数肾上腺腺瘤因为含有脂质[8],成像可以被优化,以突出脂肪的存在,从而能够在不采用AVS等有创检查手段的介入下明确诊断肾上腺腺瘤。除此以外,Israel等[9]曾报道MRI在诊断乏脂质肾上腺腺瘤时也优于CT平扫。
但也有学者认为,在使用MRI对疑似肾上腺腺瘤的患者进行诊断时,脂质并不是放射科医生对肾上腺腺瘤进行诊断时的首要判断依据,因为肾上腺病变的大小更值得引起放射科医生和临床医生的重视,随着肿瘤病变大小的增加,恶性肿瘤风险的可能性也在随之增长[10]。因此,他们在使用MRI进行PA诊断时的第一步是将影像学提示的病变大小与之前的影像学检查结果进行比较,以评估病灶的变化,其次才是判断病变图像是否存在脂质。
但是,除了大体积和含有脂质的肾上腺腺瘤以外,小体积的肾上腺腺瘤和单纯性肾上腺增生在MRI上的密度和信号与CT的影像学表现类似,因此,单从MRI对这类PA进行诊断也是不够准确的;同时考虑到MRI的空间分辨率较CT低以及价格较高等情况,临床上并不将MRI作为诊断PA的首要影像学选择。
无论是CT还是MRI,放射科医生和临床医生对于PA的诊断都不能做到100%准确。回归肾上腺的生理学基础,肾上腺分为肾上腺皮质和肾上腺髓质,基于其不同的生理学功能,MRI功能分子成像的出现能够记录并测量肾上腺不同部位的生理学参数,如血流、血容量和T1/T2参数或MRI指定的扩散成像。这些信息已被用于肿瘤学成像和癌症治疗随访等领域。随着多个“组学”(如基因组学、蛋白质组学和代谢组学)的研究越来越深入,MRI的分子成像所囊括的信息或许可以用来分析基因组数据与临床成像之间的相关性[11, 12]。它们可能对疾病的早期发现、分期和治疗有很大的益处。因此,在未来对于MRI组学与肾上腺肿瘤之间的相关性研究也会是一个重要的领域。
肾上腺的分子成像技术是在影像学的基础上利用放射性药物对肾上腺皮质和肾上腺髓质独特的功能特征具有特异性亲和力所完成的[13]。用于肾上腺成像的放射性药物作为前体进入激素生物合成途径,作为模拟激素的化合物或特定组织受体具有亲和力的配体。利用这些独特的内分泌组织特征,使用特定的放射性药物,不仅可以测量积累的过程,还可以描绘目标组织的内分泌功能。以这种方式在诊断和分析肾上腺病变中发挥作用,这一作用是随着单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)和正电子发射断层成像术(positron emission tomography,PET)即PET/CT和SPECT/CT的可用性发展起来的[14, 15, 16]。
1. 传统碘胆固醇成像:最传统的成像是20世纪70年代引入的以胆固醇为分子靶点的肾上腺皮质显像。经典的放射性胆固醇类似物是131I-19-碘胆固醇[17],随后又出现了如NP-59和75硒-硒甲基降胆固醇的改良版物质[18]。从病变的定位上来讲,NP-59显像对肾上腺皮质病变的诊断具有较高的特异性(100%)、敏感性(71%)和准确性(93%)[19]。然而,从定性角度来说,NP-59显像并不能对PA的病因(腺瘤或单纯性肾上腺增生)进行准确诊断。
NP-59显像有几个局限性。其一是放射标记示踪剂的摄取主要取决于肿瘤的大小,而不是分泌醛固酮的功能[20, 21],结果导致瘤体直径<1 cm的腺瘤出现假阴性结果。鉴于许多PA患者由于微腺瘤和单侧单纯性肾上腺增生出现CT阴性结果,高分辨率CT的假阴性结果也绝对是NP-59显像的一个限制[22]。第二个限制是摄取缺乏特异性,即示踪剂摄取不仅反映醛固酮的产生,同时也反映皮质醇和其他肾上腺皮质激素,所以在示踪剂给药前后需用地塞米松抑制正常肾上腺摄取,但地塞米松可能会引起各种不良反应。
因此,尽管NP-59显像在PA诊断中具有一定的特异性,但考虑到较小体积肿瘤未有被检出的报道以及使用前需使用地塞米松抑制等局限性,不作为当前临床诊断的首要选择。
2. 新型功能分子成像:随着研究的不断深入,酶抑制剂作为肾上腺显像的示踪剂已经成为热点,美托咪酯(metomidate,MTO)就是最典型的代表。在此基础上,不断出现的类似物或存在潜在相同靶点的化合物陆续成为研究的新切入点。表1总结了近30年来能够识别单侧PA的新功能成像研究[23, 24, 25, 26, 27, 28, 29, 30, 31]。
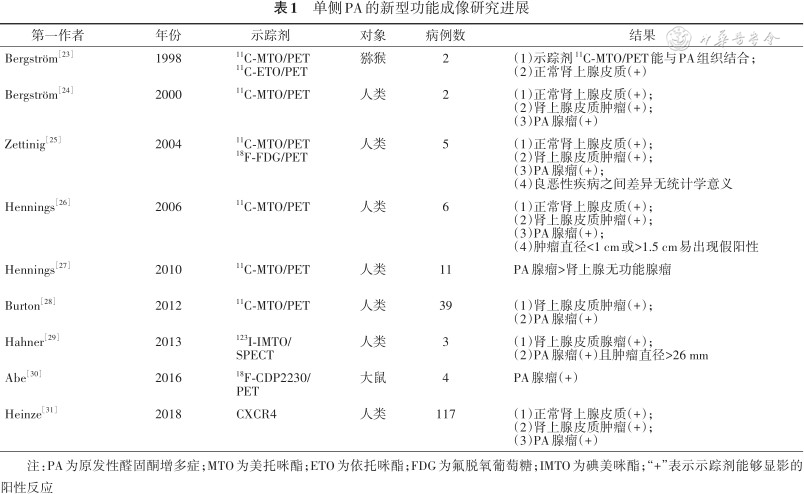
单侧PA的新型功能成像研究进展
单侧PA的新型功能成像研究进展
| 第一作者 | 年份 | 示踪剂 | 对象 | 病例数 | 结果 |
|---|---|---|---|---|---|
| Bergström[23] | 1998 | 11C-MTO/PET 11C-ETO/PET | 猕猴 | 2 | (1)示踪剂11C-MTO/PET能与PA组织结合; (2)正常肾上腺皮质(+) |
| Bergström[24] | 2000 | 11C-MTO/PET | 人类 | 2 | (1)正常肾上腺皮质(+); (2)肾上腺皮质肿瘤(+); (3)PA腺瘤(+) |
| Zettinig[25] | 2004 | 11C-MTO/PET 18F-FDG/PET | 人类 | 5 | (1)正常肾上腺皮质(+); (2)肾上腺皮质肿瘤(+); (3)PA腺瘤(+); (4)良恶性疾病之间差异无统计学意义 |
| Hennings[26] | 2006 | 11C-MTO/PET | 人类 | 6 | (1)正常肾上腺皮质(+); (2)肾上腺皮质肿瘤(+); (3)PA腺瘤(+); (4)肿瘤直径<1 cm或>1.5 cm易出现假阳性 |
| Hennings[27] | 2010 | 11C-MTO/PET | 人类 | 11 | PA腺瘤>肾上腺无功能腺瘤 |
| Burton[28] | 2012 | 11C-MTO/PET | 人类 | 39 | (1)肾上腺皮质肿瘤(+); (2)PA腺瘤(+) |
| Hahner[29] | 2013 | 123I-IMTO/ SPECT | 人类 | 3 | (1)肾上腺皮质腺瘤(+); (2)PA腺瘤(+)且肿瘤直径>26 mm |
| Abe[30] | 2016 | 18F-CDP2230/ PET | 大鼠 | 4 | PA腺瘤(+) |
| Heinze[31] | 2018 | CXCR4 | 人类 | 117 | (1)正常肾上腺皮质(+); (2)肾上腺皮质肿瘤(+); (3)PA腺瘤(+) |
注:PA为原发性醛固酮增多症;MTO为美托咪酯;ETO为依托咪酯;FDG为氟脱氧葡萄糖;IMTO为碘美咪酯;“+”表示示踪剂能够显影的阳性反应
(1)MTO11C-MTO/PET:近年来,各种酶抑制剂已被开发为肾上腺成像的候选示踪剂。最近用于治疗和诊断成像的分子靶点是CYP11B酶,它是合成醛固酮和皮质醇的关键酶。长期以来作为麻醉剂使用的MTO是临床研究中最具代表性的酶抑制剂化合物。它与肾上腺皮质CYP11B酶具有较高的特异性和亲和力。采用体外放射自显影技术,对包括人体在内的多种组织的11C-MTO的冷冻切片进行了研究,结果表明示踪剂在大鼠和猪的肾上腺皮质和PA患者的肾上腺中显影明显。这种结合对肾上腺具有高度的特异性(约100%),在肝脏中约有50%的结合,在其他器官中结合则不到10%[32]。
11C-MTO/PET作为肾上腺的非侵入性成像,从影像学精准定位诊断上证实了包括肾上腺皮质和非皮质的单侧肾上腺肿块病变[23]。在所有肾上腺皮质病变中,包括2例PA患者的腺瘤,均表现出特异性和显著的11C-MTO摄取,而非皮质病变(例如嗜铬细胞瘤等) 只有非常低的摄取。然而,由于MTO与CYP11B1和CYP11B2的亲和力相当,正常肾上腺也有明显的摄取,因此区分单侧和双侧PA是不可行的[23]。
大量对11C-MTO/PET的研究表明:①在肾上腺皮质组织和肿瘤中,11C-MTO是高度特异性的,但在髓质和非皮质肿瘤中则没有表达;②识别肾上腺皮质肿瘤的敏感性和特异性高;③肿瘤直径较小(特别是<1 cm),是成像的局限性。11C-MTO/PET在区分单侧和双侧PA时可作为AVS的敏感和特异性的无创功能成像替代,但该化合物对CYP11B2的特异性和对较小PA腺瘤的敏感性有限是需要进一步改善的主要限制。当AVS结果不是决定性时,这可能是PA诊断的一种互补成像方法[24]。
(2)碘美咪酯(123I-Iodometomidate,IMTO)/SPECT-CT:Hahner等[33]对肾上腺肿瘤患者CYP11B酶和肾上腺皮质肿瘤的分子成像进行了IMTO的相关研究。他们发现肾上腺皮质肿瘤(原发/转移性肾上腺皮质癌、双侧腺瘤)显示高特异性示踪剂摄取,而非肾上腺皮质肿瘤不显示[34]。示踪剂的摄取在肾上腺皮质肿瘤中高于非肾上腺皮质起源的肾上腺病变,敏感性为83%,特异性为86%。结果表明,123I-IMTO/SPECT从肾上腺疾病的定位上来说,在鉴别肾上腺皮质病变方面也是有用的,但考虑到SPECT的一般可用性和较长的示踪剂半衰期,与11C-MTO/PET相比,可以更广泛地使用。然而,右肾上腺和左肾上腺的摄取没有显著差异。
(3)依托咪酯(etomidate,ETO):放射自显影技术显示11C-ETO/PET与肾上腺皮质包括人肾上腺的特异性和高结合[23]。虽然11C-ETO和11C-MTO的结合有很好的相关性,但11C-ETO与肾上腺结合较低。11C-ETO/PET成像也被证明能在猴子体内可视化肾上腺,18F-FETO/PET在健康志愿者的人肾上腺中明显累积显影[23]。尽管这些结果表明,11C-ETO/PET和18F-FETO/PET对肾上腺皮质肿瘤的功能成像有潜在的应用价值,但未见更多针对包括PA在内的肾上腺皮质疾病患者的研究结果发表。
(4)CDP2230: 18F-CDP2230作为一种新型的显像剂,对CYP11B2的选择性高于MTO类似物[30]。体外放射自显影显示18F-CDP2230与肾上腺CYP11B2表达区的结合比123I-IMTO特异性更高。此外,研究表明,18F-CDP2230在肾上腺中积累,背景摄取量低。18F-CDP2230/PET可用于检测PA的单侧亚型。然而,CDP2230对CYP11B2和CYP11B1的亲和力明显低于MTO[30]。该化合物作为PET示踪剂在人体内的敏感性和特异性需要进一步的研究。
(5)趋化因子CXCR4:除了上述提到的以CYP11B为潜在靶点所进行的研究外,近年来还有研究者将趋化因子CXCR4作为新的研究切入口[35, 36]。Heinze等[31]发现,CXCR4在正常肾上腺皮质组织、肾上腺皮质腺瘤和PA腺瘤中的高表达,并且其表达与CYP11B2的表达密切相关。在纳入研究的117例PA患者中,肿瘤直径均>1 cm,所以对于肿瘤或病变直径≤1 cm的患者而言,该研究的敏感性和特异性还有待进一步证实。
尽管近几十年来随着分子成像技术的快速发展,大量的功能分子被纳入了PA的诊断范围,但这些研究目前都处于比较不成熟的阶段,期待未来看到这些新型功能分子成像在人体肾上腺应用的更多报道。
本文综述了传统影像学CT和MRI以及分子功能成像在诊断PA当中的研究进展应用,必须强调的是,近年来PA的诊断率取得显著提高是由于CT/薄层CT联合AVS的广泛应用。因此,CT仍然是临床医生对于PA进行诊断的首要影像学选择。随着科学技术的发展,期待内分泌代谢组学联合MRI分子功能成像将PA的精准影像学诊断推向崭新的时代。
所有作者均声明不存在利益冲突



























