
人呼吸道合胞病毒(HRSV)是婴幼儿发生严重下呼吸道感染的主要病原体,每年都会导致全球疾病流行,严重危害儿童健康。目前只有帕丽珠单克隆抗体(Palivizumab,Synagis®)可用于预防早产儿和免疫低下的儿童感染HRSV,但尚未引进国内进行临床应用。经过近70年的研究,仍没有被批准使用的HRSV疫苗,因此抗病毒生物制品的研究显得更加重要,尤其是一些特异性好、靶向性强的抗体类生物制品,其中纳米抗体ALX-0171、预防用单克隆抗体Nirsevimab和MK-1654在临床试验里已经展现出了令人惊喜的结果。本文梳理了HRSV抗体类生物制品的最新研究进展,希望加快我国抗体类生物制品的研发和临床试验的开展,减少婴幼儿HRSV感染的疾病负担。

人呼吸道合胞病毒(human respiratory syncytial virus,HRSV)是肺病毒科(Pneumoviridae)正肺病毒属(Orthopneumovirus)中唯一感染人的病毒,因此也称为人正肺病毒[1]。HRSV是一种单股负链RNA病毒,病毒颗粒直径100~300 nm,基因组长约15 Kb,包含10个基因,编码11种蛋白质。其中融合蛋白F(含有574个氨基酸)序列高度保守,诱导产生的中和抗体能中和A和B两个血清亚型的HRSV。F蛋白以三聚体形式存在,包含融合前(Pre-F)和融合后(Post-F)两种构象,Pre-F是一种亚稳定结构,当病毒与细胞发生融合后,可以向稳定的Post-F转变[2]。黏附蛋白G(含有298个氨基酸)是一种Ⅱ型跨膜糖蛋白,具有高度的变异性,诱导产生的抗体通常不能同时中和A和B两种血清亚型的HRSV[3]。
目前已经鉴定的6种抗原表位(site Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ø)均存在于Pre-F蛋白中,但Post-F只含有4种抗原表位(siteⅠ、Ⅱ、Ⅲ和Ⅳ)[4]。Pre-F特有的构象表位Ø位于F蛋白的顶端,识别位点是aa 62~69,aa 196~209,诱导中和抗体的能力高于其他表位[5]。抗原位点Ⅱ(aa254~277)是一种螺旋-转角-螺旋(Helix-loop-helix)结构[6],针对该表位的抗体类生物制品有帕丽珠单克隆抗体(Palivizumab,Synagis®)和纳米抗体ALX-0171。表位Ⅳ(表位C,aa427~437)是一种线性表位,针对表位Ⅳ的抗体有MAb19、MK-1654和101F等,其中MAb19是一种人源化抗体,在临床试验中未产生显著的疗效而宣布失败[7]。
HRSV通过直接接触和飞沫传播,是引起5岁以下儿童急性下呼吸道感染的首要病原[8],2岁以下的婴幼儿几乎都感染过HRSV,常常引起下呼吸道感染[9]。HRSV全球流行病学监测网络显示,2015年约有320万例5岁以下儿童因感染HRSV住院,导致约59 600例患儿死亡,其中包括27 300例<6个月的婴儿[10]。HRSV在老年人中同样具有较高的发病率与死亡率,英国科学家报道75岁以上老年人因感染HRSV而死亡的人数在1997—2009年期间呈上升趋势,而其他年龄段的死亡人数保持稳定[11]。据统计全球每年因HRSV感染产生的经济负担高于800亿美元,但尚无有效的疫苗,因此对抗病毒药物的研发具有极大的社会效益和商业价值。
过去只有气雾剂利巴韦林和Palivizumab被FDA批准用于治疗或预防HRSV感染引起的严重呼吸道疾病[12]。利巴韦林是一种广谱抗病毒药物,对多种RNA病毒有效,然而,利巴韦林的临床应用受到限制,雾化吸收的环境如果有妊娠女性,可能对胎儿有不良影响。并且利巴韦林具有非特异性的抗HRSV活性[12],因此美国儿科协会的指南不建议使用利巴韦林。Palivizumab只推荐用于早产儿、免疫低下的儿童和患有肺部相关疾病的老年人。
虽然尚未有安全有效的特异性药物,但是目前已经有多种针对HRSV治疗的药物研究,并取得了初步的进展,包括中药[13]、小分子药物[14]和RNA干扰技术(RNA interference,RNAi)等。中药可以直接抑制HRSV,也可以通过免疫调节增强机体的抵抗力[15, 16]。大量小分子药物处于临床试验阶段,包括融合抑制剂、核蛋白抑制剂和核苷类似物等[12],其中Presatovir(GS-5806)是由美国吉利德科学公司(Gilead Sciences)开发的一种新型口服抗HRSV药物[17],通过抑制HRSV进入宿主细胞发挥效用[18],在成人中开展的临床试验疗效显著。应用RNAi研发的药物ALN-RSV01同样具有良好的应用前景[19]。
预防和治疗HRSV的抗体类生物制品靶向性强、毒性低、易于优化,一直是全球各国研发的热点[20],抗体类生物制品通常指含有全部抗体、抗体片段或基因改造的蛋白生物制品[21]。本文对HRSV抗体类生物制品进行综述,希望国内早日开展相关的研发和临床试验。
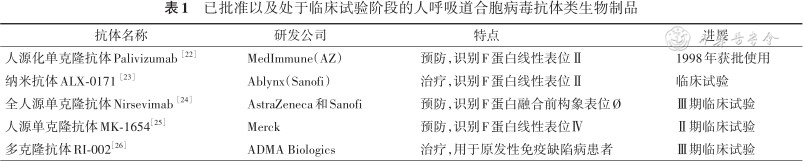
目前处于临床试验的HRSV抗体类生物制品共有4种(表1),包含纳米抗体ALX-0171、全人源单克隆抗体Nirsevimab、人源单克隆抗体MK-1654和多克隆抗体RI-002。已获批使用的抗体类生物制品只有人源化单克隆抗体Palivizumab。其中Palivizumab和ALX-0171识别F蛋白线性表位Ⅱ,MK-1654识别F蛋白线性表位Ⅳ,Nirsevimab识别Pre-F特有的构象表位Ø。Palivizumab、Nirsevimab和MK-1654通过肌肉注射途径预防HRSV感染,ALX-0171则通过雾化吸入治疗因HRSV感染引起的呼吸道疾病(图1)。
已批准以及处于临床试验阶段的人呼吸道合胞病毒抗体类生物制品
已批准以及处于临床试验阶段的人呼吸道合胞病毒抗体类生物制品
| 抗体名称 | 研发公司 | 特点 | 进展 |
|---|---|---|---|
| 人源化单克隆抗体Palivizumab [22] | MedImmune(AZ) | 预防,识别F蛋白线性表位Ⅱ | 1998年获批使用 |
| 纳米抗体ALX-0171 [23] | Ablynx(Sanofi) | 治疗,识别F蛋白线性表位Ⅱ | 临床试验 |
| 全人源单克隆抗体Nirsevimab [24] | AstraZeneca和Sanofi | 预防,识别F蛋白融合前构象表位Ø | Ⅲ期临床试验 |
| 人源单克隆抗体MK-1654[25] | Merck | 预防,识别F蛋白线性表位Ⅳ | Ⅱ期临床试验 |
| 多克隆抗体RI-002[26] | ADMA Biologics | 治疗,用于原发性免疫缺陷病患者 | Ⅲ期临床试验 |
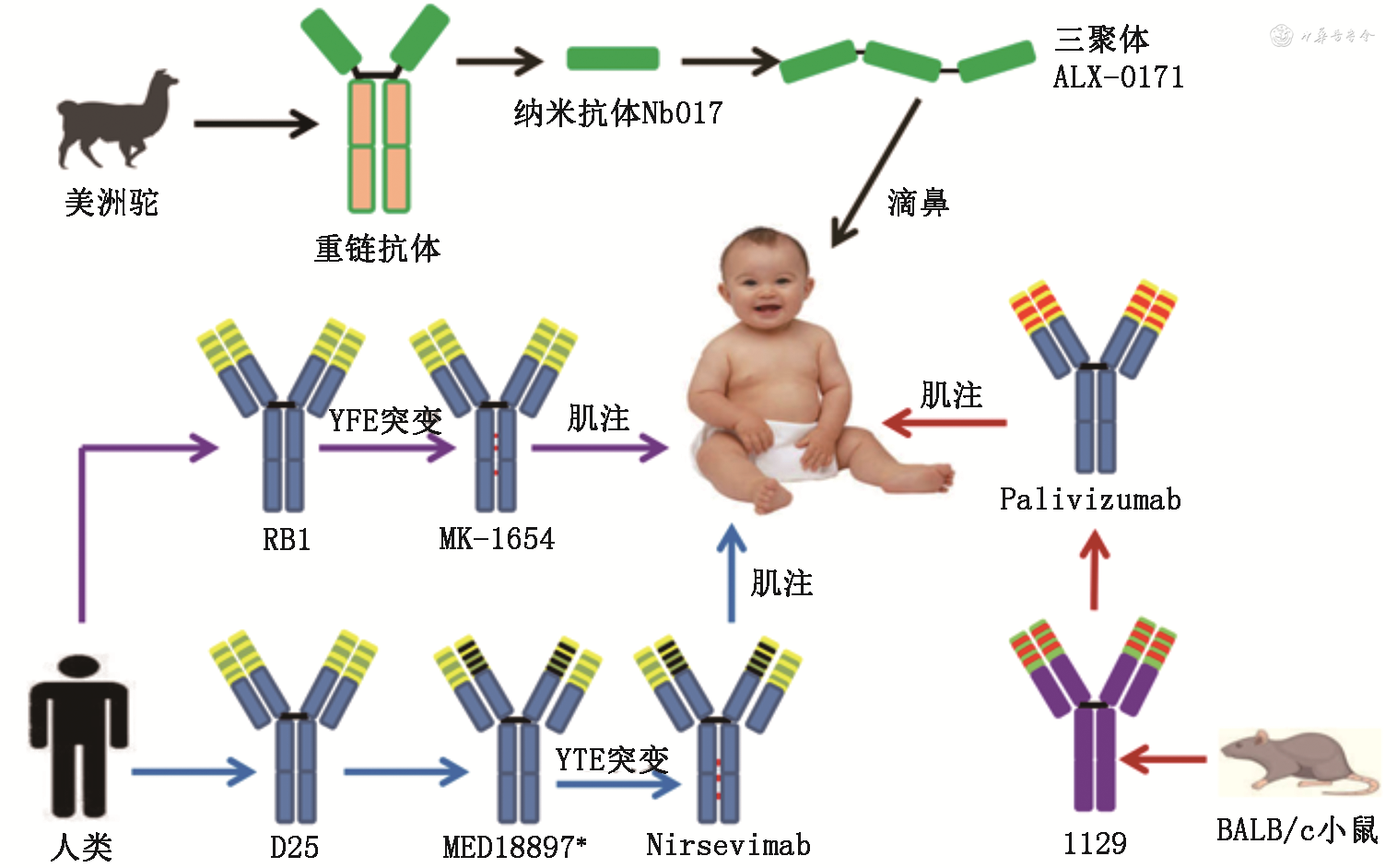

1.人源化单克隆抗体Palivizumab:Palivizumab属于人源化单克隆抗体,人源化单克隆抗体通常是用非人源单克隆抗体的互补决定区(complementarity determining region,CDR)替换人源单克隆抗体氨基酸序列,保留抗体的中和活性,降低外源抗体的免疫原性。Palivizumab由鼠源单克隆抗体1129进行人源化改造,将1129的CDR区嫁接到人IgG1抗体框架上,获得人源化单克隆抗体Palivizumab,如图1所示[27]。该类生物制品由MedImmune公司(2007年被阿斯利康收购)研发,并于1998年获得美国FDA批准,是目前唯一被批准使用的预防性单克隆抗体。Palivizumab价格昂贵,而且半衰期短,在整个HRSV感染季节,需要每月肌肉注射一次,因此只推荐用于早产儿、免疫低下的儿童和患有肺部相关疾病的老年人。Palivizumab的使用剂量为15 mg/kg,当血液浓度为40 mg/L可以有效预防婴幼儿HRSV感染[22]。
2.纳米抗体ALX-0171:ALX-0171是一种治疗性纳米抗体(nanobody),纳米抗体分子量小,组织穿透性好,特异性强,亲和力高,对机体的不良反应和毒性都非常低。如图1所示,骆驼科动物体中含有一种缺失轻链和重链第一个恒定区的特殊IgG抗体,被称作重链抗体(heavy chain antibody,HcAb)。HcAb的抗原结合部分只包含一种结构域,此结构域也被称为纳米抗体。比利时生物技术公司Ablynx[2018年,法国赛诺菲(Sanofi)公司以39亿欧元收购Ablynx]研发人员从美洲驼的免疫文库中筛选的纳米抗体Nb017(识别F蛋白的表位Ⅱ)可以有效中和HRSV。将3个纳米抗体Nb017通过柔性蛋白linkers(Gly-Ser,GS)连接形成三聚体抗体ALX-0171,在毕赤酵母菌株X-33中表达纯化的ALX-0171中和活性优于Palvizumab[23],通过雾化直接输送到肺部的,在剂型上也有明显优势[28]。Ⅱb期临床试验中,吸入ALX-0171的患儿(9 mg/kg)肺脏HRSV滴度显著降低[29]。HRSV感染只局限于呼吸道,鼻腔抗体滴度低是HRSV反复感染的一个危险因素[30],因此若能有效地输送抗体ALX-0171到肺部可以阻止HRSV感染。
3. 全人源单克隆抗体Nirsevimab:Nirsevimab是一种全人源单克隆抗体,Nirsevimab由全人源单克隆抗体D25优化改造而来,D25识别Pre-F蛋白构象表位Ø,对A和B两个亚型都有很强的中和作用,对HRSV A2和HRSV B9320毒株的半数最大抑制浓度(half-maximal inhibitory concentration,IC50)值为10.8 μg/L和7.1 μg/L。将D25互补决定区替换5个氨基酸,骨架区替换4个氨基酸后形成MEDI8897*,如图1所示。MEDI8897*对HRSV A2和HRSV B9320毒株的IC50值为2.2 μg/L和1.8 μg/L,中和活性比D25提高4倍左右。继续对MEDI8897*抗体可结晶片段(Fc)进行优化(替换M252Y、S254T和T256E三个氨基酸)形成Nirsevimab,该抗体在婴幼儿体内半衰期大大延长(62.5~72.9 d)[31],同时具有良好的安全性[24]。阿斯利康(AstraZeneca)与法国赛诺菲(Sanofi)公司合作开展的Ⅱb期临床试验显示,在HRSV流行季开始前给早产儿(29~35周)一次肌肉注射50 mg预防用生物制品nirsevimab,150 d后可使健康早产儿发生HRSV相关下呼吸道感染就医率和住院率分别降低70.1%和78.4%[32]。据新华网最新报道[33],nirsevimab针对健康婴儿的全球多中心双盲随机Ⅲ期临床试验结果显示,nirsevimab达到主要终点,即在整个典型的呼吸道合胞病毒流行季中,与安慰剂组相比,nirsevimab组中健康早产婴儿和足月婴儿因呼吸道合胞病毒引起的下呼吸道感染呈现具有统计学意义的绝对减少。安全性结果在nirsevimab组和安慰剂组之间无显著临床差异。
4.人源单克隆抗体MK-1654:MK-1654是一种人源IgG1单克隆抗体,为延长抗体的半衰期,对其亲代人源单克隆抗体RB1进行YTE突变,替换M252Y、S254T和T256E三个氨基酸获得MK-1654,该抗体的半衰期(73~88 d)比传统IgG1单克隆抗体高4倍。RB1识别F蛋白抗原位点Ⅳ,中和活性是Palvizumab的50倍,对呼吸道合胞病毒A和B亚型均有效,对A血清亚型的IC50值为2.9 μg/L[34]。在健康成年人群中的临床试验中,单次肌肉注射300 mg具有良好的安全性和耐受性[25],目前正在婴幼儿中开展二期临床试验。
5.多克隆抗体RI-002:RI-002是一种多克隆抗体预防用生物制品,从健康成年血浆池(具有高滴度的中和抗体的HRSV恢复期血浆)中制备的一种静脉滴注免疫球蛋白制剂。在三期临床试验中能有效预防原发性免疫缺陷病(primary immunodeficiency disease,PIDD)患者和其他免疫缺陷人群感染HRSV,未观察到明显的不良反应[26]。RespiGam(HRSV-IGIV)高免血清在1996—2003年用于预防2岁以下儿童(患有慢性肺部疾病或有早产史)感染HRSV[35],但该生物制品免疫不良反应较强,并且1998年不需要静脉注射的Palivizumab被批准使用,因此2004年RespiGam退出市场。
莫维珠单克隆抗体(Motavizumab)是Palivizumab的衍生物,对Palivizumab单克隆抗体重链和轻链的CDR区域进行氨基酸的替换获得了多种Palivizumab的突变抗体,其中Motavizumab结合F蛋白的能力是Palivizumab的70倍,中和HRSV的活性比Palivizumab高20倍[36],与Palvizumab之间只有13个残基不同,可显著减少棉鼠呼吸道中HRSV病毒滴度[37],但是在三期临床试验中,有些患者出现皮肤过敏反应,因此2010年AstraZeneca停止Motavizumab的研发,尚未获得FDA批准。Suptavumab(REGN2222)单克隆抗体是由美国再生元(Regeneron)生物技术公司研发的针对F蛋白的IgG1单克隆抗体类生物制品,在棉鼠中具有良好的保护效果。但是2017年的三期临床试验中,对早产儿使用一剂量或者两剂量的Suptavumab(30 mg/kg),150 d后没有达到预防早产儿感染HRSV后就医的主要终点[38],因此Regeneron终止了单克隆抗体Suptavumab的临床试验。
针对Pre-F蛋白构象位点Ø的全人源单克隆抗体Nirsevimab已经进入临床试验,同时也有针对该表位的鼠源性单克隆抗体5C4[39],5C4在小鼠体内的中和活性要比针对抗原表位Ⅱ的抗体高几十倍[40]。AM14人源单克隆抗体可以识别Pre-F蛋白的抗原位点,该抗体中和活性与D25单克隆抗体相当,并且AM14与F蛋白的结合不影响D25与F蛋白的结合,因此该抗体也具有很大的研发潜力[41]。
HRSV F蛋白历来被认为是疫苗和抗体类生物制品的靶点,但是黏附蛋白G的中心保守区域(aa163~189)同样是一个越来越引人注目的靶点,针对该区域设计的亚单位疫苗BBG2Na也进入过Ⅲ期临床试验[42, 43]。鼠源性单克隆抗体131-2G识别该区域的表位,可以通过阻止G蛋白与CX3CR1受体的结合干扰病毒吸附过程,这种单克隆抗体在早期治疗可以减少小鼠肺部炎症和肺病毒滴度,尚未研究在人体内的安全性和有效性[44]。
近几年HRSV疫苗研发已有较大突破,多种疫苗进入二期临床试验,包括亚单位疫苗[45]、载体疫苗和减毒活疫苗[46]等,但是仍然面临巨大挑战[47],因此预防用和治疗用生物制品的研发至关重要。纳米抗体ALX-0171分子量小,组织穿透性好,通过雾化直接输送到肺部的,雾化吸收是治疗呼吸道疾病的一种有效方法,与肌肉注射相比,雾化吸收具有非侵袭性、低成本、降低血源性疾病传播风险等显著优势,更容易被人类,尤其是儿童所接受[48],因此在剂型上有明显优势。目前进入临床试验的预防用单克隆抗体Nirsevimab和MK-1654同样展现出良好的应用前景,但是HRSV容易反复感染,抗体类生物制品能否预防婴幼儿反复感染以及在老年人中的保护效果仍需继续探讨。
所有作者均声明不存在利益冲突



























