
先天性心脏病(CHD)是我国出生缺陷的首位畸形,大多数常见CHD可通过经皮介入治疗取得良好效果。目前,常见CHD经皮介入治疗的循证医学证据不断涌现,我国原创的无放射线经皮介入技术也成为近年的发展热点,但是,我国在该领域的治疗意见仍停留在早期的专家共识阶段。鉴于此,本指南在充分借鉴全球最新临床研究成果的基础上,参考国际指南和中国国情,针对常见CHD经皮介入治疗的适应证、操作要点、并发症防治和术后随访等进行规范,以期为临床实践提供指导性意见。

先天性心脏病(congenital heart disease,CHD)发病率为0.7%~0.9%[1],我国现存CHD患者约400万,每年新出生CHD患儿约16万,造成严重的社会和经济负担[2, 3]。近30余年来,随着介入技术与器械的不断发展,我国CHD介入诊疗工作取得了巨大成绩[4, 5],CHD经皮介入治疗的规模居世界首位,心内科、心外科、儿科、放射科和超声科等多学科均参与了CHD经皮介入治疗工作。近年,无放射线引导经皮介入技术成为发展热点[6, 7, 8, 9, 10],这项中国原创技术使用经胸超声心动图(TTE)完全替代放射线进行经皮介入治疗,实现了“不开胸、无放射线、不全身麻醉”治疗常见CHD[11, 12, 13, 14, 15, 16],不但弥合了外科复合技术与内科经皮介入技术之间的分歧,而且以巨大的优势被推广到全球20多个国家和地区,初步建立起中国标准的技术体系。为了使CHD介入治疗技术在国内健康、有序开展,2007年国家卫生主管部门针对包括CHD介入技术在内的心血管诊疗技术颁布了《心血管疾病介入诊疗技术管理规范》[17],并且先后成立了国家CHD介入质控中心和国家经外科途径介入质控中心,对医疗机构和医师的准入资质、培训及病例数据库等进行了规范化管理和质量控制。为了更好地适应学科发展,合理、规范应用CHD介入技术,进一步提高医疗质量,国家卫生健康委员会于2021年合并了原国家CHD介入和经外科途径介入质控中心,成立国家结构性心脏病介入质量控制中心。该中心组织国内该领域相关专家对CHD经皮介入技术的适应证、操作要点、并发症防治和术后随访进行了讨论,在广泛征求意见的基础上形成了常见CHD经皮介入治疗指南(以下简称“本指南”)。本指南适用于所有临床医师,尤其是内科(心血管疾病、神经内科、呼吸与重症医学等)、外科(心外科、体外循环科等)、儿科、影像科及其他与CHD诊疗和管理相关学科的专业人员。指南推荐意见的应用目标人群为常见CHD患者。
本指南专家组参考国内外CHD介入治疗相关研究、指南和临床实践标准,主要回顾2000年1月至2021年4月发表的文献资料,并检索国内外的主要电子数据库,包括PubMed、中国知网和万方数据库,检索词包括“Congenital heart disease”“Transcatheter/Percutaneous intervention”“先天性心脏病”“经导管/经皮”“介入”及与各CHD相关的评估、检测和治疗等内容的关键词。
本指南设计与制订步骤依据2015 年《世界卫生组织指南制订手册》[18]以及2016年《中华医学杂志》发表的《制订/修订<临床诊疗指南>的基本方法及程序》[19],推荐意见采用推荐强度和证据等级相结合的方法,推荐强度和证据等级采用推荐分级的评估、制定与评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)分级系统[20](表1、2)。推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过2/3的专家意见。同时,借鉴和参考了国内外现有CHD介入治疗相关研究、临床指南和专家共识,指南相关的一些重要领域可能并不能在既往文献中找到理想依据,则需要专家组基于临床经验进行判断。
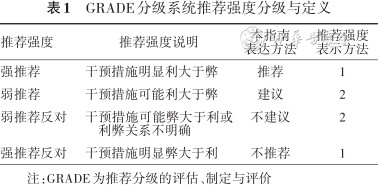
GRADE分级系统推荐强度分级与定义
GRADE分级系统推荐强度分级与定义
| 推荐强度 | 推荐强度说明 | 本指南 表达方法 | 推荐强度 表示方法 |
|---|---|---|---|
| 强推荐 | 干预措施明显利大于弊 | 推荐 | 1 |
| 弱推荐 | 干预措施可能利大于弊 | 建议 | 2 |
| 弱推荐反对 | 干预措施可能弊大于利或利弊关系不明确 | 不建议 | 2 |
| 强推荐反对 | 干预措施明显弊大于利 | 不推荐 | 1 |
注:GRADE为推荐分级的评估、制定与评价

GRADE分级系统证据质量分级与定义
GRADE分级系统证据质量分级与定义
| 质量等级 | 具体描述 |
|---|---|
| 高(A) | 非常确信真实值接近观察值 |
| 中(B) | 对观察值有中等程度信心:真实值有可能接近观察值,但仍存在两者不同的可能性 |
| 低(C) | 对观察值的确信程度有限:真实值可能与观察值不同 |
| 极低(D) | 对观察值几乎没有信心:真实值很可能与观察值不同 |
注:GRADE为推荐分级的评估、制定与评价
房间隔缺损(atrial septal defect,ASD)是指在胚胎发育过程中,房间隔的发生、吸收和融合出现异常,导致左、右心房之间存在血流交通的一种心脏畸形[21]。ASD占活产婴儿的0.88‰~1.00‰[22, 23],占所有CHD的6%~10%,多见于女性[24, 25]。根据胚胎学发病机制和解剖学特点,ASD通常分为继发孔型ASD(约80%)、原发孔型ASD(约15%)、静脉窦型ASD(约5%)和冠状静脉窦型ASD(<1%)4种类型[23,25]。ASD均可以通过外科手术闭合,其中,约80%继发孔型ASD可以通过经皮介入封堵治疗[26, 27, 28]。
单纯ASD自然病程与ASD的解剖类型、大小和患者自身因素有关[22]。低龄患者的小型继发孔型ASD常发生自然闭合[29, 30],<3月龄患儿的总体自然闭合率可达87%,其中年龄3个月以内,<3 mm的继发孔型ASD在1岁半内可全部自然闭合,缺损直径3~8 mm的患儿在1岁半内有80%以上的自然闭合率,但缺损在8 mm以上者几乎不能自然闭合[31]。未自然闭合的继发孔型ASD患者,其缺损大小可随年龄增长而变大或变小,缺损初始直径≤4 mm,70%缺损变小,12%不变,18%增大;相比之下,缺损初始直径>8 mm者,仅9%缺损变小,15%不变,76%增大[29,32]。
大多数ASD患者儿童期一般无症状,多数患者到了青春期后因心脏杂音或心电图等表现异常而通过超声心动图确诊[22]。显著的左向右分流导致右心室容量负荷过重和肺血流量增加,最终导致肺动脉高压、右心衰竭并出现疲劳和运动不耐受等临床表现[33]。近25%未治疗的ASD患者在27岁之前死亡,90%在60岁之前死亡[34]。即使是手术修复的ASD患者,在25岁之后进行手术,与年龄和性别匹配的对照人群相比,其存活率也可能降低;而40岁之后手术者,虽然手术可减少心力衰竭发作、延长寿命,但不能降低心房颤动(房颤)的发生率及由此带来的血栓栓塞风险[33]。因此,对于成人ASD患者,只要超声心动图检查有右心室容量负荷升高的证据,不管有无症状,均应尽早关闭ASD[1,35]。
外科手术与经皮封堵术治疗继发孔型ASD均有优良的远期效果,但经皮封堵术对左、右心室功能的负面影响较小[36, 37, 38],住院时间短,感染率低,并发症少,总费用低[39]。随着介入器材和导管技术的进步,经皮ASD封堵术死亡发生率接近零,严重并发症发生率<1%[40],目前已成为解剖条件合适的继发孔型ASD的首选治疗方式[1]。
根据我国的实际情况,在综合国内外相关指南和专家共识的基础上,本指南修订我国ASD经皮介入封堵治疗建议总结见表3[1,24,41, 42, 43, 44, 45, 46, 47, 48, 49, 50]。

经皮ASD介入封堵治疗建议
经皮ASD介入封堵治疗建议
| 推荐 | 推荐 等级 | 证据 级别 |
|---|---|---|
| 年龄≥2岁且体重≥10 kg的继发孔型ASD患者 | 推荐 | C |
| 有右心室容量超负荷证据且无肺动脉高压或左心疾病的继发孔型ASD患者,无论有无症状,推荐关闭ASD[45, 46] | 推荐 | B |
| 在缺损适合封堵的情况下(ASD边缘距冠状静脉窦,上、下腔静脉及肺静脉开口距离≥5 mm;距离房室瓣距离≥7 mm),首选经皮ASD介入封堵术[1,24,41] | 推荐 | B |
| 合并其他心脏畸形,但可行经皮介入治疗的患者。例如:ASD合并肺动脉瓣狭窄或动脉导管未闭等 | 推荐 | C |
| 年龄<2岁,有血流动力学意义(Qp∶Qs≥1.5)且符合上述介入标准的继发孔型ASD | 建议 | C |
| 如体重<10 kg或股静脉途径限制(如合并下腔静脉缺如、下腔静脉滤器植入术后等),可选择经颈静脉途径[47, 48] | 建议 | C |
| 特殊类型ASD如多孔型ASD、筛孔型ASD和后下边缘不良的ASD,应在临床经验丰富的中心结合3D打印、超声引导等技术实施封堵治疗[49, 50] | 建议 | C |
| 无血流动力学意义且无栓塞危险因素(如使用经静脉起搏系统、长期留置静脉导管或高凝状态等)的继发孔型ASD | 不推荐 | C |
| 重度肺动脉高压伴双向分流,艾森曼格综合征 | 不推荐 | C |
注:ASD为房间隔缺损;Qp为肺循环血量;Qs为体循环血量
数字减影血管造影机(放射线引导技术)、超声心动图诊断仪、多功能造影导管(MPA2)、0.035″(″代表英寸,1英寸=2.54 cm)超硬交换导丝(260 cm)、单纯超声引导辅助导丝(Panna导丝,260 cm)、0.035″泥鳅导丝、ASD封堵器及配套输送系统等。
常规体检,超声心动图、心电图、胸部X线平片和辅助化验检查等,患者和家属签署介入手术知情同意书。年龄≥50岁或有明显活动后心前区疼痛者,推荐行冠状动脉造影检查[1C]。不能配合手术的儿童和需做经食管超声心动图(TEE)的患者需要全身麻醉(全麻),术前需禁食水;成人局部麻醉(局麻)可不禁食水。术前建立外周静脉通道。
1. 放射线引导经皮ASD封堵术:(1)手术在导管室或杂交手术室进行,全麻或局麻后,穿刺右股静脉,静脉注射肝素100 U/kg,必要时先行右心导管检查,导管通过ASD送入左心房,将交换导丝置于左上肺静脉。(2)必要时可沿交换导丝送入测量球囊明确ASD的伸展径,然后沿交换导丝将输送鞘管送入左心房。(3)选择合适的封堵器经输送鞘管送至左心房,在X线透视(左前斜位45°~60°)、TTE或TEE监测下,先打开左心房侧伞盘,然后回撤至贴住房间隔左心房面,回撤鞘管的同时适当推送输送钢缆释放封堵器腰部和右心房侧伞盘。(4)轻轻推拉输送钢缆测试封堵器的稳定性,经超声和X线透视核实封堵器形态、位置满意,无残余分流,未影响房室瓣活动及肺静脉回流时,逆时针旋转输送钢缆,释放封堵器。(5)拔出输送鞘,压迫穿刺点后,绷带加压包扎。
2. 单纯超声引导经皮ASD封堵术:(1)手术在导管室或普通手术室进行,可以选择经股静脉途径[10,14]或经颈静脉途径[47],使用TTE或TEE引导,TTE测量ASD直径的准确性不劣于传统的球囊导管测量法,而且可以避免球囊充盈撕裂ASD薄弱边缘的风险,能满足临床应用需求[51, 52];TEE主要应用于TTE声窗条件差的患者,是TTE的重要补充[26,53]。术前测量右锁骨中线第3肋间至静脉穿刺点距离作为工作距离,并在导管及导丝上标记该工作距离。(2)全麻或局麻后,穿刺右股静脉或右颈静脉,置入动脉鞘管,静脉注射肝素100 U/kg,必要时先行右心导管检查。经动脉鞘管送入MPA2导管及超硬导丝,超硬导丝头部伸出导管外2~4 cm,将导管及导丝一起向前推送。由于超声的切面式工作原理完全不同于放射线的投影式工作原理,所以不容易探测到导丝、导管,可在导管必经路径上选择狭小腔隙,让超声以“守株待兔”的方式等待探测导丝、导管。经股静脉途径时,超声在剑突下切面可监测导管及导丝通过下腔静脉进入右心房情况;经颈静脉途径时,超声在剑突下切面监测导管及导丝从上腔静脉进入右心房情况。导管及导丝插入体内到达工作距离后,退出导丝,轻轻旋转导管,超声于四腔切面即可发现导管。在超声引导下调整导管方向,将导管送过ASD进入左心房。对于多发ASD,一般应将导管送入位于中间的孔或者最大的孔;复杂病例可在术前通过3D打印模型模拟封堵[50,54],选择最佳封堵孔及最佳封堵器(ASD封堵器或卵圆孔未闭封堵器)。超声以主动脉、上下腔静脉、二尖瓣为参照物,多普勒辅助判断导管位于大孔还是小孔,确定导管在最佳封堵孔内后,沿导管插入导丝,插入深度不能超过工作距离5~7 cm。保留导丝,退出导管,同时标记导管插入的深度,修正工作距离。退出动脉鞘管后,沿超硬导丝将输送鞘送至左心房,其送入体内深度与前述导管送入体内的工作距离一致。退出导丝及输送鞘内芯的同时轻轻推送输送鞘管,保持输送鞘管头端在左心房内的位置不变,排净输送鞘内空气。(3)选择封堵器直径一般大于缺损最大径4~8 mm,多选择>6 mm的封堵器;儿童可在ASD最大径的基础上加3~5 mm选封堵器。在主动脉短轴及心尖四腔心切面下,沿输送鞘管推送ASD封堵器进行封堵,先打开左心房侧伞盘,后撤封堵器使其贴住房间隔,再依次打开封堵器腰部和右心房侧伞盘。封堵器推送及释放期间注意输送鞘管尾部要置于水面下防止进气。封堵器安置成功后,超声在主动脉短轴切面、心尖四腔心切面和剑突下切面确认封堵器对二尖瓣、肺静脉及冠状静脉窦等周围组织无影响、位置、功能及形态良好后,逆时针旋转输送钢缆释放封堵器。(4)拔出输送鞘,压迫穿刺点后,绷带加压包扎。
对于单纯超声引导ASD经皮封堵术的初学者,推荐使用Panna导丝以降低学习曲线和减少并发症[55, 56][1B]。患者手术准备、麻醉方法及血管入路等同前。Panna导丝头部膨胀呈纺锤形,可装载进MPA2导管内,导管及导丝通过股静脉送至右心房,在右心房内释放出Panna导丝纺锤形头端,由于其头部体积较大,超声很容易探测并判断MPA2导管头端位置和方向。在超声引导下,将MPA2导管朝向ASD后,将Panna导丝头端部分收入MPA2导管以缩小体积通过ASD进入左心房,在左心房内完全释放Panna导丝,其头部能防止导丝从左心房脱入右心房,退出MPA2导管和动脉鞘管,标记导管插入的深度。沿Panna导丝将输送鞘送至左心房,Panna导丝头部不能被收入输送鞘内芯中,能防止输送鞘管损伤心脏。将Panna导丝及输送鞘内芯同时从鞘管内撤出体外,保持输送鞘管头端在左心房内的位置不变,后续封堵过程同前。
1. 穿刺血管处理:推荐术后穿刺部位沙袋压迫4 h,经颈静脉途径者可直接下床活动,经股静脉途径者卧床12 h[1C]。
2. 抗生素使用:推荐术前半小时常规应用抗生素1次,术后无白细胞增高等特殊情况不再给予[1C]。
3. 术后抗血小板治疗:推荐术后24 h给予低分子肝素(100 U/kg)皮下注射抗凝,术后第1天起口服阿司匹林3~5 mg·kg⁻¹·d⁻¹,共6个月[1C][57, 58]。
4. 特殊情况处理:术后反复头痛患者推荐在口服阿司匹林(100 mg/d)的基础上,加用氯吡格雷(75 mg/d)抗血小板3个月[59, 60][1A]。术后出现房颤者推荐使用新型口服抗凝药或华法林抗凝[1A]。
5. 术后随访:推荐术后24 h,1、3、6、12个月及每年复查超声心动图和心电图[61],必要时复查胸部X线平片[1C]。
1. 一般介入并发症:如麻醉意外、伤口感染、动静脉瘘等。
2. 封堵器移位和脱落:发生率0.20%~0.62%[62, 63, 64],封堵器脱落后患者可出现心悸、胸闷或心律失常等表现。术前和术中超声心动图的判断最为重要,若TTE声窗不清楚或缺损较大者,建议采用TEE或者冠状动脉增强CT检查以明确缺损边缘情况[2C]。术中操作应规范、确切,选择合适的封堵器,尤其是下腔静脉缘残端薄而短者。如出现封堵器脱落,推荐常规外科手术取出封堵器并修补ASD[1C];部分封堵器较小,且脱落后游离于左心房、右心房、肺动脉、主动脉者,建议尝试用抓捕器抓捕后经鞘管取出[2C];如果封堵器卡顿于瓣膜或进入左心室或右心室者,为防抓捕时损伤心脏瓣膜或腱索,推荐直接外科开胸取出封堵器后修补ASD[1C]。
3. 残余分流:术后早期封堵器内可出现星点状分流,一般封堵器内的残余分流不需要处理,封堵器内皮化后残余分流将会消失。在封堵器覆盖范围以外发现的残余分流,如果分流≥5 mm,视具体解剖条件,建议再置入1枚封堵器,保证完全封堵;如分流<5 mm,建议暂时不处理[2C]。
4. 心律失常:术中由于手术操作刺激心脏,常会发生各种心律失常,包括室上性心动过速、窦性心动过缓和室性早搏等,一般不需特殊处理,停止刺激后心律将恢复。封堵器置入后,其对房室结及其周围组织摩擦会造成暂时性水肿,患者可能会出现窦性心动过缓、房室传导阻滞、房性早搏或室性早搏等心律失常,发生率约为3.9%[65]。如果术中放置封堵器后立即出现房室传导阻滞,建议收回封堵器,待心律恢复后更换小一号封堵器再次尝试,若仍出现房室传导阻滞,推荐放弃封堵[1C]。若术后出现Ⅱ度二型或Ⅲ度房室传导阻滞,推荐尽早外科手术取出封堵器并修补ASD[1C];若术后新发Ⅰ度或Ⅱ度一型房室传导阻滞,可以使用糖皮质激素治疗,一般观察期7~10 d,如心律仍不能恢复,推荐积极取出封堵器并修补ASD[1C]。
5. 头痛或偏头痛:其发生率可达15%[60],疼痛的表现因人而异,有的伴恶心、呕吐、耳鸣、听力下降或肢体麻木。除与个体差异有关外,多发生于封堵器选择过大致其表面不能完整内皮化,或为术后抗血小板治疗不够或存在阿司匹林抵抗,导致微小血栓形成并脱落阻塞脑血管所致,推荐可适当延长抗血小板治疗至1年,并酌情加用氯吡格雷治疗3个月[1A]。对于药物治疗无效且难以控制的剧烈头痛患者,建议外科手术取出封堵器并修补ASD[2C]。
6. 封堵器磨蚀:为ASD封堵术后严重并发症,包括主动脉-左心房/右心房瘘、二尖瓣穿孔/反流及心脏压塞等,发生率0.043%~0.3%[66, 67],其原因可能为缺损残端较短而封堵器偏大,置入的封堵器与主动脉和心房壁摩擦引起。故应严格掌握适应证,对缺损较大、残端较短者应谨慎置入封堵器。术后定期复查超声心动图,一旦出现上述并发症,虽然有采用介入方法治疗ASD封堵术后主动脉-右心房瘘的成功报道[68],但推荐外科手术取出封堵器并修补ASD和瘘口[1C]。
7. 出血或血栓栓塞:其发生率约1%[64],为抗凝和抗栓相关并发症。出血包括胃肠道及颅内出血等。如封堵器左心房面形成血栓,可引起全身的血栓栓塞,包括外周动脉栓塞、视网膜动脉栓塞等。一旦发现血栓,应加强抗凝治疗,如血栓移动度较大,有发生脱落风险者,推荐外科手术取出封堵器并修补ASD[1C]。
8. 溶血:此并发症罕见,可见于ASD封堵术后发生主动脉-左心房/右心房瘘或二尖瓣反流者,由于高速血流撞击封堵器造成红细胞破坏所致。如发现尿液呈茶色或出现进行性贫血,应停用阿司匹林等抗血小板药物,促进封堵器表面血栓形成,给予糖皮质激素稳定细胞膜,减少细胞碎裂。若保守治疗无效时,推荐外科取出封堵器并修补ASD[69][1C]。
9. 心包积液/心脏压塞:为ASD封堵术后严重并发症,发生率0.5%~1.5%[70]。术后即刻发生的心包积液,多为导丝或导管穿破心房或肺静脉所致,如心包积液量少可以观察生命体征,中-大量心包积液会导致心包压塞,推荐立即行心包穿刺引流处理,积极处理后心包积液无明显减少者需急诊行外科开胸探查[1C]。术后有部分患者会出现迟发心包积液,应该加强超声心动图随访,密切监测心包内积血情况,中-大量心包积液需行心包穿刺或开窗术,严重心包压塞推荐开胸探查[1C]。
10. 空气栓塞:因输送鞘管内径较大,在低压的心房内工作时,空气容易经输送鞘尾部的止血阀进入左心房。空气栓塞引起的并发症包括急性心肌梗死、脑卒中或体循环栓塞等。预防空气栓塞最主要的措施是降低空气进入密闭输送系统的机会[71],封堵器在体外用50 ml注射器高压冲洗数次,直至装载鞘内无气泡出现为止;输送鞘进入左心房后要缓慢抽出内芯,同时缓慢经输送鞘尾端的止血阀进行抽吸排气;封堵器送入输送鞘时,应在装满水的盘子中进行,推送动作要平缓,降低空气吸进输送鞘的机会。对于高度怀疑空气栓塞的患者,应立即停止操作,快速评估气道稳定性、呼吸情况以及进行对症支持治疗,包括高流量吸氧、提高心率、机械通气、输液、血管加压药甚至高级生命支持。
11. 二尖瓣关闭不全:术后即刻出现的二尖瓣关闭不全,可能与封堵器影响二尖瓣活动有关,封堵器释放前一定要多切面判断封堵器与二尖瓣距离,如二尖瓣直接接触封堵器,推荐放弃封堵治疗[1C]。封堵术后进展性二尖瓣关闭不全的发生率为10%~37%[72],可能与封堵术后心脏形态重塑有关[73],介入封堵时患者年龄越大且ASD越大,发生二尖瓣关闭不全的可能性越大[72]。轻度或无明确血流动力学意义的二尖瓣关闭不全,可密切随诊观察;如二尖瓣病变达手术指征者,应择期外科手术处理。
卵圆孔是胚胎时期心脏房间隔卵圆窝处进行血液交换的一个正常生理性通道,出生后1年内大多数正常人原发隔和继发隔相互粘连、融合,形成永久性闭合,若3岁还未闭合则形成卵圆孔未闭(patent foramen ovale,PFO)。16世纪意大利解剖学家及外科医师Leonardo Botallo首先描述了PFO的存在。成年人中有25%~30%的卵圆孔不完全闭合,留下仅能用探针通过的微小裂隙[74, 75]。在正常情况下,左心房压高于右心房压,PFO不会引起心房间的分流,无临床意义而不需要治疗。而多数直径较大的PFO可在局部形成血液涡流、血栓和房间隔膨出瘤等,当右心房压升高超过左心房压时,类似功能性瓣膜的左侧薄弱的原发隔被推开,出现右向左的分流,此时,静脉系统的各类栓子可通过未闭的卵圆孔进入左心房后进入体循环,造成颅脑动脉和(或)其他动脉的反常栓塞,引起缺血性脑卒中[76]。目前的研究认为PFO是反常性栓塞的病理解剖学基础[77]。
早在1877年,德国病理学家Cohnheim就提出PFO可能与脑卒中相关,但长期以来PFO仍被认为无明显临床意义[74]。1992年,Bridges等[78]首次报道经导管PFO封堵术的病例。近10年来,国内外PFO与不明原因脑卒中(cryptogenicstroke,CS)的相关研究进展迅速。CLOSURE、PC和RESPECT三大随机对照试验(RCT)对比了经皮PFO封堵术与单纯药物(抗血小板药)治疗PFO合并CS的疗效,结果显示,在预防复发性脑卒中或死亡等方面,经皮PFO封堵术并未较单纯药物治疗带来更大的益处[79, 80, 81]。这些研究没有获得预期的结果被认为与封堵器类型选择、试验设计和纳入标准不合理等因素有关[82, 83, 84]。2017年,新英格兰医学杂志同期连续刊登了REDUCE[85]、CLOSE[86]和RESPECT[87]研究的远期随访结果;2018年,美国心脏病学会杂志上发表了一项有关亚洲高危PFO患者的DEFENSE研究[88],这4项RCT均证实了相比单纯抗血小板治疗,经皮PFO封堵可显著降低复发性脑卒中或短暂性脑缺血发作(TIA)的发生率,这些RCT循证医学证据成为PFO封堵术用于CS二级预防中的重要依据。
根据我国的实际情况,在综合国内外相关指南和专家共识的基础上,本指南修订我国经皮PFO介入封堵治疗建议如表4[89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108]。

经皮PFO介入封堵治疗建议
经皮PFO介入封堵治疗建议
| 推荐 | 推荐 等级 | 证据级别 |
|---|---|---|
| 适用年龄16~60岁 | 推荐 | A |
| 血栓栓塞性脑梗死伴PFO患者,未发现其他卒中发病机制[99, 100, 101] | 推荐 | A |
| CS或TIA合并PFO,具有1个或多个PFO的解剖学高危因素:房间隔膨出瘤、希阿里氏网、下腔静脉瓣>10 mm、大型PFO(>4 mm)、长隧道型PFO(长度≥8 mm),发泡试验显示中-大量右向左分流[102] | 推荐 | B |
| CS或TIA合并PFO,具有1个或多个临床高危因素:下肢深静脉血栓、反复肺栓塞、呼吸睡眠暂停等,发泡试验显示中-大量右向左分流 | 推荐 | B |
| PFO伴发泡试验显示中-大量右向左分流,具有长期(1年以上)先兆性偏头痛病史,经神经内科药物治疗无效或效果不佳,患者手术意愿强烈[103, 104, 105, 106] | 建议 | B |
| PFO伴发泡试验显示中-大量右向左分流,具有体循环其他部位矛盾性栓塞临床症状及影像学证据,排除其他来源栓塞可能 | 建议 | B |
| 合并PFO的特殊职业从业者(如潜水员、空乘人员、飞行员等)[107, 108] | 建议 | C |
| 可以找到明确原因的脑栓塞,如心源性脑栓塞、动脉夹层、动脉粥样硬化等 | 不推荐 | C |
| 中度及以上肺动脉高压或PFO为特殊通道 | 不推荐 | C |
| 无任何临床症状的PFO且不伴中-大量右向左分流者(发泡试验) | 不推荐 | C |
| PFO合并急性脑卒中2周以内 | 不推荐 | C |
注:PFO为卵圆孔未闭;CS为不明原因脑卒中;TIA为短暂性脑缺血发作
数字减影血管造影机(放射线引导方法)、超声心动图诊断仪、MPA2导管、0.035″直头泥鳅导丝(150 cm)、0.035″超硬交换导丝(260 cm)、PFO封堵器及配套输送系统。
术前准备同经皮ASD封堵术。
1. 放射线引导经皮PFO封堵术:(1)根据术前TEE及TTE结果预先准备好合适的封堵器。(2)封堵器型号的选择:PFO封堵器一般根据右心房侧伞盘直径的不同分为4个型号,封堵时依据卵圆孔距离上腔静脉口及主动脉根部后壁的距离来选择封堵器,要求封堵器右心房伞盘半径不得大于上述两距离中的最小距离。一般最小距离9~12.4 mm选18 mm伞,12.5~17.4 mm选25 mm伞,17.5 mm及以上(或合并房间隔膨出瘤)选30或35 mm伞。(3)入路途径:常规局麻下穿刺右股静脉,必要时先行右心导管检查。(4)左前斜位45°~60° X线透视下,导丝、导管配合将MPA2导管探查通过PFO,后前位X线透视下,将MPA2导管送入左上肺静脉,交换超硬导丝入左上肺静脉。(5)选择配套输送鞘管(8~10 Fr,1 Fr=0.33 mm),沿超硬导丝将输送鞘管送入左心房。(6)装载选择好的封堵器,沿鞘管送入左心房(鞘管尾端在水盘中操作注意排气),在左心房内释放左房侧伞盘和细腰,将输送鞘和封堵器输送钢缆一同后撤至房间隔,然后在右心房侧释放右房侧伞盘。(7)经X线透视(左前斜位45°~60°)及TTE超声监测观察封堵器形态、位置良好,无残余分流且不影响房室瓣活动,轻力推拉封堵器后形态、位置无变化时,逆时针旋转输送钢缆,释放封堵器。(8)撤出输送鞘管,穿刺点压迫止血包扎。
2. 单纯超声引导经皮PFO封堵术[109]:(1)手术在导管室或普通手术室进行,操作步骤与ASD封堵术相似。测量右锁骨中线第3肋间至股静脉穿刺点距离,并于术中在导管及导丝上标记该工作距离。(2)局麻下穿刺右股静脉,置入动脉鞘管,静脉注射肝素100 U/kg。经动脉鞘管送入MPA2导管及超硬导丝,超硬导丝头部应伸出导管外2~4 cm,将导管及导丝一起向前推送。剑突下切面显示下腔静脉,导管及导丝插入体内到达工作距离后,退出导丝,在超声引导下调整导管方向,顺时针旋转导管,将导管顶在房间隔中部卵圆窝位置,轻轻推送导管,同时少许逆时针旋转导管,即可将导管送过PFO进入左心房。也可以将导管置于右心房中央,在超声引导下推送超硬导丝尝试通过PFO,可旋转导管,调整推送超硬导丝的方向,超声可在主动脉短轴切面清晰显示导丝通过PFO进入左心房。如果使用超声引导辅助导丝(Panna导丝),其使用方法同经皮ASD封堵术,该导丝具有更好的指向性及安全性。导丝或导管通过PFO后,保留导丝在左心房内,退出导管,同时标记导管插入的深度。退出动脉鞘管后,沿超硬导丝将输送鞘送至左心房,退出导丝及输送鞘内芯,保持输送鞘管头端在左心房内的位置不变。(3)在超声监测下送入合适的PFO封堵器进行封堵,封堵器安置成功后,超声在主动脉短轴切面、心尖四腔心切面和剑突下切面确认封堵器对二尖瓣、肺静脉及冠状静脉窦等周围组织无影响,位置及形态良好后释放封堵器。(4)拔出输送鞘,压迫穿刺点后,绷带加压包扎。
1. 术后穿刺血管处理和抗生素使用:同经皮ASD封堵术。
2. 术后抗血小板处理:推荐术后24 h给予低分子肝素(100 U/kg)皮下注射抗凝,术后第1天开始口服阿司匹林100 mg/d(共6个月)和氯吡格雷75 mg/d(共3个月)[1C];有房颤者推荐使用新型口服抗凝药或华法林抗凝[1A]。
3. 术后随访:推荐术后24 h,1、3、6、12个月及每年复查超声心动图和心电图,必要时做TTE右心声学造影或经颅多普勒超声造影检查,判断有无残余右向左分流[76][1C]。
经皮PFO介入封堵术总体并发症发生率为1%~3%[110],不影响封堵器植入的建议水平,规范化操作可以减少并发症发生。
1. 心脏穿孔/心包压塞:心脏穿孔发生率为0.5%~1.0%,术中最常见的穿孔位置是左心耳,其他穿孔位置较为少见,包括右心室、右心房、肺静脉[111];术后心脏穿孔一般与封堵器过大磨蚀心房壁或主动脉壁有关[112]。在射线引导下,左心耳容易被误认为是左上肺静脉,错将导丝或导管放置于左心耳,左心耳非常薄,稍微用力就会导致左心耳穿孔[112]。为了避免心脏穿孔后导致急性心包压塞,建议在导丝放置于左上肺静脉之后再给肝素[2C]。术中一旦发生心脏穿孔,最重要的是在发生心包压塞前及时发现心包积液。术中患者出现胸闷,一旦怀疑发生心包积液,推荐立即行超声心动图检查[1C]。如心包积液量少可以观察生命体征,中-大量心包积液会导致心包压塞,推荐立即行心包穿刺引流处理,积极处理后心包积液无明显减少者须急诊开胸探查[1C]。
2. 空气栓塞:在右心导管测压以及封堵过程中,由于心房压力低,如果排气不充分,空气可经导管或输送鞘管进入右心房或左心房,导致空气栓塞。平躺时右冠状动脉开口较左冠状动脉开口高,因而右冠状动脉空气栓塞最为常见,表现为术中一过性ST段抬高或窦性心动过缓、房室传导阻滞等。患者或有轻度症状包括胸闷、心率减慢;ST段明显抬高者可出现胸闷、脸色苍白、出汗、恶心、呕吐伴窦性心动过缓等。空气栓塞处理措施同经皮ASD封堵术。
3. 心律失常/房颤:Shah等[99]的荟萃分析以及Ahmad等[100]的RCT研究结果显示,PFO封堵术后房颤发生率显著增加。围手术期的房颤、心房扑动的发生机制不明,可能与封堵器的选择有关[83]。封堵器刺激局部心肌,增强了心肌细胞自律性[113];封堵器的机械牵拉张力也可能是导致房颤的原因之一。绝大多数房颤为一过性或阵发性,发生在手术后30 d内,予以药物治疗后可维持窦性心律[83],因此,PFO封堵术后房颤的危害可能不大。
4. 残余分流:理论上PFO封堵术后房水平分流会消失,然而研究显示封堵术后1年完全封堵率为86%~96%[91]。残余分流的原因可能包括[114]:(1)基于封堵器的设计,血流易从封堵器的间隙中穿过;此外,残余分流也与封堵器型号有关,封堵器越大,越可能产生残余分流[91];(2)存在尚未发现的小型ASD;(3)存在小的肺动脉静脉瘘。PFO封堵术后6个月内症状复发或不缓解的患者,推荐复查发泡试验,及时发现残余分流,并通过TEE确诊[1C]。
5. 其他相关并发症:包括一般介入并发症、封堵器移位/脱落、出血或血栓栓塞、封堵器磨蚀等同经皮ASD封堵术。
动脉导管是胎儿时期肺动脉与主动脉间的正常血流通道,胎儿出生后,动脉导管可在数月内因废用而闭合。如动脉导管在出生3个月~1岁后仍持续不闭合,即为动脉导管未闭(patent ductus arteriosus,PDA)[115, 116]。PDA的发病率约为0.5‰,占所有CHD的5%~10%[117]。然而,如果加入“沉默型”PDA患者,其发病率增加至2‰[118]。PDA可以与多种心脏畸形同时出现,但在成人中,它通常是一个独立的疾病,女性的发病率约为男性的2倍[119]。PDA的临床表现取决于PDA的大小以及肺血管阻力。成年PDA患者的临床表现和自然史包括:小型PDA:无左心室容量超负荷(正常左心室)和正常肺动脉压力(通常无症状);中型PDA:主要表现为左心室容量超负荷(左心室增大,功能正常或降低)和(或)肺动脉高压(可能出现右心衰竭);大型PDA:一般发展为艾森曼格综合征,伴有不同程度的低氧血症和不同程度的发绀,而导管动脉瘤形成是一种非常罕见的并发症[1]。
1967年,Porstmann等[120]首次采用泡沫海绵封堵PDA获得成功,此后各国学者相继开展了多种介入性方法治疗PDA,随着介入技术的不断发展,尤其是1996年Amplatzer封堵器问世以来[121],介入治疗成功率高且并发症少[122, 123, 124, 125]。Pass等[126]在美国25个中心进行的调查结果显示,PDA闭合的成功率和症状改善情况在患者的任何年龄都不亚于外科手术。同时,近年来超声评估和引导的经皮PDA介入封堵术越来越多地用于极低出生体重婴儿[127],与射线引导相比,经皮PDA封堵术可以在超声指导下安全有效地进行,极大地降低了手术费用和时间[8,128, 129]。目前,经皮PDA封堵术在世界范围内得到广泛应用并逐渐成为PDA的首选治疗方法[44],外科手术只适用于PDA太大无法封堵或解剖结构不合适(如动脉瘤形成)的罕见患者[121,130, 131]。
根据我国的实际情况,在综合国内外相关指南和专家共识的基础上,本指南修订我国经皮PDA介入封堵治疗建议如表5[1,41, 42, 43,119,132]。

经皮PDA介入封堵治疗建议
经皮PDA介入封堵治疗建议
| 推荐 | 推荐 等级 | 证据级别 |
|---|---|---|
| 体重≥4 kg,有左心室容量超负荷证据且解剖条件适合介入的PDA患者,无论有无症状,推荐首选介入封堵PDA | 推荐 | B |
| 心腔大小正常的左向右分流的小型PDA,如果通过标准的听诊技术可闻及杂音,建议介入封堵PDA | 建议 | C |
| “沉默型”PDA伴有少量左向右分流(包括外科术后或者介入术后残余分流) | 不建议 | C |
| PDA合并重度肺动脉高压,动脉导管水平出现以左向右分流为主的双向分流,急性肺血管扩张试验阳性或试验性封堵后肺动脉收缩压降低20%或降低30 mmHg以上,且无主动脉压力下降和全身不良反应 | 不建议 | C |
| 依赖于动脉导管的开放维持有效肺循环或体循环的先天心脏畸形 | 不推荐 | C |
| 合并严重肺动脉高压,动脉导管水平出现双向分流或者右向左分流,急性肺血管扩张试验阴性或经靶向药物治疗无改善患者 | 不推荐 | C |
注:PDA为动脉导管未闭;1 mmHg=0.133 kPa
(一)设备器材:数字减影血管造影机(放射线引导方法)、超声心动图诊断仪、包括MPA2导管、5 Fr猪尾导管、0.035″超硬交换导丝(260 cm)、0.035″直头泥鳅导丝、可用于封堵动脉导管的封堵器[蘑菇伞封堵器、ADO Ⅱ封堵器、弹簧圈、多功能封堵器(MFO)[133]等]及配套输送系统等。
术前准备同经皮ASD封堵术。
1. 放射线引导下经股静脉PDA封堵术:(1)手术准备及麻醉方法同前,穿刺右股动、静脉,可先行左、右心导管检查。(2)送入猪尾导管行主动脉弓降部造影,以明确PDA形态、位置及大小。(3)后前位X线透视下,将MPA2导管通过右心房-右心室-肺动脉-PDA送入降主动脉,并将交换导丝置于降主动脉下方(膈肌以下)。对于经上述途径难以将MPA2导管送至PDA及降主动脉者,可经降主动脉端送入0.035″长泥鳅交换导丝(200或260 cm)通过PDA至肺动脉,再经股静脉端送入圈套器至肺动脉,将长泥鳅导丝拉至体外建立动静脉导丝轨道。(4)沿交换导丝将输送鞘管送入近横膈水平,撤出输送鞘内芯及导丝。(5)通常选择蘑菇伞封堵器,其直径一般大于PDA最窄处直径3~6 mm,婴幼儿PDA组织弹性大,选择封堵器直径应2倍于PDA直径。封堵器经输送鞘管送至鞘管头端,在X线透视下先打开主动脉侧伞盘,然后回撤输送鞘管及封堵器入PDA内,固定输送钢缆,回撤鞘管至PDA的肺动脉侧,使封堵器的腰部卡在PDA内。(6)10 min后重复主动脉弓降部造影,若无残余分流或微量分流,听诊无明显杂音,测量左肺-主肺动脉压和升主-降主动脉压无明显压差,封堵器形态、位置合适时可将封堵器完全释放。(7)重复右心导管检查,撤出鞘管后穿刺点压迫止血,绷带加压包扎。
2. 放射线引导下经股动脉PDA封堵术(适用于细小管型PDA):(1)手术准备及麻醉方法同前,穿刺右股动脉,可先行左心导管检查及主动脉弓降部造影。(2)左侧位X线透视下采用5 Fr JR4或5 Fr Cobra导管或修剪的猪尾导管配合泥鳅导丝在主动脉弓降部探查,通过PDA逆行将导管送入主肺动脉后,测量肺动脉压。(3)撤出泥鳅导丝,交换长导丝(200或260 cm 0.035″泥鳅或普通交换导丝)进入肺动脉或右心系统,退出导管,送入输送鞘管进入主肺动脉。(4)选择合适的封堵器(一般为ADO Ⅱ或弹簧圈)经输送鞘管送至鞘管头端,在X线透视下先打开肺动脉侧伞盘,然后回撤输送鞘管及封堵器入PDA内,固定输送钢缆,回撤鞘管至PDA的主动脉侧,使封堵器的腰部卡在PDA内。(5)封堵后经输送鞘管行主动脉弓降部造影,确定有无残余分流等情况,如封堵器位置、形态满意,无明显残余分流,可逆时针旋转输送钢缆释放封堵器,撤出输送系统,穿刺点压迫止血,绷带加压包扎。
3. 单纯超声引导下经股动脉PDA封堵术[16]:(1)该方法适用于PDA最窄处直径≤4.5 mm患者。手术准备及麻醉方法同前,测量穿刺点至胸骨左缘第2肋间的距离,标记为工作距离。(2)穿刺右侧股动脉后置入5 Fr动脉鞘,根据超声显示PDA走行方向,部分修剪5 Fr猪尾导管,使其头部呈1/3圆弧。将超声探头置于胸骨上窝,显示主动脉弓长轴切面。将导丝插入导管内,经动脉鞘管按工作距离将导管及导丝送至PDA开口处,退出导丝,轻轻旋转导管,调整导管方向,使导管开口朝向肺动脉,推送导丝通过PDA进入肺动脉内。导丝通过PDA后,将超声探头置于胸骨左缘第3肋间,显示肺动脉长轴切面,即可见导丝位于主肺动脉内。保留导丝,退出导管,送入输送鞘管至主肺动脉内。(3)退出导丝,沿输送鞘管送入封堵器,封堵器可选择ADO Ⅱ、MFO等双盘状封堵器,直径比PDA肺动脉侧直径大2 mm,先释放封堵器肺动脉侧伞盘,后撤导管使伞盘紧贴PDA肺动脉侧开口,后撤输送鞘管,释放封堵器剩余部分。超声检查封堵器位置、形态,残余分流情况和肺动脉分支血流流速,超声测量主动脉弓降部是否存在压差。(4)若封堵效果满意,逆时针旋转输送钢缆释放封堵器。超声再次评估封堵器形态、位置及主动脉弓降部、肺动脉分支血流速度,如果情况良好,撤出输送鞘管,穿刺点予以压迫止血,绷带加压包扎。
4. 单纯超声引导下经股静脉PDA封堵术[129]:(1)该方法一般用于PDA最窄处直径>4.5 mm患者。手术准备及麻醉方法同前,测量胸骨右缘第3肋间至右侧股静脉穿刺点的距离,并在导管上标记相应距离,作为操作的工作距离。(2)经股静脉置入6 Fr血管鞘,经血管鞘送入右冠导管或适用于超声引导的多弯导管。当导管进入体内达到该距离后,即可旋转导管方便超声探查导管在右心房内的位置。如果使用右冠导管,应将导管开口朝向三尖瓣后将导丝自右心房通过三尖瓣进入右心室,导管沿导丝进入右心室后,调整导管方向,使导管开口朝向右心室流出道,轻轻推送导丝,将导丝通过肺动脉瓣送入肺动脉内。退出右冠导管,沿导丝送入MPA2导管,其送入深度与右冠导管插入深度一致。超声在胸骨旁肺动脉长轴切面上显示主肺动脉及PDA,旋转并调整MPA2导管方向,同时推送导丝,使导丝通过PDA进入降主动脉内。退出MPA2导管及动脉鞘,沿导丝送入输送鞘,退出输送鞘内芯及导丝。如果使用超声引导的多弯导管,撤出导丝,使导管在右心房内恢复多个弯曲,在心尖四腔心切面旋转导管朝向三尖瓣,推送导管即可通过三尖瓣,导管头部弯曲会自动在右心室内朝向肺动脉瓣,沿导管送入导丝即可进入肺动脉,将多弯导管沿导丝送入肺动脉内,调整导管方向,在超声引导下将导丝通过PDA送入降主动脉,保留导丝,撤出导管,沿导丝送入输送鞘。(3)通常选择蘑菇伞封堵器,沿输送鞘送入封堵器,从输送鞘管中送入封堵器至降主动脉后打开封堵器主动脉侧,将封堵器缓缓回撤至PDA主动脉侧开口,回撤输送鞘管,使封堵器腰部镶嵌在PDA内并观察是否有明显腰征。以TTE评估残余分流,主动脉弓降部及左、右肺动脉血流速度。(4)若封堵效果满意,逆时针旋转输送钢缆释放封堵器,撤出输送系统,穿刺点压迫止血,绷带加压包扎。
1. 穿刺血管处理:推荐术后股静脉穿刺部位沙袋压迫4 h,股动脉穿刺部位沙袋压迫6 h,卧床12 h[1C]。
2. 抗生素使用:推荐术前半小时常规应用抗生素1次,术后无白细胞增高等特殊情况不再给予[1C]。
3. 术后随访:推荐术后24 h,1、3、6、12个月及每年复查超声心动图、心电图,必要时复查胸部X线平片[1C]。
1. 一般介入并发症:同经皮ASD封堵术。
2. 封堵器脱落:发生率0.5%~1.5%[126,134],主要发生于大型PDA或年龄小的患者,术中推送封堵器切忌旋转动作以免发生脱载。一旦发生封堵器脱落,建议可酌情通过抓捕器或异物钳将其取出,难以取出时推荐急诊外科手术取出封堵器并关闭PDA[135][1C]。
3. 残余分流:蘑菇伞封堵器的远期残余分流发生率<0.3%[126,136]。术后早期封堵器内部有少量残余分流是正常现象,术中可以观察10~15 min,等封堵伞充分展开及微血栓形成后分流即可消失。如果是由于封堵器移位后出现残余分流明显或影响到正常心血管结构,推荐外科手术取出封堵器并关闭PDA[1C]。
4. 左肺动脉狭窄:主要由于封堵器突入肺动脉过多造成。应用蘑菇伞封堵器的发生率为0.5%~1.5%[126,134],与PDA解剖形态有关。术中应对其形态有充分的了解,根据解剖形态选择合适的封堵器有助于避免此并发症。轻度左肺动脉狭窄可严密观察,若狭窄较重则推荐外科手术取出封堵器并关闭PDA[1C]。
5. 降主动脉狭窄:应用蘑菇伞封堵器的发生率约为0.2%[126],主要发生在婴幼儿,系封堵器过多突入降主动脉造成。轻度狭窄(跨狭窄处压差<10 mmHg,1 mmHg=0.133 kPa)可严密观察,如狭窄较重则推荐外科手术取出封堵器并关闭PDA[137][1C]。
6. 溶血:机械性溶血主要因为残余分流大、流速快,造成红细胞破坏,多发生在术后24 h内,是PDA介入治疗的严重并发症。部分患者可通过使用糖皮质激素得到控制,如果经保守治疗无效或者溶血进行性加重,推荐外科手术取出封堵器并关闭PDA[1C]。
7. 三尖瓣损伤:经股静脉途径可能对三尖瓣及其腱索造成一定的潜在损伤。导管通过过程中若遇到阻力,可能是导管被三尖瓣阻挡,此时应送入导丝,拉直导管后再尝试调整导管方向重新建立轨道。三尖瓣损伤轻度者,可随诊观察;严重者推荐尽早外科处理[1C]。
8. 血小板减少:多发生于巨大PDA封堵术后,为消耗性血小板减少[138]。建议应用糖皮质激素、止血芳酸及升血小板药物,必要时输注血小板,多可恢复[2C]。
9. 一过性高血压:多见于大型PDA封堵术后,可能与术后动脉系统血容量突然增加、反射性动脉血管收缩有关。建议硝酸甘油或硝普钠静脉滴注治疗[139][2C]。
10. 血栓栓塞:若发现有肢体末梢发绀、苍白、发凉等栓塞征象,即刻给予肝素治疗或尿激酶溶栓,如若治疗无效,推荐经导管法或外科手术取栓[1C]。
室间隔缺损(ventricular septal defect,VSD)是指心脏室间隔的先天或获得性缺损造成左右心室间的异常交通。先天性VSD是由于胚胎发育期室间隔发育不全造成,它是最常见的CHD,占活产婴儿的3.0‰~3.5‰,占全部CHD的20%~30%[140, 141, 142]。VSD可单独存在,也可以是复杂心内畸形的组成部分之一[143, 144]。根据VSD所处位置,一般将其分为膜周部(约80%)、肌部(5%~20%)、双动脉瓣下(约5%)和流入道缺损(约5%),其中膜周部和肌部VSD可通过介入方法治疗[41,144]。
1988年,Lock等[145]首次应用封堵伞封堵VSD。2007年,美国食品药品监督管理局(FDA)批准Amplatzer肌部封堵器上市,目前已在全球广泛应用于肌部VSD封堵[146]。但是,由于早期Amplatzer膜周部VSD封堵器在临床应用中出现的严重并发症,尤其是完全性房室传导阻滞的发生率偏高[147, 148],美国 FDA至今尚未批准该型封堵器上市。近年来,随着封堵器材的改进,膜周部VSD介入封堵安全性得到提高,越来越多的研究支持对膜周部VSD进行介入封堵治疗。Santhanam等[149]的荟萃分析纳入6 762例膜周部VSD介入封堵的结果,手术成功率为97.8%,完全性房室传导阻滞发生率仅为1.1%,其他并发症包括残余分流发生率为15.9%,心律失常发生率为10.3%,瓣膜损伤发生率为4.1%。Saurav等[142]收集3 134例膜周部VSD治疗结果,与外科治疗相比,介入封堵的手术成功率和并发症发生率两者均无明显差异,但是介入治疗可显著缩短住院时间和减少输血。Yi等[150]的荟萃分析结果也显示,相比外科治疗,介入封堵膜周部VSD的重症监护病房停留时间和住院时间明显缩短,相似结果也见于介入封堵儿童膜周部VSD[151]。另一项荟萃分析收集了4 050例VSD介入封堵手术病例[152],结果显示介入封堵VSD成功率高达97.96%,早期残余分流发生率为22.25%,持续性残余分流的发生率为3.1%,完全性房室传导阻滞的发生率为2.4%。因而,尽管目前外科手术仍是VSD治疗的“金标准”,但外科手术存在创伤大、围手术期并发症发生率高、住院时间长、疤痕残留等缺点[153],而经皮VSD介入封堵术因其创伤小、恢复快、住院时间短和费用低等优势,已逐渐成为解剖条件合适的VSD的重要治疗方法[149,151,154]。2020年欧洲心脏病协会发布的指南[155]强调,经皮介入封堵VSD是外科手术有效的替代治疗方法,尤其对于解剖条件合适的膜周部和肌部VSD、外科术后残余VSD和无法耐受二次手术的VSD患者。
根据我国的实际情况,在综合国内外相关指南和专家共识的基础上,本指南修订我国经皮VSD介入封堵治疗建议如表6[1,41, 42, 43,142,149,151, 152,155, 156, 157, 158, 159, 160, 161]。

经皮VSD介入封堵治疗建议
经皮VSD介入封堵治疗建议
| 推荐 | 推荐等级 | 证据级别 |
|---|---|---|
| 年龄≥3岁且体重≥10 kg的膜周部VSD | 推荐 | C |
| 膜周部VSD直径3~14 mm,有临床症状或有左心超负荷表现,Qp∶Qs>1.5[151, 152] | 推荐 | B |
| 在解剖条件合适的情况下(VSD上缘距主动脉瓣距离≥2 mm,VSD后缘距三尖瓣距离≥2 mm,无主动脉瓣反流及主动脉右冠瓣脱垂),推荐经皮VSD封堵术[142,149,151] | 推荐 | B |
| 肌部VSD,年龄≥3岁,有临床症状或有左心超负荷表现,Qp∶Qs>1.5 | 推荐 | C |
| VSD外科修补术后残余分流且符合上述介入标准[157] | 推荐 | C |
| 创伤性VSD或心肌梗死后室间隔穿孔且符合上述介入标准[158, 159, 160] | 建议 | C |
| 年龄2~3岁,有临床症状或有左心超负荷表现的膜周部VSD且符合上述介入标准。如患者体重<10 kg,可选择经颈静脉途径[161] | 建议 | C |
| VSD上缘距主动脉瓣距离≤2 mm,无主动脉瓣脱垂,不合并主动脉瓣轻度以上反流 | 建议 | C |
| 肌部VSD,年龄<3岁,有临床症状或有左心超负荷表现,Qp∶Qs>2.0[41] | 建议 | C |
| 缺损解剖位置不良,封堵器影响瓣膜功能 | 不推荐 | C |
| 重度肺动脉高压伴双向分流,艾森曼格综合征 | 不推荐 | C |
注:VSD为室间隔缺损;Qp为肺循环血量;Qs为体循环血量
(一)设备器材:数字减影血管造影机(放射线引导方法)、超声心动图诊断仪、MPA2导管、5 Fr猪尾导管,Judkins 5 Fr右冠导管、0.035″泥鳅导丝(150、200或260 cm)、0.035″普通直头导丝、交换导丝、圈套器、VSD封堵器及配套输送系统等。
术前准备同ASD封堵术。
1. 放射线引导下经皮VSD封堵术:(1)手术准备及麻醉方法同前。穿刺右股动、静脉(肌部VSD通常要穿刺右颈内静脉),可先行右心导管检查,并将MPA2导管置于肺动脉。(2)送入5 Fr猪尾导管依次行左心导管检查、左心室造影及升主动脉造影(通常取左前斜60°+足头位20°),以确定VSD的位置及大小、有无主动脉瓣反流等。静脉注射肝素100 U/kg。(3)建立动静脉轨道:左前斜60°+足头位20°用右冠导管或其他导管(如修剪的猪尾导管)经主动脉、左心室配合导丝探查VSD左心室开口,导丝穿过VSD进入右心室后,将长泥鳅导丝(200或260 cm)送入肺动脉或腔静脉。由股静脉侧经MPA2导管送入圈套器,在肺动脉或腔静脉套住交换导丝头端,由股静脉拉出,建立股静脉(或右颈内静脉)-右心房-右心室-VSD-左心室-股动脉导丝轨道。(4)放置鞘管:由股静脉端沿轨道插入输送鞘至右心房与右冠导管相接,将输送鞘沿导丝送至主动脉弓顶部,后撤扩张管头端至右心室后,缓慢回撤输送鞘管至主动脉瓣下,然后由动脉端推送交换导丝及右冠或其他导管至左心室心尖,使输送鞘头端顺势指向左心室心尖部。(5)放置封堵器:退出导丝及输送鞘内芯后,选择合适大小的封堵器(一般比缺损直径大2 mm)与装载系统和输送钢缆连接好,沿输送鞘送至鞘管头端,固定输送钢缆回撤输送鞘,在左心室腔内打开左心室侧伞盘,然后将输送鞘和输送钢缆一起后撤使封堵器左心室侧伞盘紧贴室间隔左心室面。打开封堵器腰部及右心室侧伞盘,使其腰部卡在VSD上,双盘“夹住”室间隔。(6)检查确认后释放封堵器:重复左心室造影、升主动脉造影以及超声心动图检查,确认无明显残余分流、无新发主动脉瓣关闭不全、三尖瓣关闭不全,封堵器位置、形态良好后,逆时针旋转输送钢缆释放封堵器。超声评估及后续处理同前。
2. 单纯超声引导下经股动脉VSD封堵术[7,162]:(1)手术准备及麻醉方法同前。测量左锁骨中线第2肋间至股动脉穿刺点距离,并在导管及导丝上标记为工作距离。(2)穿刺右侧股动脉,置入动脉鞘管,静脉注射肝素100 U/kg,可先行心导管检查。根据超声主动脉长轴切面的VSD血流方向,部分修剪5 Fr猪尾导管,使其头部呈1/3~1/2圆弧。经动脉鞘送入5 Fr猪尾导管及导丝。当导管和导丝的输送距离达到工作距离时,超声经胸骨上窝切面显示主动脉弓长轴切面,旋转导管可帮助发现导管的位置,调整猪尾导管方向,使其开口朝向主动脉弓小弯侧,轻轻推送导丝即可进入主动脉弓。沿导丝推送导管进入升主动脉后,退出导丝,超声显示升主动脉长轴,在超声引导下,旋转推送导管,引导导管通过主动脉瓣进入左心室。导管进入左心室后,调整猪尾导管方向,使其开口朝向缺损,显示心尖四腔或五腔心切面,轻轻推送将导丝经VSD进入右心室内。退出猪尾导管,并用工作距离法标记猪尾导管插入体内的深度。沿导丝送入输送鞘,输送鞘送入深度比猪尾导管插入深度长2~4 cm,退出输送鞘内芯及导丝。(3)封堵器直径一般比缺损直径大2 mm,将封堵器与输送钢缆连接,沿输送鞘送入封堵器。于右心室内释放封堵器伞盘,在主动脉短轴及心尖四腔心切面监测下,后撤输送系统,使伞盘紧贴缺损右心室开口,后撤输送鞘,释放封堵器左心室面。以超声心动图显示多个切面如主动脉长轴、心尖四腔心切面评价封堵器形态以及封堵器是否远离主动脉瓣,以多普勒超声检查有无残余分流、三尖瓣是否有新发反流或反流较术前加重。(4)若封堵效果满意,逆时针旋转输送钢缆释放封堵器,超声再次评估封堵器形态、位置及主动脉瓣功能。如果情况良好,撤除输送鞘,穿刺点予以压迫止血,绷带加压包扎。
3. 单纯超声引导下经颈静脉VSD封堵术[161]:(1)手术准备及麻醉方法同前。(2)穿刺右侧颈内静脉,测量穿刺点到右侧第3肋间的距离,标记为工作距离。静脉注射肝素100 U/kg,可先行心导管检查。于颈静脉内置入5 Fr动脉鞘管3~5 cm,并以缝线将动脉鞘管固定于手术单上,因路径较短,切勿将动脉鞘全部插入体内。根据VSD方向,部分修剪5 Fr猪尾导管,使其头部呈1/2~3/4 圆弧形。经动脉鞘管送入5 Fr猪尾导管及导丝。将导丝及导管送入达到工作距离后,在超声心动图引导下,退出导丝,调整导管方向并推送导管通过三尖瓣进入右心室,再次调整导管方向,使其开口朝向VSD,在超声心动图引导下,轻轻推送导丝,于主动脉短轴切面显示导丝位置并调整方向,使导丝经VSD 进入左心室内,退出猪尾导管。部分患者可使用可调弯鞘管帮助导丝通过VSD。沿导丝送入输送鞘管,部分患者如导丝支撑力不够,可经股动脉送入圈套器建立颈内静脉-VSD-股动脉轨道,沿导丝经颈静脉送入输送鞘管即可通过VSD进行封堵。(3)在超声心动图监测下,沿输送鞘送入封堵器。于左心室内释放封堵器左心室侧伞盘,后撤输送系统,使伞盘紧贴VSD左心室侧开口,后撤输送鞘,释放封堵器右心室面伞盘。(4)超声评估及后续处理同经股动脉法。
1. 穿刺血管处理:推荐术后股静脉穿刺部位沙袋压迫4 h,股动脉穿刺部位沙袋压迫6 h,卧床12 h[1C]。
2. 抗生素使用:推荐术前半小时常规应用抗生素1次,术后无白细胞增高等特殊情况不再给予[1C]。
3. 术后抗血小板治疗:推荐术后24 h给予低分子肝素(100 U/kg)皮下注射抗凝,术后第1天口服阿司匹林3~5 mg·kg⁻¹·d⁻¹,共6个月[1C]。
4. 术后随访:建议连续心电监护3 d[2C]。推荐术后24 h,1、3、6、12个月及每年复查超声心动图和心电图,术后48 h和第5天加做心电图复查,必要时复查胸部X线平片[1C]。
1. 一般介入并发症:同经皮ASD封堵术。
2. 封堵器移位和脱落:罕有发生,一般多脱落入肺动脉或主动脉,建议先尝试用抓捕器抓捕后经鞘管取出[2C],如不成功或介入抓捕困难者推荐外科手术取出封堵器并修补VSD[1C]。
3. 外周血管损伤:行股动脉穿刺时,应严格按照改良Seldinger穿刺法进行,务必轻柔操作,导丝送入过程中若感到阻力增大,切勿盲目用力,应退回调整方向后再次尝试。
4. 三尖瓣反流:首先避免在建立轨道时误穿三尖瓣腱索,其次在释放封堵器右心室侧伞盘后,回撤伞盘的过程中若遇到阻力,可能是伞盘被三尖瓣腱索阻挡,此时应收回伞盘,回撤输送鞘管,使其头端靠近VSD且在右心室内,再次释放封堵器右心室侧伞盘。对于术前存在三尖瓣反流的患者,释放封堵器后三尖瓣反流应无明显增加。
5. 主动脉瓣反流:预防主动脉瓣反流最重要的措施是术前患者的评估,使用等边伞时缺损边缘距主动脉瓣的距离应≥2 mm。此外,避免在主动脉瓣上暴力压输送鞘至左心室,在释放封堵器前,仔细评估封堵器左心室侧伞盘和主动脉瓣的位置关系尤为重要,必要时可在封堵器释放前行升主动脉造影评估主动脉瓣情况。
6. 房室传导阻滞和左束支传导阻滞:封堵器对膜部缺损周围组织的压迫引起周围组织的水肿、炎症反应,继而发生纤维化被认为是导致传导束功能障碍的主要原因。发生封堵相关传导阻滞的危险因素有低体重和使用过大的封堵器,但并不明确。一般推荐使用比缺损直径大1~2 mm的封堵器,这有利于减少术后传导阻滞的发生[1C]。术中若出现完全性左束支传导阻滞、Ⅱ度或Ⅲ度房室传导阻滞,推荐放弃封堵[1C]。术后早期发生完全性左束支传导阻滞、Ⅱ度或Ⅲ度房室传导阻滞,推荐尽早外科取出封堵器并修补VSD[1C];但若心率在55次/min以上,心电图QRS宽度在0.12 s以内,建议可给予糖皮质激素及果糖二磷酸钠等营养心肌治疗,必要时安装临时起搏器,治疗3~7 d不恢复,再外科取出封堵器并修补VSD[2C]。术后迟发型Ⅲ度房室传导阻滞,药物治疗效果通常欠佳,推荐安装永久起搏器治疗或外科取出封堵器并修补VSD[43][1C]。
7. 残余分流:残余分流是VSD封堵术后最常见的并发症,术后微量残余分流有可能自行愈合。一般>2 mm的残余分流且分流速度>3 m/s推荐外科取出封堵器并修补VSD[1C]。
8. 溶血:VSD封堵术后溶血发生率为4.7%~7.1%[163, 164],多发生在术后早期,尤其是存在残余分流的患者。大部分患者可通过使用糖皮质激素及充分水化、碱化尿液等治疗得到控制,否则推荐外科手术取出封堵器并修补VSD[1C]。
肺动脉瓣狭窄(pulmonaryvalvestenosis,PVS)是一类常见的先天性心脏畸形,约占活产婴儿的0.5‰,占所有CHD的8%~10%[165],且其发生率呈稳定上升的趋势[166],亚洲人群的发生率高于欧美国家,常和肺动脉瓣上及瓣下狭窄合并出现。PVS导致右心室持续性的高压会引起右心代偿性增大,心室壁增厚,最终发展为右心功能衰竭。中度狭窄年长者活动后可出现疲劳或气促;严重狭窄者活动后可出现呼吸困难和乏力,突发晕厥或者猝死。越来越多的患者在儿童时期通过介入手段进行矫治,经皮肺动脉瓣球囊成形术自1982年首次出现后,目前已成为PVS的首选治疗方式[167],但部分患者在长期随访时会出现反流或再狭窄等事件[168, 169, 170, 171, 172],尤其是解剖结构特殊的PVS患者疗效欠佳。Noonan综合征患者60%会出现PVS,并且约30%为重度狭窄[173],80%的该类患者球囊扩张后压差不会显著下降[174],65%的患者需要再次介入或手术干预[175]。
超声心动图和心导管检查是PVS诊断和评估的主要方式。通过超声心动图测量峰值流速、跨瓣压差等评估PVS的程度(表7)[176, 177]。心导管可测量肺动脉跨瓣压差、右心室收缩压等血流动力学指标,准确评估狭窄的程度;同时右心室造影可见增厚的肺动脉瓣和收缩期喷射性血流束,呈现“射流征”和“圆顶征”。
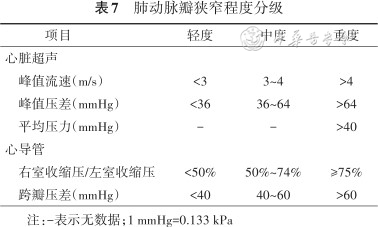
肺动脉瓣狭窄程度分级
肺动脉瓣狭窄程度分级
| 项目 | 轻度 | 中度 | 重度 |
|---|---|---|---|
| 心脏超声 | |||
峰值流速(m/s) | <3 | 3~4 | >4 |
峰值压差(mmHg) | <36 | 36~64 | >64 |
平均压力(mmHg) | - | - | >40 |
| 心导管 | |||
右室收缩压/左室收缩压 | <50% | 50%~74% | ≥75% |
跨瓣压差(mmHg) | <40 | 40~60 | >60 |
注:-表示无数据;1 mmHg=0.133 kPa
根据我国的实际情况,在综合国内外相关研究、指南和专家共识的基础上[1,41, 42, 43,178, 179, 180, 181, 182, 183, 184, 185],本指南修订我国经皮PVS介入治疗建议如表8。

经皮PVS介入治疗建议
经皮PVS介入治疗建议
| 推荐 | 推荐等级 | 证据级别 |
|---|---|---|
| 超声或心导管测量肺动脉瓣跨瓣峰值压差≥40 mmHg或合并右心功能不全表现的PVS | 推荐 | A |
| 依赖动脉导管开放的重症新生儿PVS | 推荐 | A |
| 符合上述球囊成形术指征的瓣膜发育不良型PVS | 建议 | C |
| 室间隔完整的肺动脉瓣闭锁,如果解剖合适且排除右心室依赖性冠状动脉循环,可进行瓣膜打孔球囊成形术 | 建议 | C |
| 婴幼儿复杂CHD伴PVS,暂不能进行根治术时,可采用球囊成形术进行姑息治疗 | 建议 | C |
| 室间隔完整的肺动脉瓣闭锁或极重度PVS,合并右心室依赖性冠状动脉循环 | 不推荐 | C |
| 合并明显瓣上狭窄,无肺动脉干狭窄后扩张;单纯肺动脉瓣下漏斗部狭窄,即使瓣膜正常者 | 不推荐 | C |
注:PVS为肺动脉瓣狭窄;CHD为先天性心脏病;1 mmHg=0.133 kPa
(一)设备器材:数字减影血管造影机(放射线引导方法)、超声心动图诊断仪、高压泵、普通导管主要包括 MPA2导管、猪尾导管、右冠导管等,导丝包括0.035″普通导丝、交换导丝、0.035″超硬交换导丝(260 cm),适用于超声引导的多弯导管等。根据患者年龄、体重及瓣环直径选用不同类型及规格的球囊。一般对于体重20 kg以下的儿童选用聚乙烯单球囊(直径通常有10、12、15、18、20、25 mm等多种型号,球囊长度分20、30、40 mm 3种),一般选用球囊直径为肺动脉瓣瓣环直径的1.2~1.4倍[186]。
术前准备同ASD封堵术。
1. 放射线引导经皮肺动脉瓣球囊成形术:(1)右心室造影:经皮穿刺右侧股静脉,用猪尾导管(婴幼儿可用Berman漂浮球囊导管)行右心室造影,左侧位投照,了解PVS的程度、瓣膜形态、测量瓣环及瓣口直径。(2)右心导管检查:选用合适型号的MPA2导管(或其他右心导管)行右心导管检查,测量肺动脉压、右心室压并记录肺动脉至右心室连续测压结果,了解压差大小及有无压力移行区(漏斗部狭窄)。(3)放置交换导丝:后前位X线透视下将右心导管再次送入肺动脉(可配合普通导丝操作),通过右心导管送入长260 cm的交换导丝固定于左下肺动脉远端,撤出右心导管。扩张穿刺部位,退出普通动脉鞘管,换上球囊导管专用鞘管(7~12 Fr)。(4)送入球囊导管:将选择好的球囊导管沿交换导丝送入肺动脉,使球囊中部固定于狭窄瓣口处。球囊送入前要检查有无破损及漏气,并用对比剂排尽球囊内空气。(5)扩张肺动脉瓣:通过推注稀释的对比剂(1∶3稀释)使球囊快速充盈完全直至球囊的“腰形切迹”消失,然后迅速回抽对比剂使球囊排空,回抽过程中球囊导管顺势前送至肺动脉远端,以防阻塞右心室排血时间过长,通常从开始扩张至吸瘪球囊的总时间应<10 s。如此可以重复数次,每次间隔3~5 min,直到效果满意。(6)重复测压评价效果:如“切迹”消失满意则可重复右心导管检查,观察右心室压力下降情况和有无右室流出道激惹等。如扩张效果不满意,可再次送入交换导丝及球囊导管行球囊扩张,直至压力下降满意。一般肺动脉瓣跨瓣压差下降至25 mmHg以下或较术前下降50%以上为效果满意。(7)效果满意后停止扩张,撤出导管、导丝,穿刺点压迫止血,绷带加压包扎。
2. 单纯超声引导经皮肺动脉瓣球囊成形术[12]:(1)手术准备及麻醉方法同前,操作要点与超声引导经股静脉封堵PDA相似。术前先测量胸骨右缘第3肋间至右侧股静脉穿刺点的距离,并在多弯导管上标记该工作距离。(2)穿刺右侧股静脉,置入动脉鞘,静脉注射肝素100 U/kg。经动脉鞘送入多弯导管及导丝。导丝头部应伸出导管外2~4 cm,将导管及导丝一起向前推送。导管及导丝插入体内到达工作距离后,后撤导丝,在超声心动图引导下,调整多弯导管方向,使其通过三尖瓣进入右心室。测量右心室压力后,于主动脉短轴切面微调导管方向,使其朝向右心室流出道,轻轻推送导丝,即可将导丝通过肺动脉瓣送入肺动脉内。经导管测量右心室及肺动脉压力后,交换超硬导丝,退出导管,并测量该导管插入体内的距离。(3)沿导丝送入球囊,球囊直径为肺动脉瓣环直径1.2~1.4倍。超声在主动脉短轴切面或剑突下切面监测,固定球囊及导丝,以生理盐水快速扩张球囊,超声可见明显球囊回声,一旦球囊全部扩张,腰征消失,立即回抽生理盐水。退出球囊后,经导丝送入MPA2导管测量肺动脉压力及右心室压力,若压差仍>40 mmHg,则增加球囊直径后再次进行扩张。如果术后肺动脉与右心室(漏斗部)之间跨瓣压差≤25 mmHg,心脏超声显示肺动脉瓣狭窄已解除,为肺动脉瓣球囊成形术效果良好。(4)若压差下降满意,退出导丝、导管,超声评估肺动脉瓣反流情况。退出动脉鞘,穿刺点压迫止血,绷带加压包扎。
1. 穿刺血管处理:推荐术后局部穿刺点沙袋压迫4 h,卧床12 h[1C];
2. 术后随访:推荐术后24 h,1、3、6、12个月及每年复查超声心动图、心电图,必要时复查胸部X线平片[1C]。
1. 一般介入并发症:同经皮ASD封堵术。
2. 肺动脉瓣环撕裂及心脏破裂:多由于球囊选择过大,或由于测量时高估瓣环直径所致。一旦扩张后超声发现心包压塞,推荐立即行心包引流或开胸探查,如确定为肺动脉瓣环破裂,推荐在体外循环下修补瓣环[1C]。
3. 右心室撕裂、出血:多发生在心肌组织脆弱的新生儿或小婴儿,推荐在开胸体外循环下修补右心室[1C]。
4. 右心室流出道痉挛:多为右心室流出道处反复暴力操作引起的反应性狭窄,严重时可导致患儿死亡。故操作时应轻柔,发现有痉挛表现时推荐暂停操作,待其恢复后再进行,必要时推荐应用β受体阻滞剂如艾司洛尔或普萘洛尔[1C]。
5. 一过性反应:在球囊扩张过程中,由于球囊堵塞右心室流出道引起血压下降、心动过缓、缺氧等,一旦球囊吸瘪,上述反应即消失。
6. 呼吸暂停:常由于球囊扩张时间过长或过频引起。
7. 心律失常:扩张术中可出现一过性高度房室传导阻滞或快速性心律失常,多于撤出球囊后恢复。
8. 术后肺动脉瓣再狭窄:随着患者年龄增长,瓣环结构发生改变,术后瓣膜狭窄可能会出现。有报道显示选择球囊/瓣环比(BAR)为1.2~1.4时再狭窄的发生率约6.4%[187],BAR为1.1~1.2时再狭窄发生率为16.7%[188]。BAR能够预测术后再狭窄的风险,BAR越小,术后出现再狭窄的风险越高,针对瓣膜发育不良型的PVS推荐使用BAR 1.4~1.5的球囊来预防再狭窄[186]。也有研究认为老年人相较于年轻人再狭窄的发生率更低[189],因其瓣膜结构发生改变的可能性很小,但仍存在争议[187,190]。针对右心室造影呈圆顶状典型PVS推荐再次行球囊扩张术,其有效性已被证实[191, 192]。瓣膜发育不良、交界部位粘连、肺动脉瓣上狭窄、漏斗部狭窄所致的再狭窄发生率相对更高[193],建议试行介入或者进行外科手术治疗[2C]。
9. 三尖瓣腱索断裂:由于交换导丝穿过三尖瓣腱索后进入肺动脉,球囊扩张时撕裂腱索导致其断裂,产生三尖瓣关闭不全。后前位X线透视时一定要避免导管、导丝穿过腱索(往往导丝、导管形态不自然,X线透视下有折曲),必要时可以用猪尾导管通过肺动脉瓣(适合于非重度PVS)。如果发生严重三尖瓣反流,推荐及时外科手术修复[1C]。
10. 肺动脉瓣反流:是肺动脉瓣球囊扩张术后常见并发症,多项长期随访显示肺动脉瓣中重度反流发生率为15%~60%,且反流程度随时间不断进展[194, 195, 196]。患者对中度以下的肺动脉瓣反流耐受性较好,大多数个体能够较长时间耐受肺动脉瓣反流,有10%的患者出现轻度右心室增大,5%出现右心功能衰竭[197]。研究表明,首次球囊扩张时患者年龄过小、体重<3 kg、体表面积<0.3 m2、BAR>1.4、初始狭窄更高均为术后发生肺动脉瓣反流的危险因素[189,194,198, 199, 200]。对于存在1种或多种危险因素的患者应定期随访,出现右心功能衰竭或难以耐受反流的患者推荐行外科治疗或经导管肺动脉瓣置换术[201, 202][1C]。
自20世纪80年代初我国引进CHD介入治疗技术以来,随着介入器材的不断改进、介入术者经验的积累及介入技术的逐步提高,CHD介入治疗已成为大的医疗中心常规治疗方法。但是,CHD介入治疗是一项复杂而精细的技术,我国地域辽阔,各地医疗条件及水平不同,CHD介入治疗发展也不平衡,严格、正规培训从业人员,制定CHD介入适应证和操作规范对减少介入治疗并发症有重要意义。本指南是根据既往文献和专家意见制定,仅供临床参考,不具有法律强制效力,CHD患者的介入治疗需要临床医师根据患者实际情况进行个性化处理。目前,3D打印技术、人工智能、可吸收封堵器等新技术、新器械在CHD介入治疗领域的应用层出不穷,其临床疗效还有待于进一步验证,本指南内容为阶段性的总结,仍需要今后逐步更新。
指南制定专家名单(按姓氏汉语拼音排序)
安琪(四川大学华西医院);曹华(福建医科大学附属协和医院);范太兵(阜外华中心血管病医院);方臻飞(中南大学湘雅二医院);房芳(首都医科大学附属北京安贞医院);付强(首都医科大学附属北京天坛医院);谷兴华(山东大学齐鲁医院);韩波(山东省立医院);韩宇(阜外华中心血管病医院);胡海波(中国医学科学院阜外医院);华益民(四川大学华西第二医院);蒋世良(中国医学科学院阜外医院);孔祥清(南京医科大学第一临床医学院);李奋(上海交通大学医学院附属上海儿童医学中心);李红昕(山东第一医科大学附属第一医院);莫绪明(南京医科大学附属儿童医院);欧阳文斌(中国医学科学院阜外医院);潘家华(云南省阜外心血管病医院);潘湘斌(中国医学科学院阜外医院);逄坤静(中国医学科学院阜外医院);秦永文(海军军医大学第一附属医院);宋治远(陆军军医大学西南医院);王广义(解放军总医院);王霖(中南大学湘雅医院);王琦光(解放军北部战区总医院);文平(大连医科大学附属大连市儿童医院);吴蓉洲(温州医科大学附属第二医院);伍伟峰(广西医科大学第一附属医院);谢涌泉(中国医学科学院阜外医院);邢泉生(青岛妇女儿童医院);徐玮泽(浙江大学医学院附属儿童医院);杨剑(空军军医大学西京医院);尤涛(甘肃省人民医院);曾智(四川大学华西医院);张刚成(武汉亚洲心脏病医院);张戈军(中国医学科学院阜外医院);张浩(上海交通大学医学院附属上海儿童医学中心);张玉顺(西安交通大学第一附属医院);张在强(首都医科大学附属北京天坛医院);张智伟(广东省人民医院);赵世华(中国医学科学院阜外医院);赵天力(中南大学湘雅二医院);周达新(复旦大学附属中山医院);朱达(云南省阜外心血管病医院);朱鲜阳(解放军北部战区总医院)
执笔者:欧阳文斌、胡海波、张戈军(中国医学科学院阜外医院)
所有作者均声明不存在利益冲突



























