
成人隐匿性自身免疫糖尿病(LADA)是由于胰岛β细胞遭受缓慢自身免疫损害引起的糖尿病类型。依据病因学分类,LADA应属于1型糖尿病的自身免疫亚型。LADA早期不依赖胰岛素治疗,易误诊为2型糖尿病。我国LADA患病率在全球处于较高水平,患病人数居世界首位。早期诊断和及时正确干预有利于延缓LADA病情发展。为规范LADA综合管理,中国医师协会内分泌代谢科医师分会和国家代谢性疾病临床医学研究中心(长沙)特组织专家对首版共识进行修订,形成了《成人隐匿性自身免疫糖尿病诊疗中国专家共识(2021版)》,内容涵盖LADA流行病学、遗传学、免疫学特征、临床表现、诊断与分型、治疗与管理。本共识将有助于传递新近重要临床进展,指导临床实践。

成人隐匿性自身免疫糖尿病(latent autoimmune diabetes in adults,LADA)是指临床早期不依赖胰岛素治疗,以胰岛β细胞遭受缓慢的自身免疫损害为特征的糖尿病类型。在遗传背景、自身免疫反应、胰岛功能衰退速度、临床代谢特征等方面,LADA与经典的1型糖尿病(T1DM)和2型糖尿病(T2DM)均存在差异。LADA发病机制和临床表现具有高度异质性,备受专家学者与临床医师的关注。LADA患者的疾病进展、药物反应与个体的胰岛自身免疫和胰岛功能水平密切相关,提示LADA精准分型以及个体化治疗的重要性。
LADA的归类、诊断标准及治疗一直存在争议。2019年世界卫生组织(WHO)将LADA归为混合型糖尿病,认为LADA是一种独立的糖尿病类型[1];而美国糖尿病协会(ADA)将其归为T1DM亚型[2]。2005年国际糖尿病免疫学会(IDS)提出了LADA诊断标准[3]。2012年中华医学会糖尿病学分会发表了我国首个LADA诊疗共识《中华医学会糖尿病学分会关于成人隐匿性自身免疫糖尿病(LADA)诊疗的共识》[4]。2020年国际专家组结合最新证据发布了首个国际LADA治疗管理共识《Management of Latent Autoimmune Diabetes in Adults:A Consensus Statement From an International Expert Panel》[5]。
随着对LADA研究认识的深入,LADA诊疗新方法和循证医学证据在不断积累。鉴于此,本共识专家委员会与编写委员会在2012年《中华医学会糖尿病学分会关于成人隐匿性自身免疫糖尿病(LADA)诊疗的共识》的基础上,结合国际研究进展尤其是我国的最新资料,从流行病学、遗传学、免疫学、临床特征、诊断分型、治疗管理等方面对LADA共识予以更新,旨在推出新版LADA诊疗共识以更好地指导临床实践,并推动进一步研究以持续提升LADA诊治水平。
要点:
LADA在全球普遍存在。我国LADA患病率处于较高水平,患病例数居世界首位。
LADA 是我国成年人自身免疫糖尿病的最常见类型。
根据多项国际大规模流行病学研究报道,单一抗体筛查发现LADA 占初诊表型T2DM 的2%~12%[6, 7, 8, 9, 10]。2006年全国25个城市46个中心开展的LADA China 研究,通过单一谷氨酸脱羧酶抗体(GADA)筛查发现,18岁以上我国初诊T2DM患者中LADA 患病率为6.1%;若以30 岁为截点,则LADA患病率为5.9%,且北方地区高于南方,呈现由东北向西南递减的趋势[8]。欧洲数项大型流调也报道了北高南低的LADA患病状态[11]。无论在中国还是欧洲,这均与儿童T1DM发病率的地理分布趋势一致[12]。2016 年多中心流调数据显示,LADA患者占我国新发T1DM患者的65%[13]。
在我国,采用多抗体联合筛查可将LADA检出率提高至8.6%[14]。若依照2018年糖尿病流调数据推测,则我国现有LADA患者逾1 000万[13,15]。由此可见,LADA是我国成年人中最常见的自身免疫糖尿病类型;与全球比较,我国LADA的患病率较高,患病人数居世界首位。
要点:
LADA发病的遗传背景具有T1DM和T2DM的易感基因,其遗传特征与T1DM类似。
HLA-Ⅱ类基因是LADA的主要易感基因;HLA易感基因型存在种族差异。
LADA的发病具有显著的遗传背景。T1DM和T2DM的易感基因均参与LADA的发病[16, 17]。在高加索人群中,40%~66% 的LADA 患者有糖尿病家族史[18, 19];国内研究报道25%的LADA患者有糖尿病家族史[8,13]。
LADA 遗传易感性关联最强的位点为人类白细胞抗原(HLA)基因,尤其是HLA-Ⅱ类基因[20]。全基因组关联研究证实LADA的遗传特征大部分与经典T1DM 类似,LADA 最易感的位点是HLA-DQB1基因rs9273368[21]。但LADA的HLA易感基因频率比经典T1DM低。高加索人群及中国人群的研究均发现,HLA-Ⅱ类易感等位基因DR3、DR4、DQ2 和DQ8 频率由高到低的顺序为经典T1DM、LADA、T2DM和健康对照[6,8,22, 23]。
LADA的HLA易感基因型存在种族差异。高加索人群LADA患者易感基因型是DR3/DR4,而中国LADA患者最常见的HLA-Ⅱ类易感基因型是DR9/DR9[24]。T1DM相关的非HLA基因,包括胰岛素基因(INS)、细胞毒性T 淋巴细胞相关蛋白4 基因(CTLA4)、SH2B 衔接蛋白3 基因(SH2B3)等,与LADA有关[21]。此外,蛋白酪氨酸磷酸酶非受体型22 基因(PTPN22)C1858T 与高滴度GADA 的LADA相关[25]。
LADA 也与T2DM 易感基因关联。转录因子7类似物2(TCF7L2)是在LADA患者中研究最多的T2DM 易感基因。荟萃分析显示,TCF7L2 的rs7903146 位点是欧洲高加索人群LADA 患者,尤其是超重患者的易感基因[26]。其他T2DM易感基因ZMIZ1 基因、KCNQ1 基因等也被发现与LADA关联[16]。
近年,利用遗传风险评分模型(GRS)可识别出快速进展至胰岛素依赖的LADA患者[27]。由于种族间的遗传异质性,中国人群的LADA遗传风险预测还有待于大样本的LADA全基因组研究。
要点:
LADA 的免疫特征包括胰岛炎、胰岛自身抗体、胰岛抗原反应性T细胞等。
GADA是LADA患者最常见的胰岛自身抗体;联合抗体筛查可提高LADA诊断率。
LADA是一种T细胞介导的自身免疫性疾病,从病因发病学角度属于自身免疫介导的糖尿病类型。LADA的免疫学特征包括胰岛组织病理—胰岛炎及血液循环免疫异常—体液免疫和细胞免疫改变。
LADA 的组织免疫病理特征是胰岛炎。研究显示LADA患者胰岛组织存在多种免疫细胞浸润,包括CD4+T细胞、CD8+T细胞、CD20+B细胞、CD68+巨噬细胞等[28, 29, 30]。同时,LADA患者胰岛中白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-10等多种炎症因子水平升高[29]。
LADA 的体液免疫异常主要表现为患者血清中存在胰岛自身抗体。在T1DM临床中常见的胰岛自身抗体有GADA、胰岛素自身抗体(IAA)、蛋白酪氨酸磷酸酶自身抗体(IA-2A)、锌转运体8自身抗体(ZnT8A)。其中,GADA 是LADA患者中最常见的胰岛自身抗体。在新诊断的表型为T2DM的患者中,GADA阳性率2.6%~10%[7, 8,14];GADA阳性率高于IA-2A、ZnT8A、IAA 等抗体[31, 32, 33]。一项纳入3 062例初诊T2DM患者的LADA China研究发现,GADA、IA-2A 及ZnT8A 的阳性率依次为6.43%、1.96%、1.99%;若以GADA、IA-2A或ZnT8A任一抗体阳性诊断LADA,其诊断阳性率为8.62%[34]。在264 例LADA 患者中,GADA 阳性比例为74.6%,IA-2A 为22.7%,ZnT8A 为23.1%。因此,多抗体联合筛查能提高LADA诊断率,并能帮助预测LADA的胰岛功能衰竭[35]。除此之外,LADA患者还可存在跨膜蛋白7 自身抗体(Tspan7A)[31]、羧基肽酶H自身抗体(CPH-A)[36]、转录因子SOX13 抗体(SOX13-A)[37]等。新近研究发现,21.4% 的中国LADA患者呈Tspan7A抗体阳性[31]。
LADA 的细胞免疫异常主要表现为血循环中多种免疫细胞及其亚群数目比例和功能改变。LADA患者外周血单个核细胞(PBMC)可抑制大鼠胰岛细胞分泌胰岛素,提示存在细胞介导的免疫反应[38]。调节性T细胞(Treg)可抑制致病性T细胞的活化,从而诱导免疫耐受。LADA患者CD4+T细胞Foxp3启动子区域甲基化程度增高,可导致Treg数目减少和功能缺陷,诱发LADA 的自身免疫[39, 40]。有研究报道T细胞亚群的分布与LADA患者的C肽水平相关,提示其可能用来预测LADA胰岛功能的变化[41]。研究发现,除T细胞外,LADA患者外周调节性B细胞(Breg)、边缘区B细胞(MZB)、滤泡状B细胞(FOB)频率较健康人群有显著改变,提示B细胞可能参与LADA的病理机制[42]。NK细胞和中性粒细胞在固有免疫介导的局部免疫应答和联系适应性免疫应答中发挥重要作用。LADA患者外周NK细胞数量减少,NK细胞亚群频谱改变,中性粒细胞的RNA表达谱与健康对照存在差异,提示固有免疫也参与LADA的发病[43, 44, 45]。
要点:
LADA的自然病程可概括为四阶段:遗传易感期、免疫反应期、临床非胰岛素依赖期、临床胰岛素依赖期。
自身免疫所致胰岛β 细胞功能减退是推动LADA 病情进展和临床表现各异的关键。我国LADA 患者C 肽减低速度是T2DM 的3 倍;其中GADA高滴度者胰岛功能衰退显著加快。
LADA患者合并的代谢综合征及其组分、骨密度改变,介于T1DM与T2DM之间。
LADA 的肾病及视网膜病变患病率随疾病进展而增加;其ASCVD 患病率及死亡率与T2DM相似。
LADA易伴自身免疫甲状腺疾病,建议常规筛查其甲状腺功能和甲状腺自身抗体。
在遗传易感性、环境和表观遗传因素的作用下[40,46],LADA早期表现为自身免疫性胰岛炎,存在针对β细胞抗原的自身抗体[47]。胰岛自身抗体是自身免疫进程的标志物,也是预测发病风险的免疫指标。具有遗传易感基因且胰岛自身抗体阳性的LADA患者一级亲属为罹患LADA的高危人群[48]。值得注意的是,这种LADA早期无症状阶段可以先于糖尿病诊断数年,并且自身抗体的数量与疾病发病风险密切相关[49]。
LADA 的临床过程可分为非胰岛素依赖阶段和胰岛素依赖阶段[10,50]。在非胰岛素依赖阶段,LADA处于临床早期,患者表现与T2DM相似,无典型的“三多一少”高血糖症状,口服降糖药物治疗可控制血糖,无自发酮症倾向。该阶段胰岛β细胞不仅仅数量下降,也存在功能异常,这是疾病进展的关键因素[30,51]。LADA的胰岛β细胞功能衰退速度较T2DM 快,但较经典T1DM 缓慢。其中低滴度GADA 是LADA 患者β 细胞功能保留的预测因子[52]。部分低滴度GADA 的LADA 可伴胰岛素抵抗,而高滴度GADA或多个胰岛抗体阳性LADA的胰岛β 细胞功能衰退较快,非胰岛素依赖阶段较短。
LADA的胰岛β细胞功能减退呈现先快后慢的双相模式[52]。当患者胰岛β细胞功能显著不足,导致糖尿病酮症或酸中毒,必须胰岛素治疗而进入胰岛素依赖阶段。我国LADA 患者C肽减低速度是T2DM的3倍[53]。LADA进展为胰岛素依赖的时间异质性大,与起病年龄、抗体滴度和多个胰岛抗体阳性有关[10,54];其中GADA滴度是LADA患者胰岛β细胞功能衰竭最强的预测指标。研究显示针对N-末端表位GADA 较全长GADA 能更好地预测LADA进展至依赖胰岛素治疗的状况[55]。
LADA的胰岛功能、胰岛素敏感性变化及代谢特征对于LADA治疗有指导意义。LADA患者的血糖及糖化血红蛋白(HbA1c)水平介于T1DM 与T2DM之间,其血糖波动大于T2DM[56, 57]。LADA的体质指数(BMI)、腰围、腰臀比(WHR)、血压、甘油三酯均较T2DM低[8,58],而血压、低密度脂蛋白胆固醇(LDL-C)较T1DM高[59]。与T2DM相比,LADA患者体型偏瘦。研究表明,超重或肥胖也是加速LADA发生的危险因素,尤其有糖尿病家族史者更明显[60]。我国LADA患者伴代谢综合征的比例较T2DM略低,但高于T1DM与健康对照[8,61]。
LADA 的胰岛素抵抗可能存在种族差异。高加索人群LADA 患者胰岛素抵抗程度较T2DM轻[62]。而我国的一项研究采用高胰岛素正糖钳夹评价胰岛素敏感性,显示LADA胰岛素抵抗程度与T2DM相似[51]。LADA血循环中炎症细胞因子失衡所致胰岛素抵抗可能是其发生代谢综合征的重要机制[63, 64]。
LADA 的代谢特征可因起病年龄不同而异。与起病年轻者比,老年LADA(起病年龄≥60岁)胰岛β细胞功能较好,胰岛素抵抗更重,伴代谢综合征比例更高,其代谢特征与老年T2DM相似[65]。另外,LADA患者的骨密度介于T1DM和T2DM之间,其骨转换指标与T2DM接近[66]。LADA伴骨质疏松症的比例高于健康人群,与T1DM 类似,胰岛β细胞功能减退是骨量减少的重要原因[67]。
1.糖尿病微血管并发症:LADA的微血管并发症与血糖控制密切相关。在糖尿病早期(病程<5 年),LADA 视网膜及肾脏病变患病率与经典T1DM相似,低于T2DM[68, 69]。随着病程延长(病程>5年),LADA血糖控制更差,其患病率接近甚至高于T2DM[69, 70, 71, 72, 73]。与肾病及视网膜病变不同的是,LADA的神经病变患病率普遍高于T2DM[68,74, 75]。
2. 动脉粥样硬化性心血管病(ASCVD):ASCVD 在LADA 中普遍存在。尽管LADA 的ASCVD高危因素如高血压、血脂紊乱、中心性肥胖均明显低于T2DM[6, 7,9],但多数研究发现LADA 的ASCVD 患病率及死亡率与T2DM 相似,这可能与LADA、T2DM 发病机制或治疗不同有关[70,73,76, 77, 78]。LADA 的ASCVD 患病率与T1DM 的比较结果存在争议[70, 71,79],可能与研究纳入的种族、代谢控制及病程不同有关。LADA并发症风险筛查和评估仍需进一步研究。
LADA 易伴发其他自身免疫病或自身免疫相关抗体。较常见的自身免疫病包括自身免疫性甲状腺病、乳糜泻、Addison 病和自身免疫性胃炎等[32,80]。我国多中心研究发现,LADA患者甲状腺过氧化物酶抗体(TPO-Ab)、乳糜泻相关的转谷氨酰胺酶抗体(tTG-Ab)及Addison 病相关的21 羟化酶抗体(21OH-Ab)阳性率分别为16.3%、2.1%、1.8%[32]。
LADA最常伴甲状腺抗体TPO-Ab及自身免疫甲状腺病[32];且高滴度GADA的LADA患者近20%伴自身免疫甲状腺病,并以亚临床甲状腺功能异常最常见[80]。LADA 可作为自身免疫多内分泌腺病综合征(APS)的一个重要组成部分,常表现为伴发自身免疫甲状腺病的APS Ⅲ型,这可能与LADA患者携带HLA-Ⅱ类高危基因型有关。因此,本共识推荐LADA患者常规筛查TPO-Ab和甲状腺功能。
要点:
本共识根据病因分类,将LADA归类为自身免疫T1DM的缓慢进展亚型。
LADA 诊断标准:应同时具备下述三项:糖尿病起病年龄≥18岁;胰岛自身抗体或胰岛自身免疫T细胞阳性;诊断糖尿病后不依赖胰岛素治疗至少6个月。
建议对所有新诊断的表型为T2DM 的患者进行GADA筛查,以期早期诊断LADA。
LADA可根据GADA滴度高低分为两个亚型:LADA-1型与LADA-2型。
本共识推荐LADA的诊断标准为:(1)发病年龄≥18岁;(2)胰岛自身抗体阳性,或胰岛自身免疫T细胞阳性;(3)诊断糖尿病后至少半年不依赖胰岛素治疗。具备上述3项,可以诊断LADA。
围绕上述诊断标准,着重讨论下列几方面的问题:
1.关于LADA诊断的年龄界限:2005年IDS的标准将起病年龄定为>30 岁。基于中国数据,2012年中华医学会糖尿病学分会提出的诊断标准界定发病年龄≥18岁。依照国际通用的年龄切点,LADA China多中心研究发现,中国人群15~29岁临床初诊T2DM患者GADA阳性率11.7%[81];而≥30岁患者GADA阳性率5.9%,>30岁患者以10岁年龄段划分的各亚组间差异无统计学意义[8]。鉴于中国成人的定义为18周岁以上,而且我们已有相应年龄的患病数据,即18 岁以上初诊表型T2DM 中GADA阳性率为6.1%[4],因此将LADA年龄切点定为18岁是合适的。值得注意的是,18岁以下青少年亦存在缓慢进展的自身免疫糖尿病,被称为青少年隐匿性自身免疫糖尿病(LADY)[3]。
2.关于LADA早期非胰岛素依赖:LADA的临床早期通常口服降糖药治疗有效,存在的非胰岛素依赖阶段超过6个月。在发生酮症来就诊的糖尿病患者中,包括经典T1DM和酮症倾向T2DM。青少年起病的T1DM通常终身依赖胰岛素治疗。酮症起病的T2DM经胰岛素治疗解除糖毒性后,可不再依赖胰岛素,该过程较短且常<6个月。因此,酮症起病不作为LADA的诊断标准;依赖胰岛素治疗的模式是区分酮症起病的经典T1DM与LADA的有效临床指标。诊断后6个月以上不依赖胰岛素治疗可与经典T1DM 区别,同时亦可与酮症倾向T2DM鉴别。
3. 关于胰岛自身抗体阳性:胰岛自身抗体GADA、IA-2A、ZnT8A、IAA 是诊断T1DM 的重要免疫指标,它作为胰岛自身免疫标志物,可与T2DM区别。GADA 是公认的诊断LADA 最敏感的免疫指标[7,14]。GADA出现早且持续时间长,对胰岛功能预测价值明确[52,82],其检测方法已标准化,临床应用广泛。GADA的检测方法包括免疫印迹法、免疫酶活性沉淀法、酶联免疫吸附法、放射配体法、电化学发光法等,其中放射配体法是GADA检测的金标准[83]。胰岛自身抗体检测亟需标准化,放射配体法可作为现阶段我国胰岛自身抗体检测的推荐方法[84]。如无条件开展放射配体法,推荐采用经国际标准化评估的敏感性和特异性较高的其他检测方法,或将样本送符合国际标准化的中心检测。胰岛细胞抗体(ICA)由于检测标准化困难,近期应用减少。LADA筛查的二线抗体是IA-2A、ZnT8A[35,85]和IAA[33]。由于GADA筛查存在种族差异,高加索人群LADA 患者GADA 阳性率超过90%[7,35],而中国人群LADA患者GADA阳性率仅为67%[14],故中国人群LADA 筛查常在GADA 基础上,联合IA-2A、ZnT8A 和IAA 检测以提高诊断敏感性。再者,CPH-A、SOX13抗体等三线抗体,阳性率低,临床应用受限[36, 37]。新型胰岛自身抗体Tspan7A在LADA患者中的阳性率为21.4%,且可预测LADA胰岛功能衰竭,是有希望的新型免疫标志物[31]。
4.关于胰岛自身免疫T细胞:采用细胞免疫印迹技术研究发现,部分抗体阴性的临床诊断T2DM的患者存在对胰岛蛋白的细胞免疫反应[38,86, 87]。这类LADA 患者,因胰岛抗体阴性、而外周血T细胞对胰岛抗原呈增殖反应,被称为“T-LADA”[88],其胰岛功能衰竭快于T2DM[89]。我国研究也证实T-LADA的存在[90]。酶联免疫斑点(ELISPOT)试验显示,LADA存在GAD65反应性T细胞[91],提示T细胞联合胰岛抗体检测可提高诊断灵敏度[92, 93]。采用多聚体技术检测发现,LADA存在前胰岛素原特异性CD8+T细胞,但其频率和增殖潜能低于T1DM,这可能与LADA 的进展缓慢有关[94]。由于T 细胞检测要求较高,建议有条件的单位开展,为抗体阴性的LADA提供细胞免疫诊断手段。
鉴于早期精准分型对于治疗具有重要的指导作用,而LADA患者早期临床表现无特异性,且部分低滴度GADA抗体随着病程延长而呈现滴度下降甚或转为阴性[95],因此,本共识建议对所有新诊断的表型为T2DM的患者进行GADA筛查,旨在尽早、避免遗漏地诊断LADA。GADA为首选筛查抗体,而其联合IA-2A、ZnT8A、IAA与Tspan7A检测可提高LADA检出率。如果考虑成本和检测可及性,建议选择具有LADA高危因素的糖尿病患者进行抗体筛查。LADA高危者可伴有以下临床特征:有T1DM 或自身免疫病家族史、非肥胖体型(BMI<25 kg/m2)、起病年龄<60岁。如果患者GADA阳性,可诊断为LADA;如果GADA 阴性,但临床高度疑似LADA,应进一步检测IA-2A、ZnT8A、IAA 或Tspan7A等胰岛自身抗体;有条件尚可行胰岛抗原特异性T细胞检测。LADA的诊断路径见图1。
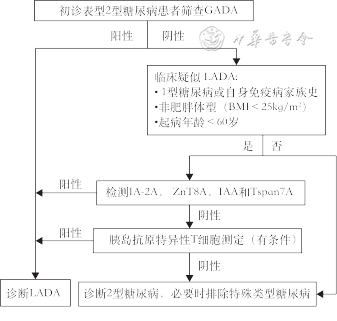

注:IAA检测适用于使用胰岛素未超过1周的新发糖尿病患者。LADA为成人隐匿性自身免疫糖尿病;GADA为谷氨酸脱羧酶自身抗体;IA-2A为蛋白酪氨酸磷酸酶自身抗体;ZnT8A为锌转运体8自身抗体;IAA为胰岛素自身抗体;Tspan7A为跨膜蛋白7自身抗体
1.不同GADA滴度的LADA:LADA可根据GADA滴度高低分为两个亚型[96]:高滴度LADA(GADA滴度≥180 U/ml)临床特征类似经典T1DM,胰岛功能衰退速度更快,较少伴代谢综合征,称为LADA-1型;而低滴度LADA(GADA滴度<180 U/ml)类似于T2DM,称为LADA-2型[8,80]。LADA-1型与LADA-2型的比例在中国患者中大约为1∶3[8]。
2.不同抗体种类的LADA:GADA阳性LADA的临床表型最典型,相比其他单一抗体阳性者,这些患者的年龄更轻、体型更瘦、β细胞功能更差,且胰岛衰减速度更快。Tspan7A阳性LADA患者胰岛功能亦较其阴性者衰减要快[31]。而单一IA-2A、ZnT8A或IAA阳性LADA患者较少见,对预测LADA进展至胰岛素依赖的价值有限[7,78]。GADA合并IA-2A和(或)ZnT8A阳性的LADA患者虽较少见,但其临床表型较GADA单一阳性者,起病年龄更轻、发病更急,胰岛功能衰减更快[97, 98, 99]。多种抗体的出现常伴随高滴度GADA;因此除GADA外的胰岛自身抗体预测价值是否独立于高滴度GADA仍需研究[99]。
3.不同起病年龄的LADA:根据发病年龄不同,LADA可分为成年LADA(发病年龄18~59岁)与老年LADA(发病年龄≥60岁)。相较老年LADA,成年LADA患者β细胞功能更差、胰岛素抵抗较轻,合并代谢综合征较少;二者胰岛抗体阳性比例相似而HLA遗传背景明显不同,成年LADA的HLA易感基因频率较高。相较老年T2DM,老年LADA有相似的胰岛功能、胰岛素抵抗水平、代谢综合征及HLA遗传特征[65]。
1999年WHO在糖尿病分型中,将LADA归类为T1DM,即自身免疫T1DM的亚型[100, 101]。而2019年WHO将LADA和酮症倾向T2DM划入混合型糖尿病[1]。2020年ADA指出,由自身免疫β细胞破坏引起的糖尿病应属于T1DM范畴,包括LADA[2]。两个学术组织分型标准的主要区别在于:2019年WHO分型标准侧重临床表现,认为LADA介于T1DM和T2DM之间,划入混合型;而2020年ADA分型标准侧重病因,认为LADA具有自身免疫病因证据,划入T1DM。鉴于病因在糖尿病分型中的特别重要性,以及临床特征具有较大异质性,本共识建议以病因发病学依据,将LADA归类为自身免疫T1DM的缓慢进展亚型。
要点:
LADA治疗目标在于理想控制血糖;调控自身免疫,保护胰岛功能;防控并发症。
LADA治疗应根据血糖控制、C肽水平、GADA滴度及心肾并发症情况,选择可能具有免疫调控、胰岛保护和心肾结局改善的降糖药物,实现个体化血糖控制目标。
LADA 患者应定期专科随诊,评估血糖控制、胰岛功能及并发症,及时调整治疗方案。
LADA治疗的总目标为,达到理想的糖代谢控制水平;调控胰岛自身免疫反应,保护胰岛β细胞功能;预防糖尿病并发症及伴发症。
为实现上述目标,本共识推荐采用下述LADA治疗管理流程(图2):先根据C肽水平,再按GADA滴度以及是否合并心肾疾病,选择胰岛素、二甲双胍及可能具有胰岛功能保护或改善心肾结局的降糖药,如二肽基肽酶-4抑制剂(DPP-4i)、噻唑烷二酮类(TZD)、钠⁃ 葡萄糖共转运蛋白2 抑制剂(SGLT2i)等,避免使用磺脲类药物。
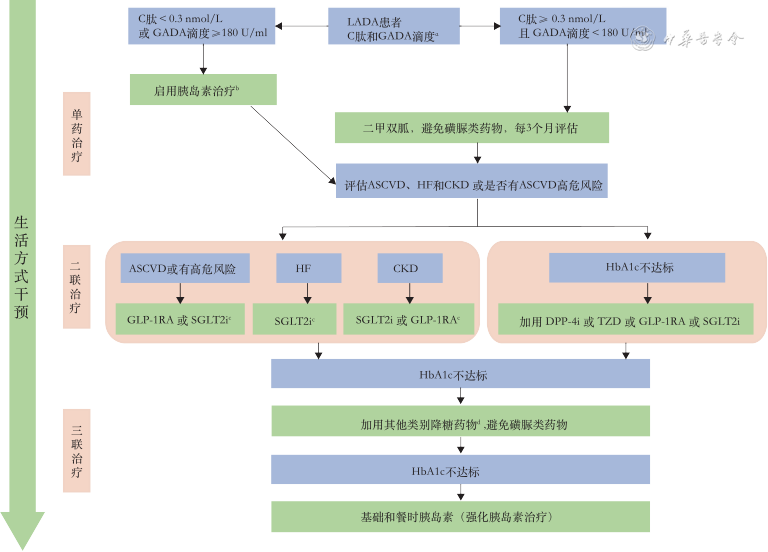

注:ASCVD为动脉粥样硬化性心血管病;CKD为慢性肾脏病;HF为心力衰竭。aGADA检测采用放射配体法,C肽单位1 nmol/L=0.333 ng/ml;b新诊患者HbA1c≥9%可短期强化胰岛素治疗;c加用有明确ASCVD、HF和CKD获益证据的GLP-1RA或SGLT2i;SGLT2i使用应注意潜在胰岛素需求和DKA风险;dHF患者不加用TZD,其他类别药物包括糖苷酶抑制剂
若C肽<0.3 nmol/L或GADA滴度≥180 U/ml:建议使用胰岛素治疗;C 肽≥0.3 nmol/L 且GADA 滴度<180 U/ml:对于新诊患者伴HbA1c≥9%,可短期胰岛素强化治疗。其他患者在二甲双胍和生活方式干预的基础上,根据是否合并心肾疾病决定治疗策略。
合并ASCVD推荐首选胰高血糖素样肽-1受体激动剂(GLP-1RA)或SGLT2i,合并心力衰竭推荐首选SGLT2i,合并慢性肾病推荐首选SGLT2i 或GLP-1RA。未合并ASCVD、心力衰竭或慢性肾脏病者,推荐加用DPP-4i、TZD、SGLT2i或GLP-1RA。如血糖控制不佳,可再加其他类别降糖药,但应避免磺脲类药物。并随访评估C肽水平和GADA滴度[5],及时调整治疗方案。
LADA 随访管理:建议根据HbA1c、胰岛功能及并发症情况综合制定随访方案。由于LADA胰岛β细胞功能减退呈先快后慢双相模式[52],建议对有一定胰岛功能者,每6~12 个月复查1 次C 肽水平。对病程5年以上患者,至少每年做1次全面的并发症筛查。
LADA患者的HbA1c水平建议通常控制在7%以下;根据年龄、病程、预期寿命、并发症或合并症的严重程度等可以制定个体化的控制目标[102]。对于血糖控制达标者,每6个月检测1次HbA1c;对更改治疗方案或血糖控制未达标者,每3个月检测1次HbA1c[102]。
LADA患者可根据监测时点和模式的适用范围,个体化灵活按需地应用各种血糖监测模式。对于大多数LADA患者,建议空腹血糖控制在4.4~7.2 mmol/L,餐后<10 mmol/L。孕期目标[103]是空腹血糖控制在3.9~5.3 mmol/L,餐后1 h 6.1~7.8 mmol/L,餐后2 h 5.6~6.7 mmol/L。
应用持续葡萄糖监测技术,LADA血糖控制的主要参数将参照T1DM目标范围内时间(TIR)要求。对于大多数LADA,建议TIR(3.9~10.0 mmol/L)>70%;而对于老年或低血糖高风险LADA,建议TIR(3.9~10.0 mmol/L)>50%;LADA合并妊娠时,则建议TIR(3.5~7.8 mmol/L)>70%[104]。
1.降糖药物:(1)胰岛素:胰岛素治疗可以通过促进胰岛休息和诱导免疫耐受,从而保护LADA患者胰岛β细胞功能[105]。鉴于LADA进展至胰岛素依赖的时间与胰岛抗体数目及GADA滴度等有关[97,106],且 GADA高滴度(≥180 U/ml)是快速出现胰岛素依赖的风险标志[52],本共识建议对于伴有GADA高滴度、多个胰岛自身抗体、低C肽水平或血糖控制不佳的LADA患者,尽早启用胰岛素治疗;而对于GADA低滴度、C肽水平或血糖控制较好者,可以选择适宜的口服降糖药物治疗。
(2)DPP-4i:DPP-4i可使DPP-4酶失活,提高GLP-1水平,促进胰岛β细胞分泌胰岛素而降低血糖。淋巴细胞表面抗原CD26分子具有DPP-4酶活性,存在于淋巴细胞、NK细胞和单核细胞表面,是T细胞激活的标志物;DPP-4i可抑制免疫细胞CD26分子DPP-4酶活性,具有免疫调节作用[107]。LADA患者单用或合用西格列汀、沙格列汀治疗,可以保护胰岛β细胞功能[108, 109, 110, 111]。本共识建议在无禁忌症情况下,LADA患者可选择DPP-4i治疗。
(3)TZD药物:TZD药物激活细胞内过氧化物酶体增殖物激活受体(PPAR),可增强胰岛素敏感性,具有抗炎及免疫调节作用[112, 113, 114]。罗格列酮可保护LADA患者胰岛β细胞功能[115]。建议在无用药禁忌情况下,可使用TZD治疗LADA。但需密切关注水肿、心功能、贫血、骨折等副作用。
(4)GLP-1RA:GLP-1RA作用于胰岛β细胞,促进胰岛素的合成和分泌;作用于胰岛α细胞,抑制胰高糖素释放;并可抑制食欲、减缓胃排空而降低血糖。GLP-1RA可通过激活免疫细胞的GLP-1R,发挥负性免疫调节作用[116, 117]。尽管GLP-1RA对T2DM患者减重、降糖、心肾保护等方面有明确获益,但治疗LADA研究有限。度拉糖肽试验(AWARD-2、-4和-5)事后分析发现,使用度拉糖肽的GADA阳性者的降糖效果与GADA阴性者相当;GADA低滴度者(≤200且≥5 U/ml)较GADA高滴度者(>200 U/ml)HbA1c下降更多,但差异无统计学意义[118]。对初诊T2DM中GADA或IA-2A阳性者使用艾塞那肽、利拉鲁肽分析[119],显示低C肽水平(≤0.25 nmol/L)患者的降糖效果差。建议GLP-1RA可应用于尚有一定胰岛功能的LADA患者。
(5)SGLT2i:SGLT2i通过抑制肾小管近端钠-糖共转运体,促进尿糖排泄而降低血糖。该类药物是糖尿病合并ASCVD及ASCVD高危因素者、合并慢性肾脏病(CKD)或心力衰竭(HF)的推荐用药[120, 121]。虽然目前尚无该类药物治疗LADA的研究报道,但是欧盟已批准达格列净和索格列净用于接受胰岛素治疗但血糖控制不佳,且BMI>27 kg/m2的成人T1DM患者[122, 123]。建议对于C肽水平较高且合并心肾并发症或超重的LADA患者可以考虑使用SGLT2i。需注意SGLT2i可能增加糖尿病酮症酸中毒(DKA)风险,应监测血酮水平。
(6)双胍类药物:二甲双胍既是T2DM的一线用药,也具有与胰岛素合用治疗T1DM的适应证[124]。可以改善T1DM患者胰岛素敏感性[125],减轻体重,降低LDL-C水平及动脉粥样硬化风险[126]。目前虽无二甲双胍单药治疗LADA的研究报道,但有合用其他药物的治疗试验[127]。建议在无双胍用药禁忌情况下,可采用二甲双胍联合其他适宜药物治疗LADA。
(7)糖苷酶抑制剂:目前尚无糖苷酶抑制剂治疗LADA的研究资料。对于胰岛功能较好的LADA患者,可考虑根据并发症和血糖控制水平,选择糖苷酶抑制剂作为三联药使用。
(8)磺脲类药物:磺脲类药物是T2DM的常用治疗药物。多项研究显示,LADA患者采用磺脲类药物治疗,多较其他药物更快进展至胰岛素依赖[97,128, 129]。磺脲类药物使LADA胰岛功能减退更快,这可能与其直接作用于胰岛β细胞,促进胰岛素释放和加速β细胞凋亡有关[130]。因此,建议LADA患者避免使用磺脲类药物。
2.免疫调节剂:(1)维生素D:维生素D可通过维生素D受体(VDR)发挥抗炎及免疫调节作用。功能性VDR存在于几乎所有免疫细胞,且维生素D代谢关键基因的多态性与T1DM相关[131]。使用1α-羟基维生素D3与胰岛素联合治疗LADA患者,较单用胰岛素组能更好地改善空腹C肽水平[132]。近年有将DPP-4i联合维生素D治疗自身免疫糖尿病的研究报道[133, 134]。西格列汀联合维生素D3 5 000 IU/d可使T1DM患者平均蜜月期延长至27.1个月[133]。沙格列汀联合维生素D3 2 000 IU/d对LADA患者胰岛β细胞功能有保护作用[134]。鉴于我国维生素D缺乏者众多,且维生素D保护胰岛功能效果好,本共识建议优先考虑给予LADA患者合用维生素D治疗。
(2)雷公藤多甙:雷公藤多甙是具有抗炎免疫调节作用的中药。研究显示,小剂量雷公藤多甙治疗LADA患者,可调节T细胞亚群,保护其残存胰岛β细胞功能[135]。本共识建议可以试用小剂量雷公藤多甙联合治疗LADA。
(3)GAD疫苗:初步研究显示,胰岛特异性抗原GAD65疫苗有助于保护LADA患者胰岛β细胞功能[136],尤其是GADA低滴度者。GAD疫苗仍在研究阶段,有效性和安全性尚待进一步验证。
(4)单克隆抗体及细胞治疗:抗CD3单克隆抗体、抗CD20单克隆抗体、干细胞或调节性T细胞等免疫治疗尚处研究阶段。治疗新发T1DM的药物试验显示其安全性及对胰岛功能的部分保护作用[137, 138]。LADA作为T1DM的缓慢进展亚型,有可能通过其免疫调节获益,尚需更大规模的临床研究证实。
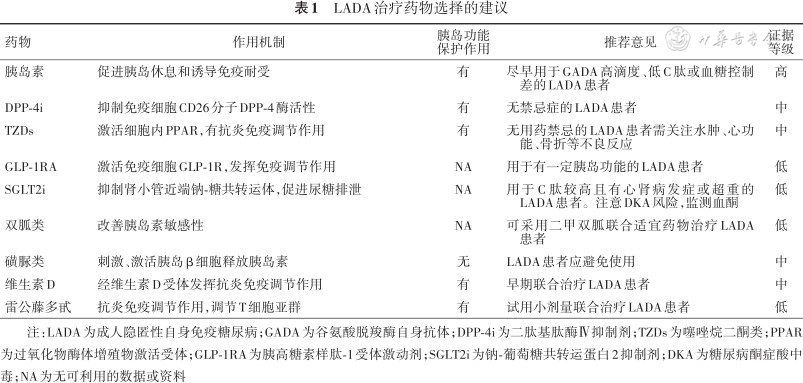
LADA治疗药物选择的建议总结见表1。本共识建议LADA治疗策略:(1)应避免使用磺脲类药物;(2)对于胰岛功能较好,且GADA低滴度或血糖控制良好者,可选择具有潜在胰岛功能保护的降糖药物,如TZD、DPP-4i、GLP-1RA或SGLT2i;(3)对于胰岛功能差、GADA高滴度者,应早期使用胰岛素治疗;(4)若联合应用上述降糖药仍血糖控制不佳者,需尽早启用胰岛素治疗;(5)可早期联合使用维生素D,发挥其免疫调节作用。
LADA治疗药物选择的建议
LADA治疗药物选择的建议
| 药物 | 作用机制 | 胰岛功能 保护作用 | 推荐意见 | 证据 等级 |
|---|---|---|---|---|
| 胰岛素 | 促进胰岛休息和诱导免疫耐受 | 有 | 尽早用于GADA高滴度、低C肽或血糖控制差的LADA患者 | 高 |
| DPP-4i | 抑制免疫细胞CD26分子DPP-4酶活性 | 有 | 无禁忌症的LADA患者 | 中 |
| TZDs | 激活细胞内PPAR,有抗炎免疫调节作用 | 有 | 无用药禁忌的LADA患者需关注水肿、心功能、骨折等不良反应 | 中 |
| GLP-1RA | 激活免疫细胞GLP-1R,发挥免疫调节作用 | NA | 用于有一定胰岛功能的LADA患者 | 低 |
| SGLT2i | 抑制肾小管近端钠-糖共转运体,促进尿糖排泄 | NA | 用于C肽较高且有心肾病发症或超重的LADA患者。注意DKA风险,监测血酮 | 低 |
| 双胍类 | 改善胰岛素敏感性 | NA | 可采用二甲双胍联合适宜药物治疗LADA患者 | 低 |
| 磺脲类 | 刺激、激活胰岛β细胞释放胰岛素 | 无 | LADA患者应避免使用 | 中 |
| 维生素D | 经维生素D受体发挥抗炎免疫调节作用 | 有 | 早期联合治疗LADA患者 | 中 |
| 雷公藤多甙 | 抗炎免疫调节作用,调节T细胞亚群 | 有 | 试用小剂量联合治疗LADA患者 | 低 |
注:LADA为成人隐匿性自身免疫糖尿病;GADA为谷氨酸脱羧酶自身抗体;DPP-4i为二肽基肽酶Ⅳ抑制剂;TZDs为噻唑烷二酮类;PPAR为过氧化物酶体增殖物激活受体;GLP-1RA为胰高糖素样肽-1受体激动剂;SGLT2i为钠-葡萄糖共转运蛋白2抑制剂;DKA为糖尿病酮症酸中毒;NA为无可利用的数据或资料
中国LADA患病人数居世界之首,有效管理LADA患者对实施健康中国战略有重要意义。早期筛查与准确诊断LADA是防治的关键,个体化治疗是其防治的重点。当前亟需解决的问题,包括胰岛自身抗体标准化检测方法推广、细胞免疫诊断、新型降糖药物或免疫治疗的随机对照试验等。未来还需开展大规模、多中心临床研究为诊疗提供更多高质量的循证医学证据,为我国LADA的治疗管理策略制定提供重要的依据。
免责声明:本共识只是专家意见,仅供临床参考,不具有法律强制效力。患者的治疗需要个性化对待,且本共识内容仅为阶段性的总结,今后仍需要进一步更新。
牵头执笔专家:周智广(中南大学湘雅二医院代谢内分泌科);纪立农(北京大学人民医院内分泌科);李霞(中南大学湘雅二医院代谢内分泌科)
专家委员会成员(按姓氏拼音排序):包玉倩(上海交通大学附属第六人民医院内分泌代谢科);陈丽(山东大学齐鲁医院内分泌科);单忠艳(中国医科大学附属第一医院内分泌与代谢病科);郭立新(卫生部北京医院内分泌科);洪天配(北京大学第三医院内分泌科);姬秋和(空军军医大学西京医院内分泌内科);纪立农(北京大学人民医院内分泌科);贾伟平(上海交通大学附属第六人民医院内分泌代谢科);姜宏卫(河南科技大学第一附属医院内分泌科);匡洪宇(哈尔滨医科大学附属第一医院内分泌科);邝建(广东省人民医院内分泌科);雷闽湘(中南大学湘雅医院内分泌科);李启富(重庆医科大学附属第一医院内分泌内科);李霞(中南大学湘雅二医院代谢内分泌科);李益明(复旦大学附属华山医院内分泌科);刘静(甘肃省人民医院内分泌科);刘铭(天津医科大学总医院内分泌代谢科);刘煜(南京医科大学附属逸夫医院内分泌科);柳洁(山西省人民医院内分泌科);母义明(解放军总医院第一医学中心内分泌科);宁光(上海交通大学医学院附属瑞金医院内分泌代谢科);秦贵军(郑州大学第一附属医院内分泌与代谢病科);全会标(海南省人民医院内分泌科);施秉银(西安交通大学第一附属医院内分泌代谢科);苏恒(云南省第一人民医院内分泌代谢科);孙子林(东南大学附属中大医院内分泌科);童南伟(四川大学华西医院内分泌代谢科);王卫庆(上海交通大学医学院附属瑞金医院内分泌代谢科);翁建平(中国科学技术大学附属第一医院内分泌科);肖海鹏(中山大学附属第一医院内分泌内科);肖新华(北京协和医院内分泌科);薛耀明(南方医科大学附属南方医院内分泌代谢科);阎德文(深圳市第二人民医院内分泌科);杨金奎(首都医科大学同仁医院内分泌科);杨立勇(福建医科大学附属第一医院内分泌科);杨涛(南京医科大学第一附属医院内分泌科);杨文英(中日友好医院内分泌科);曾天舒(华中科技大学同济医学院协和医院内分泌科);张俊清(北京大学第一医院内分泌内科);赵家军(山东第一医科大学附属省立医院内分泌科);赵志刚(河南大学附属郑州颐和医院内分泌科);周智广(中南大学湘雅二医院代谢内分泌科);朱大龙(南京大学医学院附属鼓楼医院内分泌科);邹大进(上海市第十人民医院内分泌代谢科)
编写委员会成员:曹楚晴、超晨、陈智鹰、邓超、何斌斌、侯粲、黄干、罗说明、时夏捷、王臻、武超、夏影、肖扬、谢志国、颜湘、杨琳、刘冰雯(中南大学湘雅二医院代谢内分泌科)
编写秘书:罗说明(中南大学湘雅二医院代谢内分泌科)
所有作者均声明不存在利益冲突



























