
探讨基于深度学习重建算法(DLR)的冠状动脉CT血管成像(CCTA)图像质量和对钙化病变所致冠状动脉狭窄的诊断价值。
前瞻性纳入2020年2月至2021年2月北京协和医院放射科确诊或拟诊冠心病的33例患者,其中男26例,女7例,年龄45~86(61.9±9.0)岁。所有患者接受CCTA检查并于1个月内进行有创冠状动脉造影(ICA)检查。采用DLR和混合迭代重建算法(HIR)重建CCTA图像。分别在主动脉根部、左主干开口、左前降支近段、左回旋支近段及右冠状动脉近段选取不同的感兴趣区测量两种图像的噪声、信噪比(SNR)、对比噪声比(CNR),并以Likert 4级评分法进行图像质量主观评分(1分,优秀;4分,不能诊断)。以ICA为金标准,计算基于DLR和HIR的CCTA诊断钙化斑块所致冠状动脉血流梗阻性病变的诊断效能。
共33例患者的123处病变纳入分析。DLR图像的噪声低于HIR图像(定义为主动脉根部CT值的标准差:18.12±3.66比24.19±5.71,P<0.001),CNR和SNR均高于HIR图像(主动脉根部CNR:43.83±23.73比26.38±9.69,P<0.001,SNR:26.66±7.83比21.23±8.65,P<0.001),主观评分优于HIR图像(1.12±0.41比1.46±0.60,P<0.001)。DLR与HIR对于诊断钙化病变所致冠状动脉血流梗阻性病变的灵敏度、特异度和准确度分别为100.0%、77.4%、78.9%和100.0%、63.5%、65.9%。与HIR相比,DLR图像上CCTA的假阳性病例减少38%。
基于人工智能的DLR重建算法能够显著降低CCTA图像噪声并提高图像质量。DLR有助于提高CCTA对钙化斑块所致冠状动脉血流梗阻性病变的诊断效能,具有良好的临床应用价值。

冠心病的发病率和死亡率呈现不断增长趋势[1],因此对其进行早期诊断十分重要。有创冠状动脉造影(ICA)是目前诊断冠心病的金标准,但由于其有创的特点,不适合作为冠心病的初步筛查方法。近年来,冠状动脉CT血管成像(CCTA)技术已经成为筛查和诊断冠心病的重要无创影像学检查方法[2]。CCTA诊断冠心病的灵敏度较高,但是由于钙化伪影以及呼吸运动伪影,其诊断效能受到影响。随着CT成像技术的发展,迭代重建算法的出现降低了CT的图像噪声,能够在降低辐射剂量的同时提高图像质量[3, 4],同时减少钙化伪影,改善冠状动脉狭窄评估[5]。混合型迭代重建(HIR)和全模型迭代重建是目前应用较多的传统迭代重建算法。随着人工智能技术的发展,深度学习技术在医学影像领域逐渐发挥独特优势,包括图像重建、识别肉眼无法感知的信息、提高诊断准确性等[6]。在图像重建方面,深度学习技术不但可以提高重建速度,而且能够改善图像质量[7, 8]。本研究探讨基于深度学习重建算法(DLR)对CCTA图像质量的影响,以及对提高钙化病变所致冠状动脉狭窄诊断的价值。
本研究为诊断性试验,纳入2020年2月至2021年2月于北京协和医院放射科就诊并确诊或拟诊冠心病的患者33例,其中男26例,女7例,年龄45~86(61.9±9.0)岁。纳入标准:(1)行CCTA检查,且1个月内接受ICA检查的患者;(2)CCTA影像质量尚可,无明显运动及呼吸伪影;(3)存在由钙化斑块或混合斑块所导致的冠状动脉狭窄。排除标准:(1)严重肝肾功能不全;(2)碘对比剂过敏;(3)冠状动脉旁路移植术后;(4)孕妇或哺乳期妇女;(5)失代偿性心功能不全。本研究经北京协和医院伦理委员会批准(JS-2462),所有患者均签署知情同意书。
采用320排CT(Aquilion ONE GENESIS Edition,日本东芝公司)心电门控前瞻性扫描,心率<75 次/min的患者在70%~80% R-R间期曝光,心率>75 次/min的患者在35%~55% R-R间期曝光。所有患者检查前3 min舌下喷硝酸甘油0.5~1.0 mg,确保冠状动脉管腔扩张。于患者右侧肘前静脉开通静脉通路,经双筒高压注射器注入对比剂及生理盐水,对比剂采用非离子型对比剂碘普罗胺370,根据体重采用个体化对比剂注射方案,注射流率为体重(kg)×0.053 ml/s,注射时间10 s,对比剂注射完成后以相同流率注入30 ml生理盐水。采用对比剂跟踪技术,扫描触发点设置于升主动脉根部,当升主动脉根部CT值达到触发阈值(280 HU)后,机器延迟10 s后自动开始扫描。扫描范围为气管分叉下方1 cm至心脏膈面水平。CT扫描参数:准直器宽度320 mm×0.5 mm;旋转时间0.275 s;管电压100 kVp,管电流采用自动调制技术,噪声指数SD为33。
采用混合迭代重建算法和DLR间隔2%重建CCTA图像数据,选择冠状动脉显示最佳的期相。重建层厚均为0.5 mm,层间距为0.5 mm。HIR采用FC09重建,DLR采用Cardiac模式重建。所有图像传输到专用的后处理工作站(Vitrea Workstation,Version 4.0693)进行狭窄程度分析。对有狭窄的冠状动脉节段,选取狭窄处以及狭窄近、远端正常血管,测量血管直径及面积,以狭窄近、远端的平均值作为参考管径,狭窄程度=狭窄管径/参考管径。管腔狭窄≥50%判定为梗阻性冠状动脉病变。图像质量分析包括客观分析和主观分析。
1. 客观图像质量分析:采用原始轴面图像,在HIR和DLR图像同一层面的主动脉根部、左主干开口、左前降支近段、左回旋支近段及右冠状动脉近段选取感兴趣区(ROI),在避开血管壁和斑块的同时保证ROI尽可能大,测量血管及血管周围脂肪组织的CT值。主动脉处CT值的标准差定义为图像噪声,信噪比(SNR)和对比噪声比(CNR)计算公式如下:SNR=相应血管的CT值/图像噪声;CNR=(相应血管CT值-血管周围脂肪组织CT值)/图像噪声。
2. 主观图像质量分析:将冠状动脉图像质量分为4级,相应评为1~4分[9]:1级为血管强化好,边界清晰,无阶梯状伪影或血管中断;2级为血管边界略模糊,或有轻度阶梯状伪影;3级为血管强化一般,边界模糊,或有中度伪影,但无血管中断;4级为血管显示不清或中断,有严重阶梯状伪影。质量评分为1~3级的为可评价血管,质量评分为4级的为不可评价血管。冠状动脉图像质量评价由两名医师完成,诊断不一致时两人重新观察原始图像及重建图像,最后得出一致结论。
ICA检查在导管室内由2名具有多年工作经验的心血管内科医师共同完成,检查取患者标准体位,每条主干血管至少选取2个不同的角度进行投照摄影,以便后续分析。冠状动脉狭窄程度定量测量在专业的软件(AngioPlus Core,中国博动医学影像科技)上完成。
采用SPSS 22.0软件进行统计学分析。采用率和频数描述性别、糖尿病、高血压、高血脂、吸烟和家族史等定性资料。钙化积分为偏态分布,以M(Q1,Q3)表示;经Shaprio-Wilk检验,HIR组和DLR组的CT值、噪声、信噪比、对比噪声比、主观图像质量评价都不满足正态分布,采用Wilcoxon秩和检验。以ICA为金标准,计算CCTA诊断钙化病变所致冠状动脉血流梗阻性病变的诊断效能,包括灵敏度、特异度、阳性预测值、阴性预测值和准确度等。采用Bootstrap方法计算两组算法的诊断性能差异的统计学意义。双侧检验,检验水准α=0.05。
最终33例患者的123处钙化病变纳入分析(表1)。钙化积分中位数为227.9(124.2,484.6)。
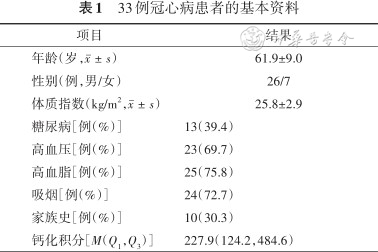
33例冠心病患者的基本资料
33例冠心病患者的基本资料
| 项目 | 结果 |
|---|---|
| 年龄(岁,) | 61.9±9.0 |
| 性别(例,男/女) | 26/7 |
| 体质指数(kg/m2,) | 25.8±2.9 |
| 糖尿病[例(%)] | 13(39.4) |
| 高血压[例(%)] | 23(69.7) |
| 高血脂[例(%)] | 25(75.8) |
| 吸烟[例(%)] | 24(72.7) |
| 家族史[例(%)] | 10(30.3) |
| 钙化积分[M(Q1,Q3)] | 227.9(124.2,484.6) |
DLR图像噪声明显低于HIR图像(主动脉根部:18.12±3.66比24.19±5.71,P<0.001)。DLR图像的CNR和SNR均高于HIR图像(主动脉根部CNR:43.83±23.73比26.38±9.69,P<0.001,SNR:26.66±7.83比21.23±8.65,P<0.001)(图1)。
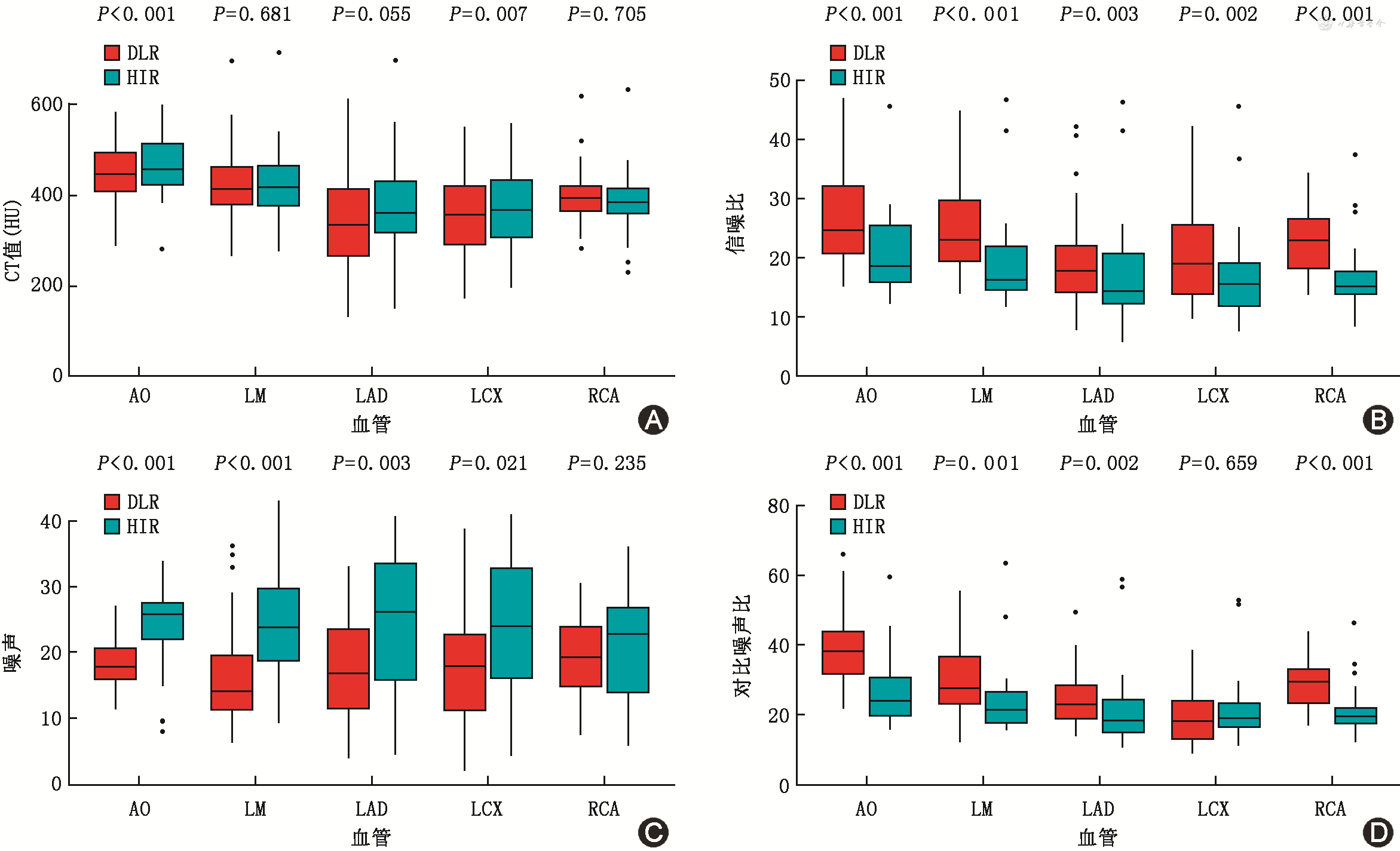

注:DLR为深度学习重建算法;HIR为混合迭代重建算法;Ao为主动脉根部;LM为左主干;LAD为左前降支;LCX为左回旋支;RCA为右冠状动脉
DLR图像和HIR图像对所有冠状动脉节段均可评价。综合评分DLR图像质量优于HIR图像(1.10±0.38 比1.36±0.60,P=0.003)(表2)。
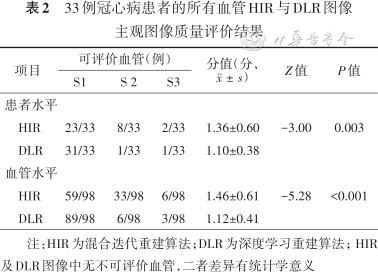
33例冠心病患者的所有血管HIR与DLR图像主观图像质量评价结果
33例冠心病患者的所有血管HIR与DLR图像主观图像质量评价结果
| 项目 | 可评价血管(例) | 分值(分,) | Z值 | P值 | ||
|---|---|---|---|---|---|---|
| S1 | S 2 | S3 | ||||
| 患者水平 | ||||||
HIR | 23/33 | 8/33 | 2/33 | 1.36±0.60 | -3.00 | 0.003 |
DLR | 31/33 | 1/33 | 1/33 | 1.10±0.38 | ||
| 血管水平 | ||||||
HIR | 59/98 | 33/98 | 6/98 | 1.46±0.61 | -5.28 | <0.001 |
DLR | 89/98 | 6/98 | 3/98 | 1.12±0.41 | ||
注:HIR为混合迭代重建算法;DLR为深度学习重建算法;HIR及DLR图像中无不可评价血管,二者差异有统计学意义
以病变为分析单位,DLR与HIR图像诊断钙化或混合斑块引起的≥50%面积狭窄的灵敏度、特异度、阳性预测值、阴性预测值和准确度分别为83.0%、84.2%、76.5%、88.9%、83.7%及85.1%、75.0%、67.8%、89.1%、78.9%。DLR图像诊断准确性优于HIR图像(83.7% 比78.9%,P<0.001)。与HIR相比,DLR图像上的假阳性病例由19例降低到12例,假阴性病例增加1例。DLR与HIR图像诊断钙化或混合斑块引起的≥50%直径狭窄的灵敏度、特异度、阳性预测值、阴性预测值和准确度分别为100.0%、77.4%、23.5%、100.0%、78.9%及100.0%、63.5%、16.0%、100.0%、65.9%。DLR图像诊断准确性优于HIR图像(78.9%比65.9%,P<0.001)。与HIR相比,DLR图像上假阳性病例由42例降低到26例,CCTA的假阳性病例减少38%(表3和图2)。
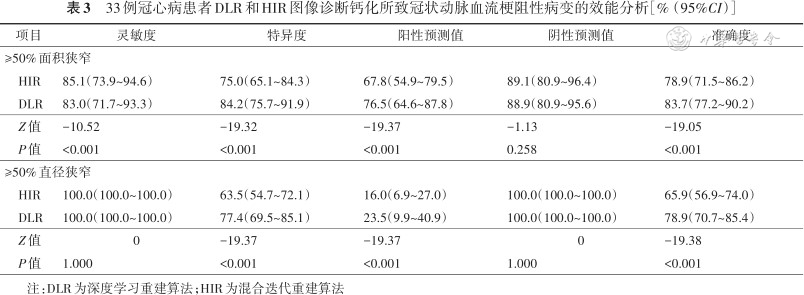
33例冠心病患者DLR和HIR图像诊断钙化所致冠状动脉血流梗阻性病变的效能分析[%(95%CI)]
33例冠心病患者DLR和HIR图像诊断钙化所致冠状动脉血流梗阻性病变的效能分析[%(95%CI)]
| 项目 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 | 准确度 |
|---|---|---|---|---|---|
| ≥50%面积狭窄 | |||||
HIR | 85.1(73.9~94.6) | 75.0(65.1~84.3) | 67.8(54.9~79.5) | 89.1(80.9~96.4) | 78.9(71.5~86.2) |
DLR | 83.0(71.7~93.3) | 84.2(75.7~91.9) | 76.5(64.6~87.8) | 88.9(80.9~95.6) | 83.7(77.2~90.2) |
Z值 | -10.52 | -19.32 | -19.37 | -1.13 | -19.05 |
P值 | <0.001 | <0.001 | <0.001 | 0.258 | <0.001 |
| ≥50%直径狭窄 | |||||
HIR | 100.0(100.0~100.0) | 63.5(54.7~72.1) | 16.0(6.9~27.0) | 100.0(100.0~100.0) | 65.9(56.9~74.0) |
DLR | 100.0(100.0~100.0) | 77.4(69.5~85.1) | 23.5(9.9~40.9) | 100.0(100.0~100.0) | 78.9(70.7~85.4) |
Z值 | 0 | -19.37 | -19.37 | 0 | -19.38 |
P值 | 1.000 | <0.001 | <0.001 | 1.000 | <0.001 |
注:DLR为深度学习重建算法;HIR为混合迭代重建算法
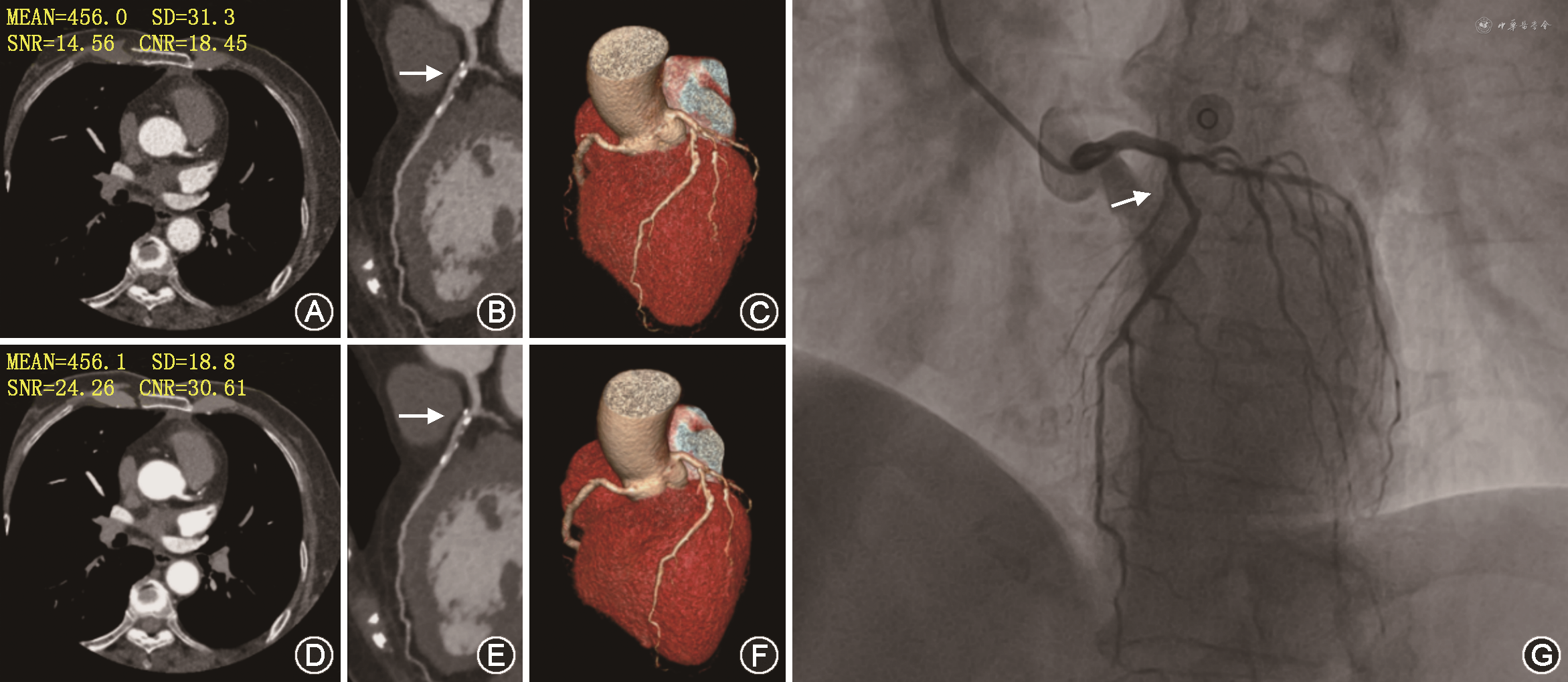

注:MEAN为平均CT值(单位:HU);SD为图像噪声;SNR为信噪比;CNR为对比噪声比
本研究采用基于深度学习的图像重建算法,探究其对CCTA图像质量以及钙化病变所致血流梗阻性病变诊断效能的影响。结果显示,DLR图像噪声低于HIR,图像质量优于HIR,以ICA为金标准,DLR图像提高了钙化所致血流梗阻性病变的诊断准确性。
提高CT的图像质量是CT技术研究的热点。随着迭代重建技术的应用,大量研究已证明IR可以改进CT图像质量,并能够大大减少辐射剂量,提高诊断效能[5,10]。HIR和全模型迭代重建是目前应用较多的传统模式迭代重建算法,但这两种迭代重建算法图像的塑胶感、块状伪影会影响CT图像的评估[11]。随着深度学习技术应用于噪声去除,CT的图像质量进一步提高。近来出现的东芝640层宽体CT的DLR算法利用深度卷积神经网络,对图像进行降噪和去除伪影,该网络以低剂量的混合迭代重建图像作为训练输入,以高剂量的全模型迭代重建图像作为训练目标,通过学习其噪声特性,更好的区分噪声和信号,实现更高的空间分辨率并达到更好的噪声去除效果。多项研究证实DLR图像噪声比混合迭代重建更小,CNR更高[12, 13, 14]。然而,该技术在冠状动脉成像方面应用较少。本研究结果显示DLR图像主动脉根部噪声较HIR图像降低25.1%,主动脉根部SNR和CNR分别提高了25.6%和66.2%,DLR图像质量主观评分也优于HIR图像,与Tatsugami等的研究结果一致[13]。
钙化伪影是影响CCTA诊断准确性的主要原因之一。Arbab-Zadeh等 [15]的研究表明对于钙化积分>600患者,CCTA的诊断特异度和阴性预测值明显下降,假阳性率升高。使用迭代重建降低图像噪声的同时,能够提高重度钙化病变所致血流梗阻性病变的诊断准确度[5]。Tatsugami等[13]指出DLR图像上冠状动脉血管边界更加锐利,但没有研究DLR对冠状动脉狭窄的诊断效能。本研究纳入患者的钙化积分为227.9(124.2,484.6),在比较DLR与HIR图像质量的基础上,以ICA为金标准,比较二者对冠状动脉钙化病变所致狭窄的诊断效能。结果显示无论是面积狭窄还是直径狭窄,DLR图像对钙化所致冠状动脉血流梗阻性病变的诊断准确性均高于HIR图像(面积狭窄:83.74%比78.86%;直径狭窄:78.86%比65.85%)。Benz等[16]研究基于GE的Revolution CT,比较基于DLR与自适应统计迭代重建算法的CCTA图像诊断血流梗阻性病变的效能,结果表明DLR具有更好的图像质量,诊断准确性略有提升,假阳性结果降低,但差异无统计学意义。钙化病变是引起CCTA假阳性结果的主要原因,Benz等[16]并未针对钙化病变。本研究针对钙化病变所致的血流梗阻性病变,假阳性病例分别减少36.8%(面积狭窄)和38.1%(直径狭窄),表明DLR能够减少钙化伪影的影响,避免患者经受不必要的有创冠状动脉造影检查,具有临床应用价值。
本研究尚有不足之处:样本量小,尚需进一步扩大样本量验证研究结果;只关注了钙化病变,没有研究非钙化斑块引起的狭窄或支架内再狭窄;本研究仅仅是在东芝CT上进行的,没有比较其他厂商的深度学习算法对CCTA的影响。
综上所述,基于人工智能的DLR重建算法能够显著降低CCTA图像噪声并提高图像质量。DLR有助于提高CCTA对钙化所致冠状动脉血流梗阻性病变的诊断效能,具有良好的临床应用价值。
佳能医疗系统(中国)有限公司的徐敏和闫静对本研究中提供统计学和深度学习算法支持
所有作者均声明不存在利益冲突



























