
儿童膀胱过度活动症(POAB)临床多见,常以尿急尿频为主要症状,不及时治疗可引起反复泌尿系感染甚至上尿路损害,严重者常产生精神心理问题。我国POAB诊断和治疗方案有待进一步规范。该领域专家在充分借鉴全球最新研究成果的基础上,参考我国及国际指南和相关文献,共同讨论制定了本共识,以期为POAB的诊治提供指导意见。

儿童膀胱过度活动症(pediatric over active bladder,POAB)是一种常见的下尿路功能障碍症候群,在儿童和青少年中发生率较高,且有逐年增高的趋势,显著影响患儿的生活质量。但POAB病因和发病机制复杂,诊断和治疗方案仍不规范[1, 2, 3]。中华医学会小儿外科学分会小儿尿动力和盆底学组以及泌尿外科学组的相关专家根据国际儿童尿控协会(International Children′s Continence Society,ICCS)、国际尿控协会(International Continence Society,ICS)、欧洲泌尿外科协会(European Association of Urology,EAU)和美国泌尿外科协会(American Urological Association,AUA)制定的OAB诊疗指南,并结合国内外最新相关文献制定本共识,为临床规范POAB的诊断和治疗提供参考。
膀胱过度活动症(OAB)不是一种单一的疾病,而是一种复杂的症候群。1996年以前以尿急为主的下尿路症候群被定义为不稳定膀胱(无明确病因)和逼尿肌反射亢进(神经系统疾病),认为与储尿期膀胱逼尿肌不稳定收缩有关。1997年首次出现OAB这一概念[2],此后OAB的定义被数次修改。2010年以前,ICS曾将OAB定义为在膀胱充盈期患者不能主观抑制的逼尿肌自发或诱发收缩,引起膀胱内压升高(超过15 cmH2O,1 cmH2O=0.098 kPa)[3, 4]。2010年,国际泌尿妇科协会(International Urogynecological Association,IUGA)和ICS把OAB定义修改为“尿急,通常伴有尿频和夜尿增多,伴或不伴有急迫性尿失禁,无泌尿系感染和明确器质性病变”[5]。2016年ICCS采用了上述定义,将POAB定义为以尿急为主要特征的临床症候群,常伴尿频、夜间多尿、遗尿等,伴或不伴有急迫性尿失禁(图1),且排除尿路感染或明确病理因素[3]。
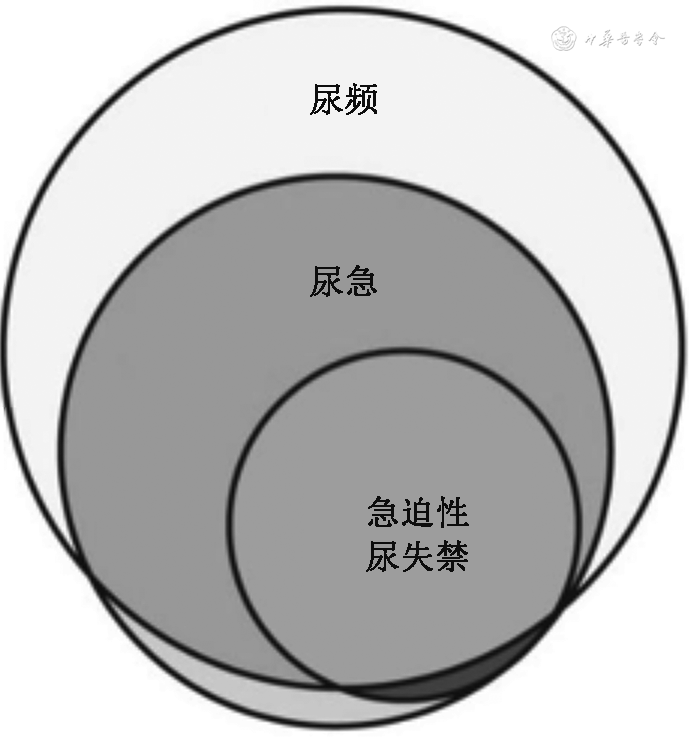

从广义来看,只要存在OAB定义所述的尿急症候群的儿童均可诊断为POAB。根据是否存在明确病因可分为原发性/特发性OAB和继发性OAB。上述2016年ICCS定义的OAB类型即为原发性/特发性OAB(IOAB)[6, 7];而有明确病因的OAB称为继发性OAB。
根据OAB治疗的难易程度,AUA/尿动力学与女性泌尿外科学会(Society for Urodynamics and Female Urology,SUFU)指南定义了一个特殊类型的OAB,“难治性/顽固性OAB(refractory overactive bladder)”,即在接受符合症状的行为疗法足够时间后(8~12周)治疗失败,且有一种及以上抗M受体药物用药4~8周疗效不佳或不能耐受者[6]。
对于儿童来讲,根据是否与神经因素有关,继发性POAB又可分为“神经源性(neurogenic)OAB”和“非神经源性(non-neurogenic)OAB”。前者指存在中枢及外周神经器质性病变引起的神经源性尿急症候群,原发疾病有新生儿缺血缺氧性脑病、椎管内肿瘤、脊柱裂、脊膜膨出和脊髓栓系等;后者由可能引起OAB症状的非神经因素疾病导致,如泌尿系感染、尿道瓣膜、结石、肿瘤和尿道狭窄等[8, 9]。此外,在尿急的基础上,根据是否有急迫性尿失禁,OAB可分为“干性OAB”和“湿性OAB”。
【推荐意见】POAB定义为儿童尿急尿频伴或不伴有尿失禁,常伴夜间多尿/遗尿,排除尿路感染和明确的原发疾病。如果有明确的原发病则诊断为继发性OAB。
OAB患病率各地报道结果不尽一致。根据ICS定义,2005年至今欧洲及部分亚洲国家流行病学调查显示,成人OAB的患病率在9%~28%[10]。日本的一项流行病学调查显示,如果按照尿急且排尿次数>8次/d或每月存在≥1次急迫性尿失禁的定义,则日本儿童OAB的患病率可达17.8%[11, 12]。2009年韩国调查显示,5~13岁儿童OAB的总患病率为16.59%,随着年龄增长,患病率有降低趋势[13, 14, 15];2018和2020年流行病学调查显示,中国5~14岁儿童和17~21岁青少年女性OAB的患病率分别为9.01%[16]和6.1%[17],干湿性OAB的患病率分别为3.8%和2.3%[17]。OAB儿童的夜间遗尿、便秘、大便失禁的发生率明显高于健康群体,儿童时期有OAB病史者在成人阶段尿频、尿急、尿失禁的发生率明显升高[9,15]。此外,近年来随着育儿方式的改变(如一次性尿不湿的普及或依赖性使用),儿童排尿功能障碍尤其合并尿频尿急、尿失禁和遗尿等OAB症候群的发生率也有升高的趋势[18, 19, 20]。
原发性OAB的病因尚不十分明确,目前认为可能与下列异常有关:(1)膀胱功能异常,如膀胱不稳定或逼尿肌不稳定、小容量膀胱等。部分OAB的患儿在尿动力学检测中被发现存在充盈期逼尿肌过度活动(detrusor overactivity,DO),因此,OAB曾被称为膀胱不稳定收缩,认为由膀胱不稳定收缩引起。(2)尿道不稳定(urethral instability,URI)及逼尿肌括约肌协同失调(detrusor sphincter dyssynergia,DSD)。膀胱尿道同步测压可以判断OAB是由单纯的膀胱功能异常引起还是膀胱和尿道协同失调或URI所致[21, 22, 23]。(3)膀胱感觉过度敏感,常与膀胱黏膜及神经感觉过敏有关,且未发现明确病因[3,14]。(4)盆底肌功能异常,如盆底功能减弱等。(5)其他发病相关因素,如肥胖、原发性夜间遗尿症、便秘、婴幼儿期如厕训练延迟、尿不湿过度依赖、膀胱直肠功能障碍、激素代谢失调以及精神心理因素等[17,24]。
Loening-Baucke[25]对234名便秘儿童调查发现,29%并发白天尿失禁,34%有夜间遗尿,并且11%有泌尿系感染(urinary tract infection,UTI)。2013年ICCS将儿童排尿和排便障碍症状统一定义为膀胱直肠功能障碍(bladder and bowel dysfunction,BBD)[24]。儿童同时存在下尿路症状和排便功能障碍,可表现为尿频尿急、大小便失禁、排尿困难、反复尿道感染、便秘或腹泻等,排除神经和解剖等器质性疾病证据[4,26]。特发性OAB的患儿如果存在便秘等排便障碍也属于BBD的范畴。国外一项研究发现,当95%患儿排便功能改善后,68%的患儿白天尿失禁减少,治疗排尿障碍也可同时降低患儿便秘及大便失禁的发生率。排尿和排便关系密切,OAB治疗的同时也需要治疗便秘[24]。而与OAB相关的因素如神经系统疾病、合并泌尿系解剖及器质性疾病、泌尿系感染、家族聚集及遗传倾向等因素可纳入继发性OAB范畴。
【推荐意见】POAB发病的影响因素较多,应注意甄别原发疾病。
POAB诊断主要依据临床症状。甄别不同类型的OAB首先需要进行尿常规、泌尿系超声等辅助检查,以确定是否存在常见的器质性病变。怀疑神经源性疾病需要进一步行尿动力学检查和必要的神经系统影像及功能学检查。尿动力学检查可判断是否存在DO和(或)DSD等,同步膀胱尿道测压可以了解是否存在URI。
POAB与成人OAB诊断基本一致,但排尿频率有其特殊性。正常儿童排尿次数较成人多[22],新生儿排尿频率为15~20次/d,而随着年龄的递增,排尿次数逐渐减少,到12岁时接近成人,接近4~6次/d[27]。因此,12岁以下的儿童尿频诊断标准不能按照成人的诊断标准(白天排尿>8次/d)判断。年龄≥12岁的儿童和成人OAB尿频诊断标准虽基本一致,但又有其特殊性。学龄期儿童尿频指白天排尿次数>10次/d[22]。OAB的主要诊断方法如下。
尿频和尿急是OAB临床表现特征,尿急是一种突然迫切需要排尿的体验,膀胱难以自主控制,有时会伴有急迫性尿失禁[3,11]。
诊断OAB详细询问病史很重要。重点了解排尿的时间、频率、次数、每次尿量及是否伴随急迫性尿失禁情况等。为避免出现描述的主观差异,可以通过记录排尿日记(voiding diary)协助诊断。部分儿童因年龄小或不能准确表达尿急紧迫感,可伴随哭闹、原地跺脚或转圈、夹腿、奔跑到卫生间等特征性表现[2,6]。
远程无线排尿日记监测系统也是一种较为便捷和相对客观的排尿日记记录方式,医生的电脑终端可实时监测并获取受检查者的排尿日记信息,患儿在家即可通过远程尿流计将数据传输到医生端,为制定治疗方案及疗效随访提供快速依据。
尿常规、泌尿系超声、骶椎前后位X线片、脊髓磁共振成像(MRI)等辅助检查可初步筛查UTI、结石、梗阻、脊柱裂等疾病。合并有夜间遗尿的患儿,建议行夜间“尿垫试验”。患儿的用药史及其对临床症状的影响有利于判断是否存在OAB。尤其需要关注是否使用抗胆碱药、镇静催眠药、利尿药、抗精神病药、肾上腺素能受体激动药、酒精、咖啡因和钙拮抗剂等[11]。
【推荐意见】POAB主要诊断依据为病史和尿急尿频症状。尿常规和泌尿系统超声应作为诊断常规检查。排尿日记可以提供客观依据。难治性/顽固性OAB应做腰骶部正位X线平片检查、MRI检查以排除神经源性因素。
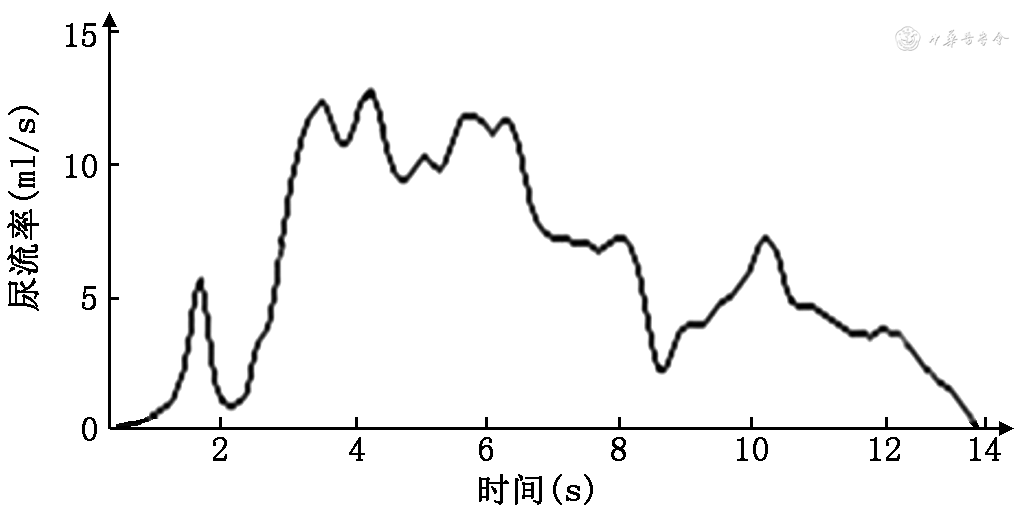
1. 自由尿流率(uroflowmetry,UFM)检测:UFM检测简单无创,类似日常如厕排尿过程,可以初步评估膀胱储尿和排尿功能。UFM可通过尿流曲线、最大尿流率、排尿量和排尿时间等参数初步判断是否可能存在DO和DSD。有研究显示,对OAB患儿进行UFM检测,发现其有效膀胱容量及最大尿流率均明显低于相应年龄段的健康儿童,但排尿后残余尿(post void residual,PVR)明显多于相应年龄段的健康儿童[12,22]。部分合并DSD的OAB患儿由于排尿过程中出现尿道括约肌失调(短暂痉挛)引起突然尿流中断或断奏排尿,即Staccato曲线[3],该曲线模式在整个排尿过程中是不规则和波动的,但流动是连续的,在排尿过程中尿流速度不会降至零(图2)。此外,要符合断奏标准,尿流率波动幅度应大于最大尿流率(maximum flow rate)的平方根[3]。OAB患儿在UFM检测中Staccato曲线发生率约为15%[12],有研究显示,30%的8~13岁正常排尿儿童存在该曲线,并且9%的儿童有PVR,因此Staccato曲线结合PVR测定更具有临床指导意义[28, 29]。实际上,UFM检测结合B超测定PVR已经成为临床初步筛查排尿功能障碍的标准检查。

此外,UFM联合盆底肌电图(EMG)检查可以进一步证实DSD的存在,可在排尿检测UFM的同时发现括约肌肌电图活动增强。Palmer等[29]对OAB患儿进行尿流率联合会阴部和腹部EMG以诊断括约肌功能失调;Combs等[30]通过EMG/UFM检测了解到内括约肌功能失调患者的EMG滞后时间超过4 s(EMG记录比尿流率记录延迟的时间),Franco[31]建议此类患儿行影像尿动力学检查,以确定是否存在内括约肌功能障碍,如有,则治疗时考虑加用α受体阻滞剂或解痉药物。
2. 膀胱压力容积(cystometrogram,CMG)和压力-流率测定(pressure/flow study,PFS):当UFM及PVR测定无法满足尿急症状儿童的OAB诊断,可考虑行CMG/PFS。PFS指记录膀胱压力的同时进行尿流率测定。可用于评价膀胱贮尿功能、充盈期逼尿肌的稳定性及排尿期逼尿肌收缩功能等。OAB患儿临床表现的症状多为储尿期症状,因此,检测膀胱充盈期的压力-容量变化可了解膀胱逼尿肌的功能变化和临床症状之间的关系。患儿在充盈期出现DO(图3),此时表现出尿急症状,排尿期常发现最大尿流率偏低以及尿量偏少,多数出现PVR增多。但并不是所有OAB患儿均由DO引起,也可存在其他引起儿童尿急症状的因素[32, 33]。
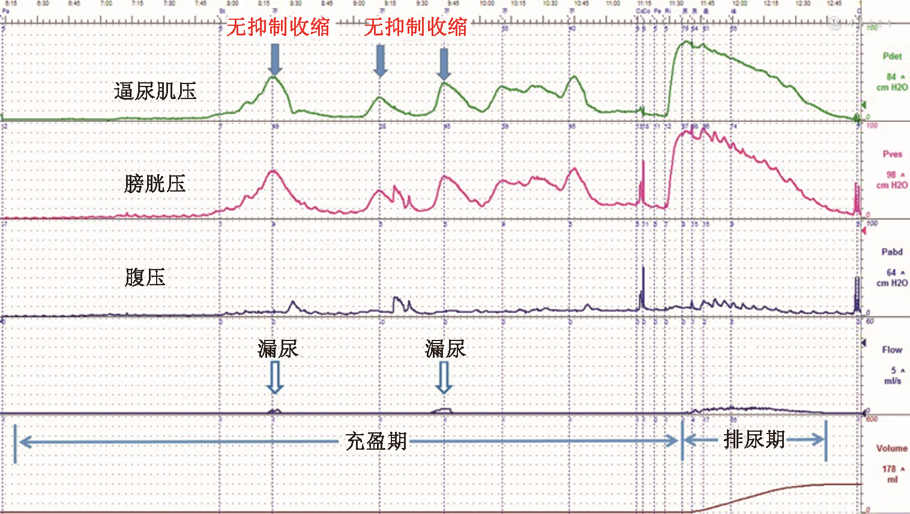

注:横坐标为时间,从上至下纵坐标分别为逼尿肌压力、膀胱压力、腹压、尿流率和排出尿量;右侧数据为测定期间相应的参数的最高值;由图可见膀胱充盈期逼尿肌无抑制收缩波
3. 影像尿动力学检查(video urodynamics,VUDS):VUDS是指用造影剂做充盈介质充盈膀胱,在X线监视下进行CMG/PFS,可在充盈期及排尿期实时观察膀胱尿道形态、膀胱颈口位置及有无膀胱输尿管反流(vesicoureteral reflux,VUR)等。对于难治性/顽固性OAB的患儿,建议直接行VUDS检查以在功能性及形态学角度评估膀胱及尿道在充盈期和排尿期的状态。由于VUDS的实用性较强,尤其能鉴别OAB合并PVR增加的患儿是否和DSD相关,图像直观反映膀胱尿道功能状态(图4)[34]。
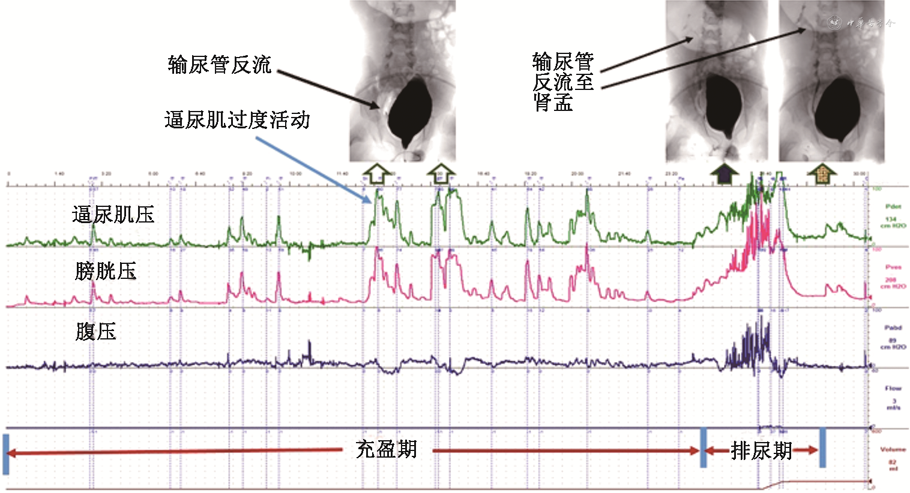

注:横坐标为时间,从上至下纵坐标分别为逼尿肌压力、膀胱压力、腹压、尿流率和排出尿量;右侧数据为测定期间相应的参数的最高值;由图可见膀胱充盈期逼尿肌过度活动,右侧膀胱输尿管反流,排尿期反流至肾盂,尿道不能完全开放,排尿困难,残余尿增多
4. 同步膀胱尿道测压
OAB除了与逼尿肌功能异常有关外,也可由URI引起。检查URI的方法有括约肌肌电图(EMG)和同步膀胱尿道压力测定。EMG易受环境因素的干扰,且表面电极记录的是整个盆底肌肉的活动,不能精准定位,针状电极有创且部分儿童难以忍受疼痛。同步膀胱尿道测压可直接记录尿道压力,能更好地反映尿道压力在膀胱充盈期漏尿的压力变化和确定尿道的功能。正常情况下,随着膀胱充盈尿道压逐步升高,排尿期尿道压降低,但OAB的儿童可在膀胱充盈期出现尿道压的突然降低(即URI),而发生尿失禁。同步膀胱尿道测压能记录这个变化。最新研究发现,79例OAB患者中,URI占54.4%[35]。Kummeling等[36]对URI与OAB进行研究发现,URI的发生率为 2%~95%,表明OAB除了与DO有关外,也可由URI引起。同步膀胱尿道测压能够提高URI诊断率[21]。
5. 动态尿动力学检查(ambulatory urodynamics monitoring,AUM):AUM是指尿液自然充盈膀胱的条件下,通过记录患者日常生活中多个排尿周期的膀胱压力变化来了解膀胱功能[37]。有研究报道,对32例怀疑OAB但CMG结果未见典型异常的患者行AUM,其中16例监测到了DO[38]。因此,对于在CMG监测期间没有发现但仍怀疑DO的患者,可以通过AUM进行诊断。
【推荐意见】对所有怀疑POAB的患儿均需进行UFM和超声PVR测定。顽固性OAB建议做CMG/PFS或VUDS以甄别是否存在膀胱输尿管反流和DSD。疑难病例推荐AUM。怀疑URI者需做同步膀胱尿道测压。
(四)膀胱壁厚度及容量的超声检查:膀胱容量和膀胱壁厚度指数(bladder volume and wall thickness index,BVWI)已经用于评估膀胱逼尿肌不稳定。Sreedhar等[39]用5 MHz探头的高分辨率超声测量在儿童出现尿急而无法继续充盈时的膀胱纵向长径、最大横向短轴直径、最大横向长轴直径,三者的乘积再乘以系数0.523,即为最大预期膀胱容量。接着通过将探头在横切面旋转90°,测量纵向长径、横向长径和前后径,此时三者的乘积即为膀胱容量指数(bladder volumn index,BVI)。此时的膀胱前壁、后壁和侧壁厚度的平均值作为膀胱壁厚度(bladder thickness,BT),BVI除以BT得出BVWI。BVWI(初始尿急感时)<70%的BVWI(达预期膀胱容量时)的患儿约96%在行膀胱测压中发现充盈期逼尿肌不稳定收缩。据报道,部分隐性脊柱裂儿童合并长期逼尿肌过度活动,可因逼尿肌高压或长期过度收缩引起膀胱顺应性降低及膀胱壁增厚。正常儿童膀胱充盈状态下膀胱壁平均厚度为1.55 mm,排尿后膀胱壁平均厚度为2.76 mm,膀胱壁厚度上限分别为3 mm和5 mm,其中充盈状态下膀胱壁厚度>3 mm提示此类患儿上尿路损害的可能性增加[40, 41]。
【推荐意见】诊断POAB前常规超声检查膀胱形态和PVR并测量膀胱壁厚度。
根据ICCS[3]、ICS[5]和AUA[6]制定的OAB指南,POAB经典治疗模式为先进行排尿基础训练和行为治疗(urotherapy),无效者选择行为联合药物治疗(二线治疗),对于上述治疗仍无效者可考虑联合用药。对于药物治疗无效的顽固性OAB,可酌情考虑膀胱壁注射肉毒素、骶神经电刺激和经皮胫神经电刺激(percutaneous tibial nerve stimulation,PTNS)等,膀胱扩大成形及尿液分流手术应作为上述方案都难以奏效且明显影响生活质量及预后时的选择[13]。
行为治疗是OAB一线治疗方式的首选,包括调整生活方式、膀胱训练、盆底肌训练(Kegel运动)、生物反馈治疗(biofeedback treatment,BioT)及盆底肌电刺激等。(1)调整生活方式:如调节饮食、减少咖啡、碳酸饮料摄入过多和避免肥胖。(2)膀胱训练:包括调节排尿时间点及饮食饮水习惯,延长排尿间隔和增加储尿量,记录排尿日记等。延长排尿间隔的具体方法为有尿意时让患儿尝试憋尿,比平时排尿延迟5~10 min,根据承受能力逐渐过渡到2 h左右排尿1次,每次排尿量在最大预期膀胱容量的1/2以上。(3)盆底肌训练及BioT:早在30年前就观察到通过刺激盆底肌肉可以治疗女性OAB,BioT儿童OAB直到2000年才有介绍,由于BioT需一定的配合度,3岁及以下的低龄儿童对于BioT的选择受到限制[42]。Franco[31]建议5岁以上且无明显学习障碍、行为异常或其他精神和神经方面异常的患儿采用BioT方案。BioT联合经直肠电极电刺激治疗亦可增加疗效,对于5岁以下难以自主配合BioT的儿童也可考虑盆底肌电刺激治疗并控制电刺激的强度。(4)治疗便秘:对于慢性便秘的儿童,当直肠容量扩大到120 ml后才有排便感,而正常儿童在20 ml时就会有急迫的排便感。对于存在BBD的儿童,排尿和排便功能互相影响,且治疗便秘可以改善排尿。有研究表明,治疗便秘缓解1年后,可有80%的BBD儿童白天尿失禁病情缓解,63%的BBD儿童夜间遗尿病情缓解[24,31]。
【推荐意见】婴幼儿或年幼儿童原发性OAB治疗首选行为治疗。
治疗POAB的一线药物主要为抗毒蕈碱(M受体),而β3受体激动剂和α受体阻滞剂等作为备选。
1. M受体阻滞剂:因逼尿肌的收缩通过激动胆碱能M2和M3受体介导,因此,抗毒蕈碱M药物被广泛应用于治疗OAB。常见的药物有:(1)奥昔布宁(oxybutynin):具有较强的抗M胆碱能作用,可解除平滑肌痉挛,也起局麻镇痛作用。口服后可作用于膀胱逼尿肌,降低膀胱内压,推荐起始剂量为5 mg/d,并根据疗效及不良反应情况增加药物剂量,最大剂量一般不超过20 mg/d。在美国该药广泛用于治疗OAB,并取得较好的疗效。但该药M受体亚型选择性偏低,口服时不良反应可表现为口干、嗜睡、视物模糊、便秘等,5岁以下儿童不推荐首选。(2)托特罗定(tolterodine):是针对OAB治疗的经典药物,其效果较好,不良反应较奥昔布宁小。但目前国内关于儿童使用托特罗定治疗OAB的用药经验仅为散发报道,其儿童用药安全性还需要大量数据的证实[43, 44]。托特罗定片(2 mg/片)一般是以1~2 mg/d为起始剂量,一般不超过4 mg/d。而托特罗定缓释片作用更稳定。(3)消旋山莨菪碱(654-2):为生物提取类M受体阻滞剂,曾用于胃肠道及输尿管解痉治疗腹痛及泌尿系结石绞痛的治疗,为抗胆碱能类药物,作用类似阿托品,也可作为儿童OAB的治疗。儿童可每次服用按0.1~0.2 mg/kg,每日1~3次。(4)索利那辛(solifenacin):作为高选择性M3受体阻滞剂,不良反应少。在国外已广泛应用于儿童,有国内学者开始小剂量用于POAB的治疗。该药物说明书不推荐儿童使用,儿童用药的长期安全性目前仍缺乏足够的循证医学依据[45]。
2. β3受体激动剂:米拉贝隆(mirabegron)用于治疗OAB的选择性β3肾上腺素能受体激动剂。米拉贝隆在国内外已广泛应用于成人OAB且不良反应小于M受体阻滞剂[46, 47]。和M受体阻滞剂联合用药治疗POAB。和索利那辛类似,药物说明书不推荐儿童使用。其安全性及疗效已被国外报道证实[48, 49]。
3. α受体阻滞剂:Donohoe等[46]研究发现,在BioT失败后,α受体阻滞剂治疗POAB效果良好。26名平均年龄12.8岁的顽固性OAB患儿服用α受体阻滞剂后症状均得到不同程度的改善,其UFM从治疗前的5.5~12.6 ml/s升高到10.3~19.7 ml/s,PVR减少,而排尿后EMG滞后时间也减小。国外研究使用的药物为坦索罗辛(tamsulosin),因成人常规剂量为0.2 mg/d,但目前没有专门为儿童设计的小剂量片剂或胶囊,可考虑酌情减量。或另一种α受体阻滞剂为特拉唑嗪(terazosin),常规使用剂量为每日0.2 mg/kg,最大不超过每日0.4 mg/kg。α受体阻滞剂常见的药物不良反应可能为低血压、晕厥以及嗜睡等[47]。但由于其停药后易复发,α受体阻滞剂联合M受体阻滞剂治疗POAB是否能增加疗效有待进一步研究,国内关于儿童口服坦索罗辛或特拉唑嗪的安全性尚未报道。
4. 联合用药:Bolduc等[50]发现口服奥昔布宁(oxybutynin)5~20 mg/d或托特罗定2~4 mg/d联合小剂量索利那辛(5~10 mg/d)治疗儿童顽固性OAB有良好的效果,比单纯增加奥昔布宁剂量疗效确切,可能与索利那新的M受体高选择性有关。应该注意的是,患儿用药剂量应该从小剂量开始,根据病情逐步增加。
【推荐意见】治疗POAB的M受体阻滞剂首选奥昔布宁或消旋山莨菪碱,12岁以上儿童可以酌情联合应用α受体阻滞剂(如坦索罗辛)。
A型肉毒素的作用机制是通过抑制钙依赖的乙酰胆碱释放,从而导致肌肉无力甚至萎缩。在临床上这种化学去神经作用的效果会在5~7 d内表现出来并持续3~6个月。Frohme等[51]的研究显示,注射肉毒素A治疗不仅具有很好的改善尿急和膀胱憋尿后疼痛的效果,而且对患儿生活质量的改善起到了积极的作用,治疗6个月后,患儿对生活质量的满意度达到83%。一般对于难治性OAB且严重影响生活质量或合并上尿路损害的患儿才考虑选择使用A型肉毒素注射的治疗方案,并有可能承担PVR增加或尿潴留的风险[52]。
SNM是由神经起源调节骶神经反射通路以抑制膀胱神经反射,从而减少OAB症状,已被证明在缓解急迫性尿失禁、尿频、大便失禁和神经源性尿潴留是有效的。先经S3神经孔植入临时起搏器电极调试以确定其有效性,而后再置入永久电极和脉冲并连接一个手控开关,每5~10年更换一次电池。足够的证据支持SNM的使用对尿急尿频有效,而且对急迫性尿失禁也有治疗作用,目前尚无SNM造成的永久性损伤或长期神经损伤的报道。年龄较大的儿童神经源性膀胱引起的顽固性OAB可以考虑SNM[53, 54],但目前SNM用于儿童神经和非神经源性排尿功能障碍的成熟性目前还以散发报道为主,其疗效确切性仍存在个体差异,且其疗效及二次手术率可能与儿童生长发育及解剖生理的变化、电极是否移位、神经稳定性等因素有关。虽然美国食品药品监督管理局(FDA)目前仅批准成人使用SNM手术治疗相关疾病,但目前SNM用于改善儿童排尿排便问题已经得到多位专家证实[55, 56, 57]。临床实践中,患者多因昂贵的起搏器而拒绝该疗法。非神经源性膀胱所致的OAB原则上考虑行为和药物治疗为主,对于难治性OAB,可酌情选择。
PTNS最早于20世纪80年代出现,但直到2000年才用于临床治疗OAB,其确切的作用机制尚不清楚,但被认为是逆行骶神经丛的神经调节。这个神经丛起源于供应膀胱和盆底的神经,直接刺激胫骨后神经可改变骶神经丛功能并对OAB症状有改善作用。英国国立健康与临床优化研究所(NICE)推荐使用PTNS仅适用于保守治疗和药物治疗失败后,患者不希望接受治疗肉毒素和SNM者。应提前告知患者其疗效的有限性和不确切性[58]。
【推荐意见】对于行为和药物治疗无效的POAB患者,可以考虑SNM、PTNS或A型肉毒素膀胱壁注射。
对于严重的低顺应性膀胱、膀胱容量过小且危害上尿路功能,经其他治疗无效的OAB患儿可选择手术治疗。手术方法包括膀胱自体扩大术、肠道膀胱扩大成形术、尿流改道术以及逼尿肌横断术等。
综上,婴幼儿或年幼儿童原发性OAB治疗首选行为治疗(一线),无效者联合药物治疗(二线)。对于大龄儿童的难治性OAB,可考虑肉毒素注射或神经电刺激等治疗(三线),并严格控制好指征及密切随访。膀胱扩大术及尿流改道手术较少用,一般只针对膀胱容量过小者。POAB诊疗流程详见图5。
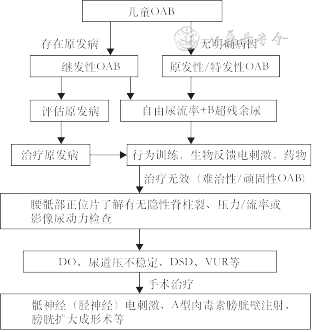

注:OAB为膀胱过度活动症,DO为逼尿肌过度活动,DSD为逼尿肌-括约肌协同失调,VUR为膀胱输尿管反流
POAB症候群较为常见,初步诊断可依据尿急、尿频等临床表现,通过尿常规、泌尿系超声、腰骶椎X光片或MRI等初步鉴别是原发性或继发性。继发性OAB需要同时治疗原发病。难治性OAB推荐进行尿动力学检查,根据膀胱功能的尿动力学分型制定相应治疗方案。
本共识仅代表参与编写及讨论专家的观点。共识内容仅用于指导临床医生实践,不具有法律约束性质。共识内容是该领域的阶段性认识,今后会根据新的临床证据随时更新。
共识执笔者:文建国、徐鹏超(郑州大学第一附属医院)
共识编写委员会名单(按专家所在单位汉语拼音排序):魏光辉、何大维(重庆医科大学附属儿童医院);毕允力(复旦大学儿科医院);徐迪(福建省立医院);夏慧敏(广州市妇女儿童医疗中心);赵夭望(湖南省儿童医院);李宁(华中科技大学同济医学院附属同济医院);张潍平、田军(首都医科大学附属北京儿童医院);吴荣德(山东省立医院);黄鲁刚(四川大学华西临床医学院/华西医院);陈方(上海交通大学附属第六人民医院/上海东方泌尿修复重建研究所);李守林、陈进军(深圳市儿童医院);张敬悌(西安市儿童医院);宋翠萍(新乡医学院第一附属医院);唐达星(浙江大学医学院附属儿童医院);王庆伟、文建军、王焱、范应中、徐鹏超、文建国(郑州大学第一附属医院);杨艳芳(郑州大学附属儿童医院);杨屹(中国医科大学附属盛京医院)
所有作者均声明不存在利益冲突



























