
了解国产磁共振引导激光间质热疗(MRgLITT)治疗药物难治性癫痫的安全性及短期有效性。
前瞻性纳入首都医科大学宣武医院神经外科2020年10月至2021年4月使用国产MRgLITT系统治疗的药物难治性癫痫患者22例。术后即刻评估毁损容积比,记录围手术期并发症并随访,临床疗效评估采用Engel分级标准以评估该治疗的安全性和短期有效性。
22例患者,其中男12例,女10例,年龄3~45(24±13)岁。癫痫类型包括:内侧颞叶癫痫(MTLE)5例,下丘脑错构瘤(HH)3例,局灶皮质发育不良(FCD)7例,其他类型 7例。手术时间101~308(173±49)min,手术出血1~5(3.7±1.6)ml,手术后3~10(5.5±1.8)d出院,平均毁损容积比为92.6%。其中仅2例患者(顶叶FCD)术后出现一过性对侧肢体无力,未出现症状性颅内出血、脑梗死等严重并发症。随访时间为14~168 d。Engel分级Ⅰ级者13例(59.1%),Ⅱ级者2例(9.1%),Ⅲ级者2例(9.1%),Ⅳ级者5例(22.7%)。短期无发作率分别为MTLE 5/5和FCD 4/7。
国产MRgLITT系统治疗药物难治性癫痫微创、安全、可靠,对MTLE、FCD短期疗效更好。

磁共振引导激光间质热疗(MRgLITT)是通过立体定向设备,在颅内精准置入光纤,通过特殊波长能量激光的热效应,在磁共振实时扫描下(每7秒更新一帧热成像)可控的间质热疗毁损颅内病变的一种技术[1]。美国食品药品监督局(FDA)在2007年就批准了激光间质热疗(LITT)的使用[2],主要应用于药物难治性癫痫、脑肿瘤等颅脑疾病的微创外科治疗[3],疗效和安全性都经过了大量的临床病例的验证。荟萃分析认为,对于一些类型的药物难治性癫痫,如海马硬化引起的内侧型颞叶癫痫(MTLE)、下丘脑错构瘤(HH)引起的痴笑型癫痫、低级别胶质瘤引起的局灶性癫痫等,LITT的疗效可以媲美或超过开颅手术,几乎没有正常皮质和脑组织的损伤,并且无需开颅,更加微创[4, 5]。但一直以来,该技术被少数国家所垄断,并没有在国内开展。近年来随着我国医学激光基础材料科学的不断进步,我国也完成LITT系统的研发和整合,并匹配了3 s成像的磁共振热成像技术,在首都医科大学宣武医院完成药物难治性癫痫MRgLITT治疗22例。现将国产MRgLITT系统的使用流程、安全性和初步有效性报道如下。
本研究为前瞻性系列病例分析。前瞻性纳入2020年10月至2021年4月在首都医科大学宣武医院接受国产MRgLITT[华科精准(北京)医疗科技有限公司,专利号CN 108836477 B]治疗的药物难治性癫痫患者的临床资料。
1.纳入标准:(1)年龄6个月至70周岁;(2)既往诊断为药物难治性癫痫,局灶性发作;(3)筛选前3个月平均癫痫发作频率≥2次/月;(4)致痫灶局限,适宜进行外科手术治疗。
2.排除标准:(1)MRI禁忌患者;(2)凝血功能严重障碍患者;(3)妊娠期或哺乳期妇女;(4)研究者判断,存在严重或不能控制的全身性疾病的证据。所有患者及家属均知情同意并签署知情同意书。本研究获得首都医科大学宣武医院医院伦理委员会批准(批准号:临械审[2020]007号-修正1)。
1.术前评估:患者均行长程视频脑电图监测,记录3~5次惯常发作,并行磁共振癫痫序列明确是否存在结构性病变,必要时行正电子发射型计算机断层显像(PET)、脑磁图(MEG)和神经心理评估。经神经外科、神经内科、影像科等多学科讨论后决定入组,确定手术方案。
2.手术计划制定:手术前需要根据手术方案设计光纤置入计划和预估间质热疗范围。需要扫描增强磁共振多平面重建(MPR),将影像数据导入工作站,并进行配准,融合后三维重建,选择靶点和路径规划。每个治疗靶点设计两条路径。
3.手术过程:治疗过程共分为两部分:机器人引导激光光纤套管置入和MRgLITT(图1)。(1)机器人引导激光光纤套管置入:患者局部麻醉置入颅骨Marker并进行CT薄扫后与磁共振图像配准,进行机器人导航注册。手术采取全身麻醉,使用磁共振兼容头架固定头部并连接手术床和立体定向机器人,导入手术计划后注册,消毒铺巾后钻孔、刺破硬脑膜并使用探针保证光纤套管通路顺畅。安装导向螺钉,最后按深度置入冷却套管并置入光纤并进行核磁扫描确定光纤位置后准备进行LITT。(2)MRgLITT:将冷却套管妥善连接,将磁共振基准序列配准,确定光纤位置满意后,将光纤轴向MRI作为基础勾画间质热疗区域和温度监控区域,在序列上勾画多个矩形区域作为温度计算中的参考区域。设定光纤发射模式,启动循环冷却水,确定光纤发射参数并启动,同时进行MRI实时温度监控,设定区域超过警戒温度会发出警报并停止。必要时可以回退光纤进行重复间质热疗,在全部间质热疗结束后,扫描增强核磁确定间质热疗范围。确认满意后移出激光光纤套管,缝合包扎。
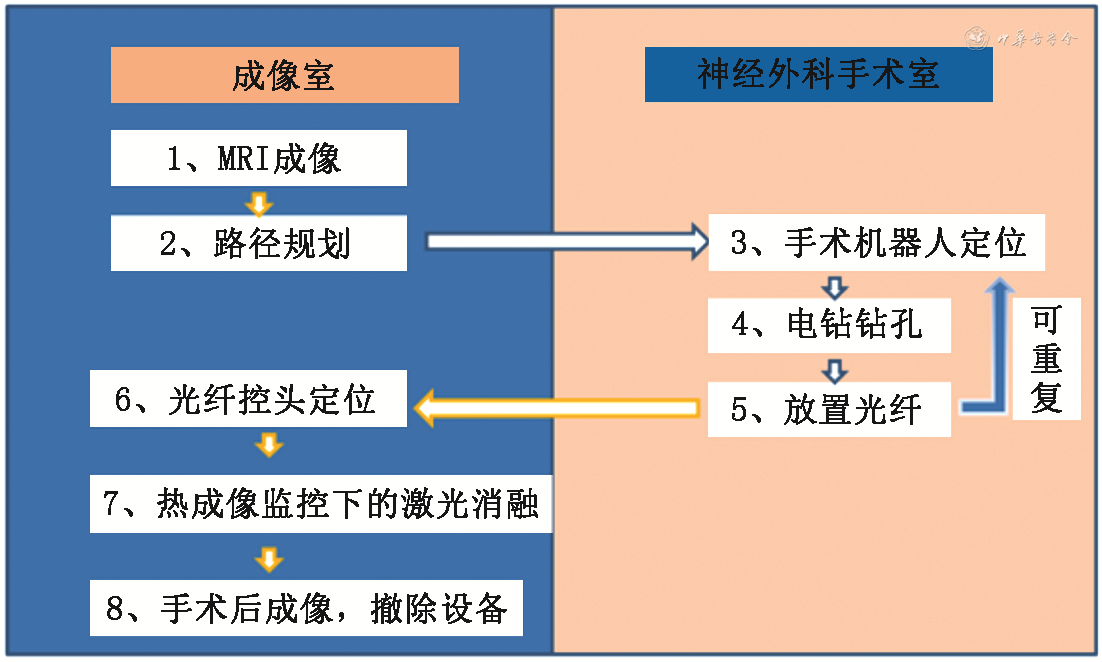

4.激光间质热疗比计算:术前由研究者在MRgLITT软件上进行间质热疗计划,拟定间质热疗范围,得到计划间质热疗组织体积;间质热疗后30 min内进行磁共振扫描,得到间质热疗后的影像。由非术者的研究者确定实际间质热疗区域,计算实际间质热疗范围与计划间质热疗范围交集部分的体积,进而得到间质热疗体积比。
5.治疗的安全性、短期有效性评估:记录手术时间、手术出血量、手术后住院天数和手术相关并发症发生情况。手术相关并发症包括:明确与治疗相关的死亡、昏迷、症状性脑出血、症状性脑梗死、其他神经功能缺损、脑膜炎、无症状颅内出血或脑梗死、脑脊液漏、感染、切口愈合不良。
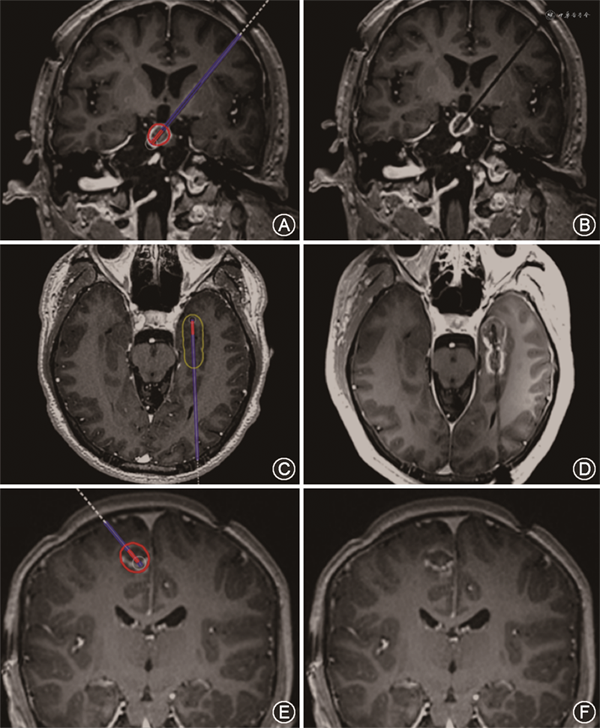
共纳入接受MRgLITT患者22例,男12例,女10例,年龄3~45岁(24±13岁)。包括局灶皮质发育不良(FCD)7例,MTLE 5例,HH 3例,低级别胶质瘤3例,灰质异位1例,结节性硬化1例,海绵状血管瘤1例,多灶性癫痫1例。22例患者共进行24靶点毁损,其中21例患者行致痫灶毁损,1例多灶起始患者行胼胝体离断。手术时间101~308(173±49)min,手术出血1~5(3.7±1.6)ml,手术后3~10(5.5±1.8)d出院。体积间质热疗比为87.3%~97.0%,平均92.6%。其中1例累及中央区患者进行了术中唤醒磁共振引导激光间质热疗,其余均为全身麻醉下操作。不同癫痫类型患者术后即刻增强磁共振显示的毁损范围与计划的毁损范围相比基本相同(图2)。

22例患者随访14~168 d,Engel分级Ⅰ级者13例(59.1%),Ⅱ级者2例(9.1%),Ⅲ级者2例(9.1%),Ⅳ级者5例(22.7%)。按不同病种计算短期无发作率:FCD 4/7,MTLE 5/5,HH 1/3,低级别胶质瘤1/3,其余病种分别为灰质异位1例无发作,海绵状血管瘤1例无发作,结节性硬化1例改善不明显,多灶性癫痫1例发作不明显。其中治愈性手术为21例,短期无发作率为61.9%。
无患者在围手术期或随访期间死亡或昏迷。术后2例功能区FCD患者出现短暂对侧肢体力弱,均在1周内基本恢复。无患者出现严重或永久性并发症。
LITT是一种利用激光热间质热疗靶组织的技术,其靶点精准,间质热疗过程中出血控制好,很早就应用于全身多个脏器,如肺、肝、前列腺等脏器的外科治疗中[1,6]。Jolesz等[7]首次报道了MR引导的颅内肿瘤激光热疗,但还无法做到实时监控温度变化和范围。近30年来,基于立体定向技术的进步,术者可以将激光发生器置入脑内任何部位,并在磁共振环境下进行激光热间质热疗,用以监测温度和间质热疗的范围[8]。目前国际上常用的MRgLITT有两种系统,分别使用波长为1 064 nm和980 nm的激光,脑组织穿透范围在2~10 mm[9]。但两种系统都没有引入国内。华科公司自主研发的磁共振引导下的激光间质热疗治疗系统目前为国内首个MRgLITT的治疗体系,并且与磁共振手术间很好地相结合,其操作流程简便,间质热疗可控性强,温度反馈及时到位。这22例临床病例的开展,标志着MRgLITT系统已经正式国产化运行,包括立体定向机器人、激光间质热疗系统和磁共振序列等均可在一家医院内独立的完成。
在美国等西方国家,近年来MRgLITT应用呈快速进展态势,其中药物难治性癫痫为其一大主要的适应证[1]。但不同类型的药物难治性癫痫的治疗效果有明显的差异。近年的荟萃分析指出,LITT治疗颞叶癫痫的无发作率为59%,伴有海马硬化者可达66%[3]。另一篇荟萃分析也指出,LITT治疗颞叶癫痫的无发作率为59%,优于SEEG引导的射频毁损治疗[4]。在HH方面,目前国际上最大宗研究报道了71例患儿,其中93%的患儿在1年随访期无发作,23%的患者接受了二次LITT手术[10]。其他类型致痫灶,如FCD、结节性硬化、灰质异位、海绵状血管瘤等国际上亦无大宗样本报道。本中心使用国产MRgLITT系统治疗的不同类型癫痫患者治愈率和国际大宗样本报道有一定的差异性:颞叶癫痫入组病例均有明显单侧海马硬化,且随访时间较短,因此无发作率远高于长时间随访的大宗样本。HH共纳入3例,均为曾经接受开颅手术或射频毁损治疗的患者;另外2例为SEEG射频热凝毁损术后患者,激光间质热疗治疗后随访分别为Engel Ⅲ级和Engel Ⅳ级,考虑癫痫控制不佳可能和瘤体较大、致痫网络复杂性相关。2例功能区FCD在毁损后出现了一过性对侧肢体肌力下降,在1周内基本恢复正常,考虑和致痫灶间质热疗导致水肿有关。其他类型患者数量暂时相对较少,不足以说明治疗的效果。但只要术前评估认为致痫灶局限,且致痫网络相对简单的患者,在本病例队列中如FCD、海绵状血管瘤、灰质异位等,均有不错的疗效。
本研究22例患者均未出现严重并发症,仅2例功能区患者出现一过性对侧肢体力弱,可见国产MRgLITT系统具备了临床使用的安全性和可靠性。且根据术前计划和术后即刻复查影像计算后,平均92.6%的间质热疗比例也和国际上常用的两种MRgLITT系统基本保持一致[11]。在保证LITT工作的同时,磁共振系统的优化使得国产系统能够达到3 s的温度序列刷新频率,超过了国际上的7 s刷新频率[12, 13],因此也使得间质热疗过程的控制更加及时和可靠。但目前国产MRgLITT激光探头仅有一种散射头,理论上更适用于类圆柱形的致痫灶的间质热疗,对一些形态不规则的致痫灶可能需要继续研发能适形间质热疗的激光探头[14, 15]。另外,本研究着重了解国产MRgLITT系统的操作性、稳定性与安全性,因此随访时间较短,其长期有效性有待进一步研究。
综上所述,国产磁共振引导激光间质热疗系统操作便捷,可靠性高,治疗微创,围手术期安全性好。对各种类型药物难治性癫痫的疗效则需要进一步临床研究证实。
所有作者均声明不存在利益冲突



























