
分析糖尿病肾病(DKD)患者高钾血症的发生率及相关因素。
选取2012年1月至2020年12月郑州大学第一附属医院肾脏病中心就诊的DKD患者,收集患者的临床资料,分析DKD患者高钾血症的发生率以及在不同年龄、性别和不同慢性肾脏病(CKD)分期患者中的发生情况,并进一步分析高钾血症发生的相关因素。
共纳入临床资料完整、符合标准的DKD患者1 721例,其中男1 117例(64.9%),年龄(56±12)岁;女604例(35.1%),年龄(59±12)岁。血钾水平为(4.93±0.77)mmol/L,其中男性和女性血钾水平分别为(4.92±0.77)mmol/L和(4.93±0.76)mmol/L,差异无统计学意义(P=0.752);以CKD分期进行分组,CKD 1~5期患者的血钾水平分别为(4.58±0.52)、(4.65±0.47)、(4.86±0.59)、(5.21±0.79)、(5.61±0.88)mmol/L,组间比较差异有统计学意义(F=170.701,P<0.001)。高钾血症的总体发生率为37.0%(636/1 721),其中轻、中、重度高钾血症的发生率分别为17.4%,10.5%和9.1%,不同性别高钾血症发生率差异无统计学意义(男性36.8%比女性37.3%,χ²=0.035,P=0.851);CKD 1~5期高钾血症发生率分别为16.3%、21.2%、37.6%、55.2%、72.5%,发生率随CKD严重程度升高而升高(χ²=365.721,P<0.001)。多因素logistic回归结果显示,估算肾小球滤过率(OR=0.975,95%CI:0.972~0.979)、舒张压(OR=0.985,95%CI:0.975~0.994)、血钠(OR=0.972,95%CI:0.945~1.000)是DKD患者高钾血症的独立相关因素。
DKD患者高钾血症发生率为37.0%,发生率随肾功能恶化逐渐升高,估算肾小球滤过率、舒张压、血钠是其独立相关因素。

糖尿病是全球关注的重大非传染性慢性疾病(慢病),预计到2040年,全球将有6.42亿糖尿病患者[1]。我国是糖尿病患病率上升最显著的国家之一,患病率超过11%[2],因此,国家将糖尿病列入健康中国行动计划防控的重大慢病之一。糖尿病肾病(DKD)是糖尿病最常见的微血管并发症,30%~40%的糖尿病患者会发展为DKD[3],已经成为我国慢性肾脏病(chronic kidney disease,CKD)的首要病因。电解质、酸碱平衡紊乱是CKD的常见并发症,其中高钾血症因其发生率高、危险性大而备受关注。轻度高钾血症可引起肌无力、心律不齐等,严重的高钾血症可导致心律失常、心脏骤停甚至猝死[4, 5]。国外一项流行病学研究显示,在CKD患者中高钾血症的发生率高达14%~20%[6],我国最近的一项流行病学研究发现,在合并CKD的门诊患者中,高钾血症发生率达22.89%,显著高于一般人群水平[7]。DKD是CKD疾病谱最重要的组成部分,但其高钾血症发生情况目前尚未见相关报道,基于此背景,本研究以DKD患者为研究对象,观察高钾血症在DKD患者中的发生率,并进一步分析其相关因素,为DKD高钾血症的防治提供思路,降低高钾血症发生风险和因此而导致的突发生命意外。
横断面研究。收集2012年1月至2020年12月在郑州大学第一附属医院门诊或住院治疗的DKD患者临床资料。纳入标准:(1)年龄≥18岁;(2)临床诊断为DKD;(3)多次就诊的患者选取确诊为DKD后第1次检查的临床数据。排除标准:(1)相关临床数据缺失;(2)患有肾上腺功能减退、代谢性酸中毒或口服补钾药物等已知有除CKD外高钾血症的其他影响因素。初步筛选1 965例,按照纳入排除标准,最终共收集到1 721例患者资料纳入分析,其中男1 117例(64.9%),女604例(35.1%)。本研究通过郑州大学第一附属医院伦理委员会批准(伦理审查编号:2019-KY-015)。
通过电子病历系统收集患者资料:(1)一般信息:年龄、性别、病史、收缩压、舒张压、治疗状况;(2)辅助检查:双肾及双肾血管彩超、肾脏CT、肾脏穿刺病理等;(3)实验室检验:尿素氮、血肌酐、血尿酸、血浆总蛋白(TP)、血浆白蛋白(ALB)、估算肾小球滤过率(eGFR)、随机尿白蛋白/肌酐比值(UACR)、空腹血糖(GLU)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、电解质等。
1. DKD诊断标准:(1)根据《糖尿病肾脏疾病临床诊疗中国指南》[8],UACR≥30 mg/g或尿白蛋白排泄率(UAER)≥30 mg/24 h,且在3~6个月内重复检查UACR或UAER,3次中有2次达到或超过临界值;eGFR<60 ml·min⁻¹·(1.73 m2)⁻1持续3个月以上;排除急性肾损伤、高血压肾损害、自身免疫性疾病以及肾小球源性血尿等。(2)肾活检符合DKD病理改变。
2. 高钾血症诊断标准:根据《中国慢性肾脏病患者血钾管理实践专家共识》[9],血钾>5.0 mmol/L即可诊断高钾血症,根据《慢性肾脏病高钾血症风险评估及管理专家建议(2020版)》[10],血钾5.0~5.5 mmol/L为轻度高钾血症,血钾>5.5~6.0 mmol/L为中度高钾血症,血钾>6.0 mmol/L为重度高钾血症。3.5~<5.0 mmol/L为血钾正常水平。
3. CKD分期标准:根据2013年改善全球肾脏病预后组织(KDIGO)指南进行CKD分期,CKD 1~5期eGFR分别为>90、60~89、30~59、15~29、<15 ml·min⁻¹·(1.73 m2)⁻¹。
应用SPSS 26.0统计学软件进行统计分析。连续变量做正态性检验后,正态分布或近似正态分布的计量资料用表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析;非正态分布的计量资料用M(Q1,Q3)表示,两组间比较采用Mann-Whitney U检验;分类变量用频数(百分比)表示,组间比较采用χ²检验,有序分类变量组间比较采用趋势χ²检验;高钾血症影响因素分析采用单因素和多因素logistic回归分析。均为双侧检验,检验水准α=0.05。
共纳入1 721例DKD患者,其中男1 117例(64.9%),年龄(56±12)岁;女604例(35.1%),年龄(59±12)岁。男性患者舒张压、eGFR、ALB、血肌酐、血尿酸、尿素氮水平均高于女性,而年龄、TG水平均低于女性(均P<0.05)(表1)。
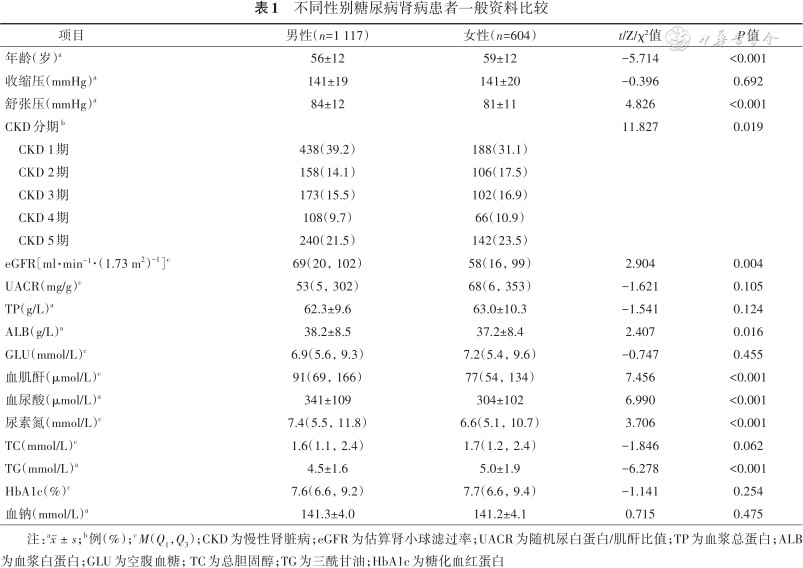
不同性别糖尿病肾病患者一般资料比较
不同性别糖尿病肾病患者一般资料比较
| 项目 | 男性(n=1 117) | 女性(n=604) | t/Z/χ²值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 56±12 | 59±12 | -5.714 | <0.001 |
| 收缩压(mmHg)a | 141±19 | 141±20 | -0.396 | 0.692 |
| 舒张压(mmHg)a | 84±12 | 81±11 | 4.826 | <0.001 |
| CKD分期b | 11.827 | 0.019 | ||
CKD 1期 | 438(39.2) | 188(31.1) | ||
CKD 2期 | 158(14.1) | 106(17.5) | ||
CKD 3期 | 173(15.5) | 102(16.9) | ||
CKD 4期 | 108(9.7) | 66(10.9) | ||
CKD 5期 | 240(21.5) | 142(23.5) | ||
| eGFR[ml·min⁻¹·(1.73 m2)-1]c | 69(20,102) | 58(16,99) | 2.904 | 0.004 |
| UACR(mg/g)c | 53(5,302) | 68(6,353) | -1.621 | 0.105 |
| TP(g/L)a | 62.3±9.6 | 63.0±10.3 | -1.541 | 0.124 |
| ALB(g/L)a | 38.2±8.5 | 37.2±8.4 | 2.407 | 0.016 |
| GLU(mmol/L)c | 6.9(5.6,9.3) | 7.2(5.4,9.6) | -0.747 | 0.455 |
| 血肌酐(μmol/L)c | 91(69,166) | 77(54,134) | 7.456 | <0.001 |
| 血尿酸(μmol/L)a | 341±109 | 304±102 | 6.990 | <0.001 |
| 尿素氮(mmol/L)c | 7.4(5.5,11.8) | 6.6(5.1,10.7) | 3.706 | <0.001 |
| TC(mmol/L)c | 1.6(1.1,2.4) | 1.7(1.2,2.4) | -1.846 | 0.062 |
| TG(mmol/L)a | 4.5±1.6 | 5.0±1.9 | -6.278 | <0.001 |
| HbA1c(%)c | 7.6(6.6,9.2) | 7.7(6.6,9.4) | -1.141 | 0.254 |
| 血钠(mmol/L)a | 141.3±4.0 | 141.2±4.1 | 0.715 | 0.475 |
注:a;b例(%);cM(Q1,Q3);CKD为慢性肾脏病;eGFR为估算肾小球滤过率;UACR为随机尿白蛋白/肌酐比值;TP为血浆总蛋白;ALB为血浆白蛋白;GLU为空腹血糖;TC为总胆固醇;TG为三酰甘油;HbA1c为糖化血红蛋白
本研究人群血钾水平为(4.93±0.77)mmol/L,其中男性和女性血钾水平分别为(4.92±0.77)mmol/L、(4.93±0.76)mmol/L,差异无统计学意义(P=0.752)。按照年龄进行分组,不同年龄、不同性别的DKD患者血钾水平见图1。进一步以CKD分期进行分组,随着CKD分期的加重,患者平均血钾水平逐渐升高,CKD 1~5期患者的血钾水平分别为(4.58±0.52)、(4.65±0.47)、(4.86±0.59)、(5.21±0.79)、(5.61±0.88)mmol/L,组间比较差异有统计学意义(F=170.701,P<0.001)。

本研究中共有636例患者血钾>5.0 mmol/L,高钾血症的总体发生率为37.0%。其中,男性DKD患者中,高钾血症411例,发生率为36.8%;女性中高钾血症225例,发生率为37.3%,不同性别高钾血症发生率差异无统计学意义(χ²=0.035,P=0.851)。按照年龄分层,18~45岁、45~69岁、>69岁DKD患者高钾血症的发生率分别为35.7%、36.2%和37.0%,差异无统计学意义(χ²=2.081,P=0.149)。进一步按慢性肾脏病分期,CKD 1~5期高钾血症发生率分别为16.3%、21.2%、37.6%、55.2%、72.5%,高钾血症发生率随CKD严重程度升高而升高(χ²=365.721,P<0.001)。轻、中、重度高钾血症的发生率分别为17.4%,10.5%和9.1%。不同性别、年龄高钾血症严重程度差异无统计学意义(均P>0.05)。但在不同CKD分期中,高钾血症严重程度分布不同,中、重度高钾血症发生率随肾功能恶化而升高(χ²=127.631,P<0.001)(表2)。
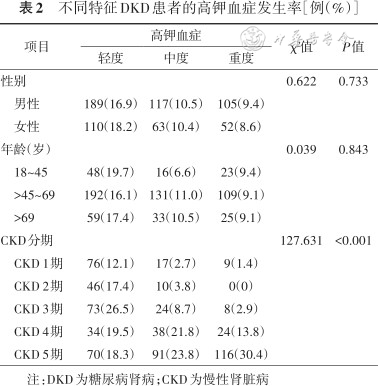
不同特征DKD患者的高钾血症发生率[例(%)]
不同特征DKD患者的高钾血症发生率[例(%)]
| 项目 | 高钾血症 | χ²值 | P值 | ||
|---|---|---|---|---|---|
| 轻度 | 中度 | 重度 | |||
| 性别 | 0.622 | 0.733 | |||
男性 | 189(16.9) | 117(10.5) | 105(9.4) | ||
女性 | 110(18.2) | 63(10.4) | 52(8.6) | ||
| 年龄(岁) | 0.039 | 0.843 | |||
18~45 | 48(19.7) | 16(6.6) | 23(9.4) | ||
>45~69 | 192(16.1) | 131(11.0) | 109(9.1) | ||
>69 | 59(17.4) | 33(10.5) | 25(9.1) | ||
| CKD分期 | 127.631 | <0.001 | |||
CKD 1期 | 76(12.1) | 17(2.7) | 9(1.4) | ||
CKD 2期 | 46(17.4) | 10(3.8) | 0(0) | ||
CKD 3期 | 73(26.5) | 24(8.7) | 8(2.9) | ||
CKD 4期 | 34(19.5) | 38(21.8) | 24(13.8) | ||
CKD 5期 | 70(18.3) | 91(23.8) | 116(30.4) | ||
注:DKD为糖尿病肾病;CKD为慢性肾脏病
为进一步探索DKD患者高钾血症发生的影响因素,把相关变量年龄、性别、收缩压、舒张压、GLU、血尿酸、TP、ALB、TC、TG、UACR、eGFR、HbA1c、血钠纳入单因素logistic回归分析,结果显示舒张压、GLU、血尿酸、TP、ALB、TC、UACR、eGFR、HbA1c、血钠与高钾血症的发生相关(均P<0.05)。为排除混杂因素的干扰,进一步进行多因素logistic回归分析,结果显示舒张压、eGFR、血钠与高钾血症的发生独立相关,舒张压、eGFR、血钠越低,高钾血症的发生风险越高,OR值(95%CI)分别为0.985(0.975~0.994)、0.975(0.972~0.979)和0.972(0.945~1.000)(表3)。
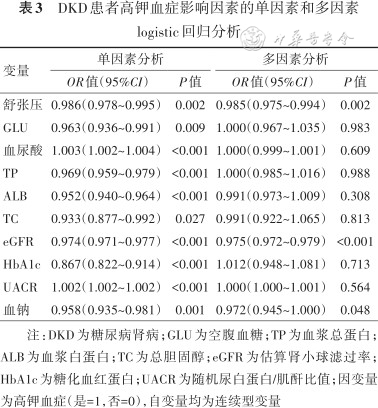
DKD患者高钾血症影响因素的单因素和多因素logistic回归分析
DKD患者高钾血症影响因素的单因素和多因素logistic回归分析
| 变量 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | |
| 舒张压 | 0.986(0.978~0.995) | 0.002 | 0.985(0.975~0.994) | 0.002 |
| GLU | 0.963(0.936~0.991) | 0.009 | 1.000(0.967~1.035) | 0.983 |
| 血尿酸 | 1.003(1.002~1.004) | <0.001 | 1.000(0.999~1.001) | 0.609 |
| TP | 0.969(0.959~0.979) | <0.001 | 1.000(0.985~1.016) | 0.988 |
| ALB | 0.952(0.940~0.964) | <0.001 | 0.991(0.973~1.009) | 0.308 |
| TC | 0.933(0.877~0.992) | 0.027 | 0.991(0.922~1.065) | 0.813 |
| eGFR | 0.974(0.971~0.977) | <0.001 | 0.975(0.972~0.979) | <0.001 |
| HbA1c | 0.867(0.822~0.914) | <0.001 | 1.012(0.948~1.081) | 0.713 |
| UACR | 1.002(1.002~1.002) | <0.001 | 1.000(1.000~1.001) | 0.564 |
| 血钠 | 0.958(0.935~0.981) | 0.001 | 0.972(0.945~1.000) | 0.048 |
注:DKD为糖尿病肾病;GLU为空腹血糖;TP为血浆总蛋白;ALB为血浆白蛋白;TC为总胆固醇;eGFR为估算肾小球滤过率;HbA1c为糖化血红蛋白;UACR为随机尿白蛋白/肌酐比值;因变量为高钾血症(是=1,否=0),自变量均为连续型变量
高钾血症因其带来的严重生命威胁一直在临床备受关注,肾病患者又是高钾血症发生的高危人群,将血钾平均水平控制于<5.0 mmol/L可能降低3~5期未透析患者肾功能快速进展的风险[11],因此高钾血症是肾内科医师关注的重点和难点。DKD是CKD疾病谱的重要组成部分,但其高钾血症发生相关的临床研究较为缺乏,本研究主要针对DKD患者的临床资料进行分析,探究高钾血症的发生率、严重程度以及相关因素。
美国有研究显示 CKD患者高钾血症发生率为14%~20%[6],日本的一项真实世界研究发现在CKD患者中高钾血症发生率为22.79%[12],我国最近的临床研究发现门诊CKD患者高钾血症发生率为22.89%[7]。本研究纳入的DKD人群中高钾血症发生率为37.0%,高于国内外流行病学调查中CKD高钾血症的发生率。一项基于丹麦人群的队列研究发现糖尿病本就是高钾血症的危险因素之一[13],这可能是导致DKD患者高钾血症发生率较高的重要原因,其次可能与糖尿病引起的乳酸堆积、代谢紊乱状态以及醛固酮分泌减少有关,其中具体机制还需要进一步研究。本研究发现不同性别、年龄DKD患者之间高钾血症发生率差异无统计学意义,与一项来自英国的研究结果一致[14],但美国有研究认为性别和年龄是高钾血症发生的影响因素,且男性发生率高于女性[15],与本研究结果有差异,分析原因可能是未把地域、种族因素纳入研究,今后有待进一步的扩展研究。本研究发现,CKD严重程度与血钾水平之间存在一定程度的联系,随着肾功能的恶化,患者血钾水平升高,可能与钾离子大部分通过肾脏排泄有关,肾小球滤过功能减退和肾小管排泄障碍可使钾离子在体内积聚。
本研究分析了DKD患者高钾血症发生的影响因素,结果显示舒张压、eGFR、血钠与高钾血症的发生独立相关。CKD预后联盟[16]以及英国[14]随访研究发现高钾血症的风险与较低的eGFR有关,eGFR是与高钾血症相关的最重要因素,eGFR越低,发生高钾血症的风险越高。来自西班牙的研究也发现eGFR、舒张压、血钠是高钾血症发生的相关因素[17],另一项观察性队列研究结果显示高钾血症与eGFR和舒张压呈负相关[18],以上研究相关结论都与本研究一致,进一步说明了本研究结果的可靠性。由于血肌酐、尿素氮与eGFR之间存在共线性,本研究并未把血肌酐、尿素氮纳入多因素回归分析,以eGFR代表肾功能。另外,部分其他研究结果显示高钾血症与收缩压、尿蛋白等因素之间存在关联[16,18],本研究并未发现其中存在相关性,原因可能是样本构成之间存在差异,本研究纳入的人群样本均来自郑州大学第一附属医院肾脏病中心,在地域上患者大多分布在中原地区,患者的文化、经济、生活环境、生活方式等可能对结果产生一定的影响,今后本课题组将纳入更大样本量资料进行分析以提高结论的准确性。本研究是回顾性研究,对高钾血症的发生可能造成影响的用药信息收集不够完善,分析存在一定的局限性,这将是未来工作中重点深入探索的内容。
综上,本研究发现DKD患者高钾血症发生率为37.0%,高于CKD整体高钾血症发生率,且高钾血症发生率随肾功能恶化逐渐升高。另外,通过分析临床检验指标与高钾血症发生率之间的关系,发现eGFR、舒张压、血钠浓度越低,高钾血症发生风险越高,可为DKD患者高钾血症发生的预测提供一定依据,以预防和减少临床高钾血症及其相关不良事件的发生。
所有作者均声明不存在利益冲突



























