
本文报道1例骨髓增生异常综合征合并+8染色体三体相关肠道溃疡患者的诊治过程。该患者起病表现为腹痛、腹泻及发热,同时合并结肠多发溃疡,曾被误诊为溃疡性结肠炎,给予激素及免疫抑制剂治疗,效果不佳。后经骨髓等系列检查,最终确诊骨髓增生异常综合征,+8染色体三体相关肠道多发溃疡,最终给予异体造血干细胞移植治疗,病情缓解。

患者女,50岁,因“腹痛、腹泻、发热半年”于2020年5月28日收入青岛大学附属医院。患者2019年12月无明显诱因出现腹痛,为下腹部阵发性疼痛,疼痛视觉模拟评分(VAS)5~10分,无放射痛,疼痛后有便意,排便后有所缓解,伴腹泻,4~5次/d,黄色不成形稀便,无脓血,无发热,外院就诊,查白细胞(WBC)10.1×109/L,红细胞(RBC)3.71×1012/L,血红蛋白(Hb)95 g/L,红细胞压积0.314,平均血红蛋白含量25.7 pg,平均血红蛋白浓度303 g/L,血小板总数(PLT)252×109/L,乳酸脱氢酶(LDH)366 U/L,癌胚抗原、甲胎蛋白、糖基抗原125及糖基抗原19-9均正常,大便潜血阴性,腹部CT:多发肝囊肿,双肾囊肿;胃镜提示慢性非萎缩性胃炎伴胆汁反流,胃多发息肉,结肠镜提示回盲部、升结肠及横结肠多发阿弗他样溃疡;病理提示黏膜固有层内见较多急慢性炎细胞浸润,可见小脓肿形成,未见溃疡面坏死,不排除溃疡性结肠炎(UC)。后患者逐渐出现发热,体温最高41 ℃,伴畏寒、寒战,仍有腹痛,腹泻进行性加重,最多每日10余次,伴口腔溃疡,无外阴溃疡、无皮疹,偶有恶心、呕吐,再次复查肠镜仍提示结肠多发片状溃疡,大者15 mm×5 mm,外院考虑“UC,不除外感染”,给予积极抗感染、抗病毒治疗无效,后给予美沙拉嗪1 g/次,3次/d口服,甲泼尼龙20~80 mg及吗替麦考酚酯等治疗,足量激素后症状好转,减量后症状反复。患者仍有腹痛、腹泻、发热,为进一步诊治来本院就诊。既往史:13年前行“剖宫产”手术。婚育史、个人史及家族史无特殊。入院查体:体温36.4 ℃,轻度贫血貌,睑结膜轻度苍白,无口腔溃疡,无皮疹,腹软,无压痛。
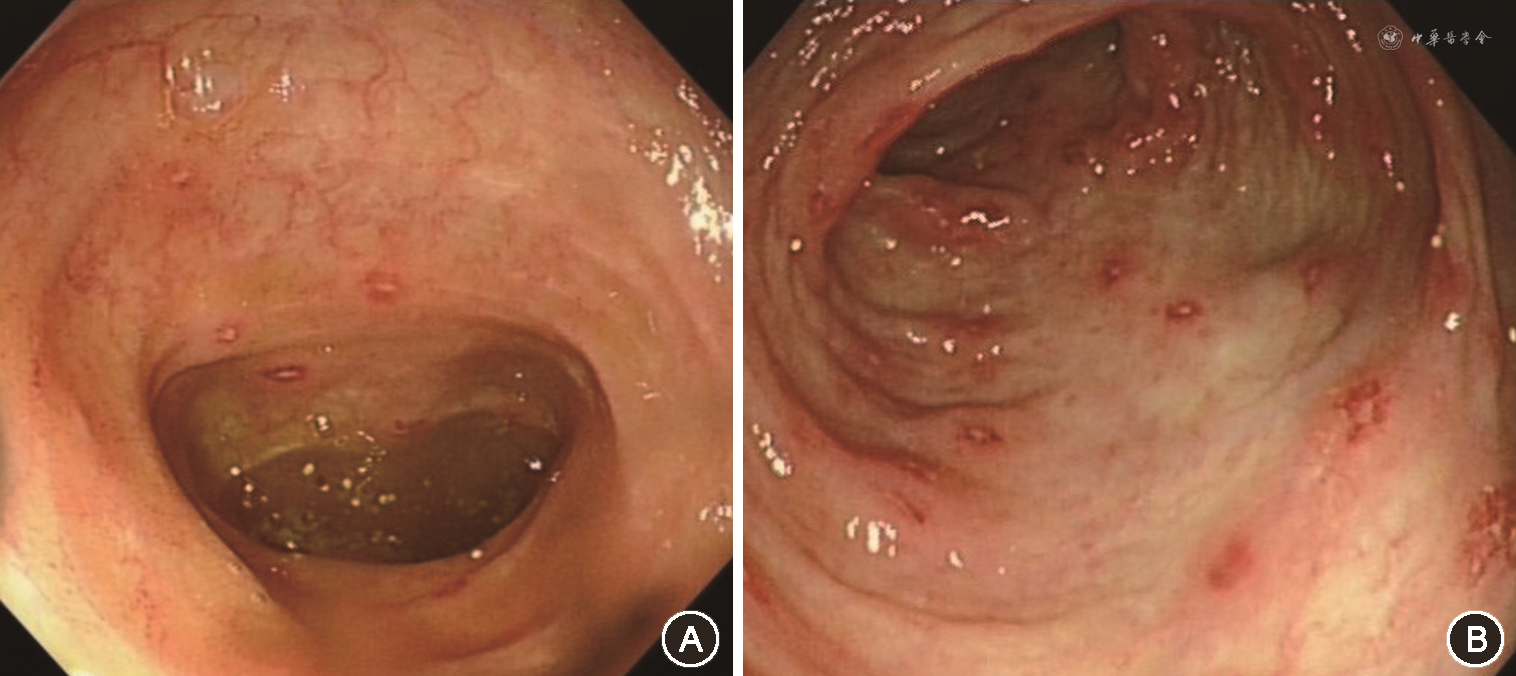
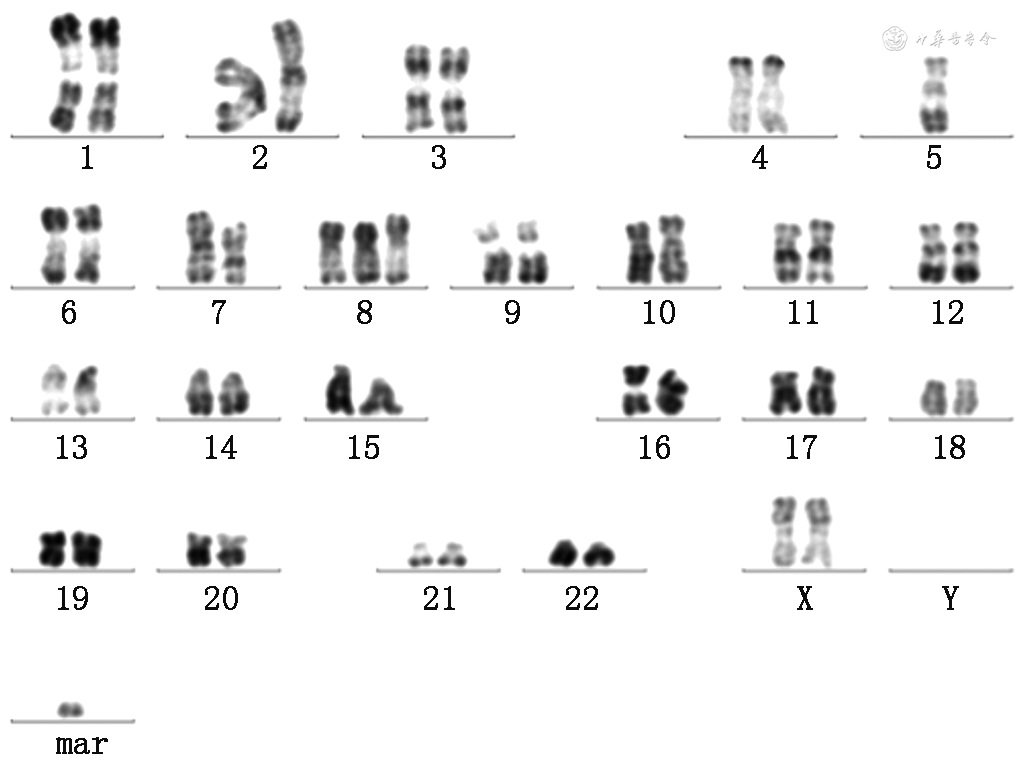
入院后完善检查,WBC 20.6×109/L,Hb 100 g/L,PLT 54×109/L,C反应蛋白(CRP)22.38 mg/L,LDH 525 U/L,铁蛋白369.9 ng/ml,EB病毒(EBV)DNA 1.74×103 拷贝/ml,生化、免疫等均正常。肠镜及胶囊内镜检查示回肠末端,结肠散在点片状溃疡,大者12 mm×5 mm,覆白苔,周边黏膜明显发红(图1),病理:黏膜组织呈慢性活动性炎伴糜烂及肉芽组织增生,间质淋巴细胞及部分中性粒细胞浸润,EB编码核糖核酸(EBER)(-),T细胞抗原受体重排(-)。患者中年女性,慢性病程,临床表现为腹痛、腹泻、发热,炎症指标升高,PLT下降,贫血,WBC略高,LDH、铁蛋白升高,肠镜为回肠末端,结肠可见多发阿弗他样及片状穿凿样溃疡,周边黏膜明显发红,病理不支持UC。结合以上,考虑该患者回结肠溃疡不符合UC,血液系统疾病不除外,故逐渐减量激素,完善骨髓检查及功能代谢显像(PET)CT。骨髓示骨髓增生极度活跃(细胞容积90%,粒红比例减少,粒系以中幼及以下阶段为主,红系各阶段可见,巨核细胞易见,最多达20个/高倍视野),流式细胞学示髓系原始细胞比例增高(5.6%),粒系比例增高,建议除外髓系肿瘤[骨髓增殖性肿瘤(MPN)、骨髓增生异常综合征(MDS)/MPN];染色体核型克隆性异常,-5,del(7q),+8,+mar[可见于MDS,急性髓细胞白血病(AML),淋巴系统疾病等](图2)。PET CT:结肠肝曲壁轻度增厚,代谢轻度增高,标准最大摄取值(SUVmax)3.1,脾脏弥漫性代谢增高,SUVmax 3.7,骨骼系统弥漫性代谢增高,SUVmax 5.7。为进一步对疾病诊断、预后判断和治疗策略进行指导,完善二代测序:与疾病密切相关热点突变位点SET结合蛋白1(SETBP1):47.5%,肿瘤蛋白p53(TP53):48.5%。结合以上,患者最终诊断:MDS[MDS-多系造血异常(MLD),基于WHO分类的预后评分系统(WPSS)3分 高危,国际预后评分系统(IPSS)评分1.5分 中危-2,修订版IPSS 4.5分 中危],给予地西他滨治疗40 mg d1~d5,症状有所缓解,但患者症状仍有反复,后于北京协和医院血液内科住院诊治,查PLT 49×109/L,LDH 439 U/L,超敏C反应蛋白(HsCRP)28.37 mg/L,大便培养阴性,艰难梭菌毒素、真菌D-葡聚糖、肥大外斐反应试验、布氏杆菌凝集试验、巨细胞病毒(CMV)DNA及EBV DNA等感染检查均阴性。免疫及肿瘤标志物均阴性。外周血细胞形态学分析提示原始细胞1%,荧光原位杂交(FISH)-MDS系列:P53 10%,EGR1 95%,D7S486 84%,Csp8 84%,D20s108 6%,骨髓穿刺:增生活跃,粒系原始粒细胞比例增高,占4%,部分粒细胞可见胞浆颗粒减少,可见个别P-H畸形,符合MDS治疗后。肠镜检查提示回肠、盲肠、结肠、直肠可见散在充血糜烂及椭圆形穿凿样溃疡,表覆黄苔。病理提示炎性渗出物及肠黏膜慢性炎,乙状结肠黏膜下层部分小血管壁玻璃样变。CMV原位杂交技术(ISH)及EBER ISH均阴性,完善检查后提示患者诊断为MDS-MLD,IPSS-R6分,中危,肠道溃疡为白塞氏综合征(Behçet syndrome,BS),考虑为+8染色体三体相关肠道多发溃疡可能性大,给予足量激素,沙利度胺50 mg/次,1次/d治疗,逐渐加量至100 mg/次,1次/d及司坦唑醇2 mg/次,3次/d治疗,并建议异体造血干细胞移植(haematopoietic stem-cell transplantation,HSCT)治疗,后患者行HSCT,症状缓解,未再腹痛、腹泻,未再发热,血常规恢复正常,目前应用更昔洛韦预防性抗病毒、氟康唑预防性抗真菌、复方磺胺甲噁唑片预防性抗卡氏肺孢子及抗排异等治疗,仍在随访中。


患者以腹痛、腹泻、发热、肠道溃疡等消化系统表现发病,容易误诊或漏诊其他系统疾病。
当MDS合并+8染色体三体时,容易出现腹部症状及肠道溃疡,临床对该病认知不足。
MDS合并+8染色体三体相关溃疡(BD/BS)时治疗比较困难,常规治疗效果不佳。
当患者有消化道症状、发热、典型血管炎样溃疡及血常规异常时,需要警惕MDS可能。
当MDS存在+8三体染色体时,我们应警惕是否存在肠道受累,尤其是存在不明原因发热或腹部主诉的病例。
MDS存在+8三体染色体相关溃疡(BD/BS)时,治疗方案主要选择HSCT,避免反复应用激素、免疫抑制剂及生物制剂,以免延误疾病治疗。
本例患者中年女性,慢性病程;腹痛、腹泻和发热为主要临床表现,病程过程中有口腔溃疡;实验室检查提示小细胞低色素贫血,病程过程中逐渐出现PLT下降,LDH、铁蛋白、EBV DNA轻度升高,发热时CRP升高,结肠镜及胶囊内镜均提示回肠末端、结肠多发穿凿样溃疡,覆白苔,溃疡周边黏膜发红。病理提示非特异性炎症,PET CT提示结肠肝曲壁轻度增厚,脾脏及骨骼系统弥漫性代谢增高。骨髓:流式细胞学检查提示髓系原始细胞比例增高(5.6%),考虑MDS;染色体核型有克隆性异常,-5,del(7q),+8,+mar;MDS二代测序:TP53∶48.5%;最终诊断:MDS(MDS-MLD,IPSS-R 6分 高危)。
患者为MDS,但以消化系统症状起病,表现为腹痛、腹泻、合并发热,结肠镜提示回肠末端及结肠多发穿凿样溃疡,曾被外院误诊为UC。该患者肠道溃疡的病因仍需要进一步排查,是MDS导致还是存在二元论可能。从诊断和鉴别诊断的角度分析,肠道溃疡有以下可能:(1)感染:患者一般有不洁饮食史或疫区旅居史,临床上可表现为发热、腹痛、腹泻,甚至恶心、呕吐等,实验室检查提示WBC改变,炎症指标升高,多次大便、血培养或组织培养可能发现致病菌,足疗程抗感染治疗有效。该患者反复完善细菌、病毒、真菌及寄生虫等检查均阴性,反复足疗程抗感染治疗效果不佳,考虑原发感染可能性小。(2)血管炎:患者有口腔溃疡,炎症指标升高,结肠镜提示穿凿样溃疡,溃疡周边黏膜充血,符合血管炎改变,病理提示慢性炎症,乙状结肠黏膜下层部分小血管壁玻璃样变,足量激素治疗病情有所好转,该患者需要进一步考虑血管炎可能,如BS等。(3)炎症性肠病(IBD):患者慢性病程,临床表现为腹痛、腹泻、发热,炎症指标升高,结肠镜提示肠道溃疡,病理提示慢性炎症,激素治疗有一定效果,但患者溃疡改变不符合UC内镜改变,也不符合典型克罗恩病(CD)表现,UC临床表现为腹泻、黏液脓血便、腹痛,该患者无明显黏液脓血便,与临床不符;另外,UC内镜表现为从直肠发起的弥漫连续病变,该患者为散在病变,不符合UC内镜改变,因早期CD可表现为阿弗他溃疡,故需要除外早期CD可能;然而,轻中度IBD一般对美沙拉嗪及激素敏感,但该患者效果不佳,故考虑患者IBD可能性小,基本可排除UC,早期CD不除外,但可能性小,需进一步随访。(4)淋巴瘤:患者发热、腹泻,血常规异常,LDH、EBV DNA升高,肠道多发溃疡,需要考虑淋巴瘤可能,但PET CT、骨髓及病理均不支持,考虑可能性小。故该患者肠道溃疡诊断方面首先考虑血管炎可能性大。
MDS是起源于造血干细胞的高度异质性髓系克隆性疾病,其特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病转化[1]。MDS本身几乎不累及胃肠道。但文献发现MDS可合并肠白塞病(Behçet Disease,BD)/BS样特征改变,尤其是+8染色体三体的MDS患者[2]。多项研究提示8号染色体三体在MDS合并BD/BS样特征改变时与肠道溃疡之间有重要的关联[2, 3, 4, 5, 6, 7, 8]。MDS合并BD/BS样特征改变的患者中,8号染色体最常见出现的核型异常,8号染色体三体的患者更易出现发热及肠道病变[2]。该患者为+8染色体三体的MDS,临床上表现为消化道症状及发热,CRP升高,肠道表现符合BS样特征,故其肠道溃疡最终考虑为+8染色体三体相关肠道溃疡可能性大。
既往报道,+8染色体三体的MDS患者中有76.2%的患者合并BD/BS样特征改变[7]。研究者曾总结约50例+8染色体三体的MDS患者资料,其平均年龄为45.7岁,69.2%患者有发热,69.2%的患者有肠道累及,仅11%患者合并眼部病变[7]。合并发热时可出现炎症指标升高;内镜主要表现为结肠黏膜弥漫肿胀,多发糜烂,孤立或多发穿凿样溃疡,当MDS合并典型肠BD时,肠道溃疡一般呈现边缘锐利的圆形深溃疡,好发于回盲部及近端结肠,肠道溃疡容易穿孔与出血[2]。许多患者早期因肠道溃疡被误诊为IBD,延误疾病诊治。该患者临床也表现为发热、肠道累及,炎症指标升高,肠道溃疡为小肠及结肠黏膜多发糜烂、穿凿样溃疡,同样发病半年内被误诊为UC,反复给予了激素等治疗,与文献报道一致。BD/BS样特征改变与MDS可同时发生,也可早于或晚于MDS发生[9]。
+8染色体三体的MDS合并BD/BS时治疗比较困难,极个别患者可能对硫唑嘌呤或生物制剂有效,近年来研究发现应用糖皮质激素、免疫抑制剂、肿瘤坏死因子(TNF)-α单克隆抗体对上述患者疗效不显著。另有研究发现HSCT对其治疗有效,不仅能有效控制肠道溃疡,同时能够消除MDS产生的异常恶性克隆,从而控制病情[10]。本例患者足量激素可适当控制病情,但地西他滨、沙利度胺等均未能有效维持疾病缓解。
为何+8染色体三体的MDS患者表现出高度炎症状态的原因还不完全清楚。既往研究发现,患者的白细胞介素(IL)-1β、IL-6、IL-8、IL-17、IL-18、TNF-α和干扰素(IFN)-γ水平升高,特别是在疾病活动状态下[9,11]。Chen等[12]报道了在来自+8染色体三体的MDS患者的分化34阳性造血祖细胞群中促炎基因的上调,如转化生长因子-β、IFN-β2、IL-6、IL-7R、细胞间黏附分子-1(ICAM-1)和单核细胞趋化蛋白-1(MCP-1)。TNF相关凋亡诱导配体(TRAIL)及其受体(TRAIL-R)在淋巴细胞稳态中起重要作用,与包括MDS在内的多种恶性血液病密切相关,而编码TRAIL-R的基因就位于8号染色体短臂21-22位点(8p21-22)[13]。+8染色体三体的MDS合并BS的相关发病机制有待进一步研究。
综上,MDS合并BD/BS与单纯的MDS或BD/BS临床特征不同,给予常规治疗效果欠佳,血液科、风湿免疫科及消化内科医生对其认知不足,容易误诊或者漏诊。所以,当MDS存在+8三体染色体时,应警惕是否存在肠道受累,尤其是存在不明原因发热或腹部主诉的病例,需进一步明确是否合并BD/BS样特征改变;治疗方案选择主要选择HSCT,避免反复应用激素、免疫抑制剂及生物制剂,以免延误疾病治疗。另外,当患者有消化道症状、发热并有典型血管炎样溃疡时,需要警惕MDS可能。
所有作者均声明不存在利益冲突



























