
构建能够表达人重组蛋白Elafin的益生菌大肠杆菌Nissle 1917(EcN),并探讨其对葡聚糖硫酸钠(DSS)诱导的急性小鼠结肠炎的保护作用。
构建带有Elafin基因的重组质粒,将其转入感受态EcN,构建能够表达Elafin蛋白的益生菌EcN-Elafin。通过Western印迹证实该益生菌在体外成功表达Elafin。C57/BL6J小鼠随机分为4组:健康对照组(PBS组)、结肠炎组(DSS组)、野生型EcN(EcN-WT)治疗结肠炎组(EcN-WT组)、EcN-Elafin治疗结肠炎组(EcN-Elafin组)。每天同一时间测量小鼠体重、观察小鼠排便情况及计算疾病活动度指数(DAI)。小鼠处以安乐死后测量结肠长度,苏木精-伊红(HE)染色及组织病理学评分比较各组肠黏膜炎症程度,流式细胞术检测结肠固有层浸润中性粒细胞和巨噬细胞的比例,酶联免疫吸附法(ELISA)定量结肠组织中的肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6及趋化因子CXCL-1的蛋白表达水平。
在EcN-Elafin的培养基上清和菌体沉淀中均能检测到Elafin蛋白。与DSS组相比,EcN-Elafin组和EcN-WT组小鼠体重减轻状况和DAI评分均明显改善。EcN-Elafin组小鼠结肠长度显著长于DSS组。EcN-Elafin组结肠炎组织学评分显著低于DSS组(5.3±2.3比9.3±1.4,P<0.05)。与DSS组小鼠相比,EcN-Elafin组小鼠结肠固有层浸润的中性粒细胞[(8.65±1.49)% 比(17.60±2.16)%,P<0.01]和巨噬细胞[(3.79±0.26)% 比(5.73±0.45)%,P<0.01]比例均显著降低。EcN-Elafin组和EcN-WT组结肠中TNF-α、IL-6、和CXCL-1蛋白质表达水平均显著低于DSS组。
表达Elafin的益生菌EcN-Elafin能够显著减轻DSS诱导的急性小鼠结肠炎,对肠黏膜炎症具有保护作用,为临床炎症性肠病的治疗提供一种新的经济有效的方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,炎症性肠病(IBD)在发展中国家的发病率迅速上升,为各个国家带来了沉重的经济负担[1]。抗肿瘤坏死因子(TNF)-α等生物制剂疗法是目前常用的治疗方法,然而高达40%以上的IBD患者对此无应答,且初治有效者部分发展为继发性无应答[2, 3]。Elafin是一种天然存在的可表达于健康肠道黏膜的蛋白酶抑制剂。本课题组前期研究结果表明Elafin在IBD患者外周血和结肠黏膜中的表达均有下降,且其mRNA表达量与患者的疾病活动度评分呈负相关[4, 5],提示Elafin可能参与了IBD的发生和进展。相关研究表明,Elafin具有抗炎、抗微生物感染、组织修复和免疫调节功能[6]。由于蛋白质药物在到达肠道作用靶点前就会被降解失活[7],因此Elafin蛋白无法直接通过口服给药,还需要为其找到一个经济高效的药物表达系统。大肠杆菌Nissle 1917(EcN)是一种肠道益生菌,既往研究证实EcN可以通过调节肠道微生态,发挥对小鼠实验性肠炎的保护性作用[8],同时在诱导和维持溃疡性结肠炎(UC)患者临床缓解方面也有较好的疗效[9]。此外,新近采用EcN表达重组蛋白药物治疗结肠炎的研究已取得不错的疗效[7,10],证实了这一方案的可行性。本研究将通过构建能够表达Elafin的EcN(EcN-Elafin),经灌胃将Elafin直接释放于实验性结肠炎小鼠肠黏膜表面,探讨EcN-Elafin对实验性结肠炎的保护作用。
1.实验动物:8周龄SPF级雄性C57BL/6J小鼠,购自北京斯贝福实验动物技术有限公司。本研究经北京大学第一医院实验动物福利伦理委员会审查通过(批号J201812)。
2.基因工程菌的构建及验证:EcN和pGEX-4T-3质粒均由本实验室保存。重组质粒构建方法:以Elafin cDNA质粒为模板,扩增出编码不含信号肽的成熟Elafin DNA序列,两端包含EcoRI和XhoI双酶切位点。在细菌表达质粒pGEX-4T-3中用点突变的方法,在GST cDNA前创建一个EcoRI酶切位点,以便构建表达非融合蛋白形式的Elafin的重组质粒。定点突变后的质粒用EcoRI酶切后自连接。转染后的EcN经PCR证明含有Elafin表达质粒(图1)。


注:WT为野生型EcN;EL为EcN-Elafin;M为DNA分子量标记;Ctrl为阴性对照(空载体转染EcN菌株)
3.灌胃用细菌准备方法:细菌培养基采用LB(Luria-Bertani)培养基,含有甘油的EcN-WT和EcN-Elafin菌株分别进行分装后于-80 ℃进行保存。实验当天分别将EcN-WT和EcN-Elafin冻存菌株加入无菌LB培养基中置于37 ℃,220转/min恒温摇床进行摇菌,5 h后离心弃上清,用无菌磷酸盐缓冲液(PBS)洗涤一遍,弃上清用无菌PBS调整菌体浓度为5×109集落形成单位(CFU)用于小鼠灌胃,灌胃方案为每天每只小鼠0.2 ml/次,重复灌胃10 d直至处死前1 d。
4.动物分组及实验性肠炎模型的建立:小鼠随机分为4组:健康对照组(PBS组,n=6)、葡聚糖硫酸钠(DSS)急性肠炎组(DSS组,n=8)、给予野生型EcN(EcN-WT)灌胃的急性肠炎组(EcN-WT组,n=8)、给予表达Elafin的EcN(EcN-Elafin)灌胃的肠炎组(EcN-Elafin组,n=8)。DSS(相对分子质量36 000~50 000)购自美国MP Biomedicals公司。3个肠炎组(DSS组、EcN-WT组和EcN-Elafin组)均采用含2.5% DSS的无菌饮用水让小鼠自由饮水5 d,随后换为不含DSS的无菌饮用水继续灌胃5 d。每天记录小鼠体重和粪便情况,并按照文献[10]中提到的方法计算小鼠每天的疾病活动度指数(DAI)。在开始实验后的第11天对小鼠处以安乐死,收集所需标本以进行后续实验。
5.标本采集与处理:取小鼠全结肠,剪开肠系膜,拍照并测量从肛门至结肠起始端长度,随后将整根结肠纵行切开,清除肠内容物,按文献方法留取标本备用:直肠端起始1 cm立即放入液氮供ELISA检测使用,剩余结肠按照文献[11]卷成瑞士卷样(Swiss-rolling)后进行固定、包埋、切片以供组织病理学分析用。
6.苏木精-伊红(HE)染色及组织病理学评分:小鼠结肠组织切片经HE染色后在光学显微镜下由一名研究人员采用盲法观察并进行组织病理学评分。结肠炎组织病理学评分按如下标准进行:炎症程度(0=无;1=轻度;2=中度;3=重度);炎症细胞浸润深度(0=无;1=黏膜下层;2=肌层;3=全层);隐窝破坏程度(0=无;1=基底1/3隐窝破坏;2=基底2/3隐窝破坏;3=顶部出现破坏);病变范围(0=无;1=1%~25%;2=26%~50%;3=51%~75%;4=100%)。最终评分由四个方面的评分相加,理论分值区间为0~13分。
7.小鼠结肠固有层单细胞悬液的制备及流式细胞分析:按照文献[12]的方法提取小鼠结肠固有层细胞并制备为单细胞悬液以进行后续的流式细胞分析。流式细胞分析所用抗体:anti-CD11b-PEcy7、anti-Ly6G-APC、anti-F4/80-APC、anti-CD16/32,上述抗体均购自Biolegend公司。
8. ELISA检测小鼠结肠组织中的细胞因子和趋化因子表达水平:取预留小鼠结肠组织加入含蛋白酶抑制剂的RIPA裂解液,使用组织细胞破碎仪获得组织匀浆,采用BCA法对总蛋白浓度进行定量。随后严格按照ELISA试剂盒(购自美国Invitrogen公司)说明书操作,检测结肠组织匀浆中白细胞介素(IL)-6、TNF-α和CXCL-1蛋白表达水平,组间比较使用“pg/mg总蛋白”进行分析。
9.统计学方法:使用Graphpad Prism 7.0软件进行统计学分析。文中数据均符合正态分布,记为。多组间比较采用单因素方差分析(One-way ANOVA),各组间两两比较采用Turkey多重比较法。双侧检验,检验水准α=0.05。
1. 成功构建能够稳定表达Elafin的益生菌EcN(EcN-Elafin):EcN-WT和EcN-Elafin均于4 ml LB培养基37 ℃下过夜摇菌,第2天按1∶100分别接种于20 ml新鲜的LB培养基中继续摇菌6 h,随后在5 000转/min条件下离心。培养基上清通过Amicon-4 ml超滤管(截留分子量为3 kd)进行浓缩,细菌沉淀加入2 ml PBS重悬后使用超声裂解。通过Western印迹分别检测EcN-WT和EcN-Elafin培养液上清和菌块超声裂解液中的Elafin蛋白,如图1A所示,EcN-Elafin的培养液上清和菌块中均在同一位置显示代表Elafin的特异性条带,而EcN-WT的培养液上清和菌块未显示相应条带。
2.EcN-Elafin对DSS诱导小鼠急性结肠炎体重和疾病活动度的影响:各组小鼠体重情况如图2A所示,实验开始后第5天,DSS组与PBS组体重开始出现明显差异并且持续到实验结束(P<0.01)。停DSS后第2天(总第7天),EcN-Elafin组小鼠体重下降程度与DSS组出现差异(P<0.05)且持续至实验结束。仅第9天EcN-Elafin组小鼠体重下降程度与EcN-WT组有差异(P<0.05)。图2B示各组DAI评分,实验开始第7天,EcN-Elafin组小鼠DAI评分开始显著低于DSS组[(4.88±2.30)比(8.75±1.28),q = 4.67,P<0.05]且一直持续到实验结束。EcN-WT组小鼠仅第9天(P<0.05)和第10天(P<0.01)DAI评分显著低于DSS组。同时,第9天和第10天 EcN-Elafin组DAI评分显著低于EcN-WT组(P<0.05)。


注:PBS为健康对照组,n=6;DSS为结肠炎组,n=8;EcN-WT为野生型EcN治疗结肠炎组,n=8;EcN-Elafin为EcN-Elafin治疗结肠炎组,n=8;与DSS组相比,aP<0.05;与DSS组相比,bP<0.01;与EcN-WT组相比,cP<0.05
3.EcN-Elafin对DSS诱导小鼠急性结肠炎的结肠长度和结肠炎症程度的影响:DSS诱导小鼠肠炎的特征之一是结肠长度会出现缩短。EcN-Elafin组与DSS组相比,其结肠长度显著增加(P<0.01),与EcN-WT组相比,其差异无统计学意义(P>0.05)。EcN-WT组与DSS组相比,同样差异无统计学意义(P>0.05)。图3显示各组小鼠结肠组织学变化,DSS组小鼠结肠黏膜固有层由于炎症细胞浸润,可见其厚度增加,同时隐窝结构由于炎症反应受到破坏,出现扭曲甚至上皮细胞大片脱落。EcN-WT和EcN-Elafin组的结肠黏膜上皮均呈现出一定程度的修复表现,可见几乎正常的隐窝结构。进行肠炎组织病理学评分,发现EcN-Elafin组组织病理学评分显著低于DSS组(5.3±2.3比9.3±1.4,q = 3.80,P<0.05)。然而EcN-WT组与DSS组病理组织学评分相比差异无统计学意义(P>0.05)。
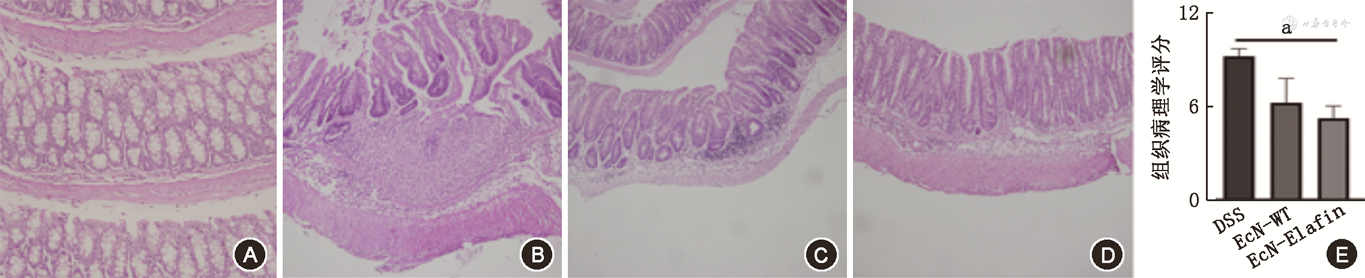

注:PBS为健康对照组,n=6;DSS为结肠炎组,n=8;EcN-WT为野生型EcN治疗结肠炎组,n=8;EcN-Elafin为EcN-Elafin治疗结肠炎组,n=8;aP<0.05;A~D为苏木精-伊红(HE)染色(×200);DSS为葡聚糖硫酸钠
4.EcN-Elafin对DSS诱导小鼠急性结肠炎模型结肠固有层浸润中性粒细胞和巨噬细胞比例的影响。分离各组小鼠结肠固有层细胞进行流式分析结果显示:EcN-Elafin组小鼠结肠固有层浸润中性粒细胞比例低于DSS组[(8.65±1.49)% 比(17.60±2.16)%,q = 10.29,P<0.01],同时也低于EcN-WT组[(14.1±1.47)%,q=6.26,P<0.01]。然而EcN-WT组小鼠结肠中浸润的中性粒细胞比例与DSS组相比差异无统计学意义(P>0.05)。对各组小鼠结肠固有层巨噬细胞比例进行分析发现,EcN-Elafin组低于DSS组[(3.79±0.26)% 比(5.73±0.45)%,q=8.80,P<0.01]。EcN-WT组也低于DSS组(P<0.05),然而与EcN-Elafin组相比,差异无统计学意义(P>0.05)(图4)。
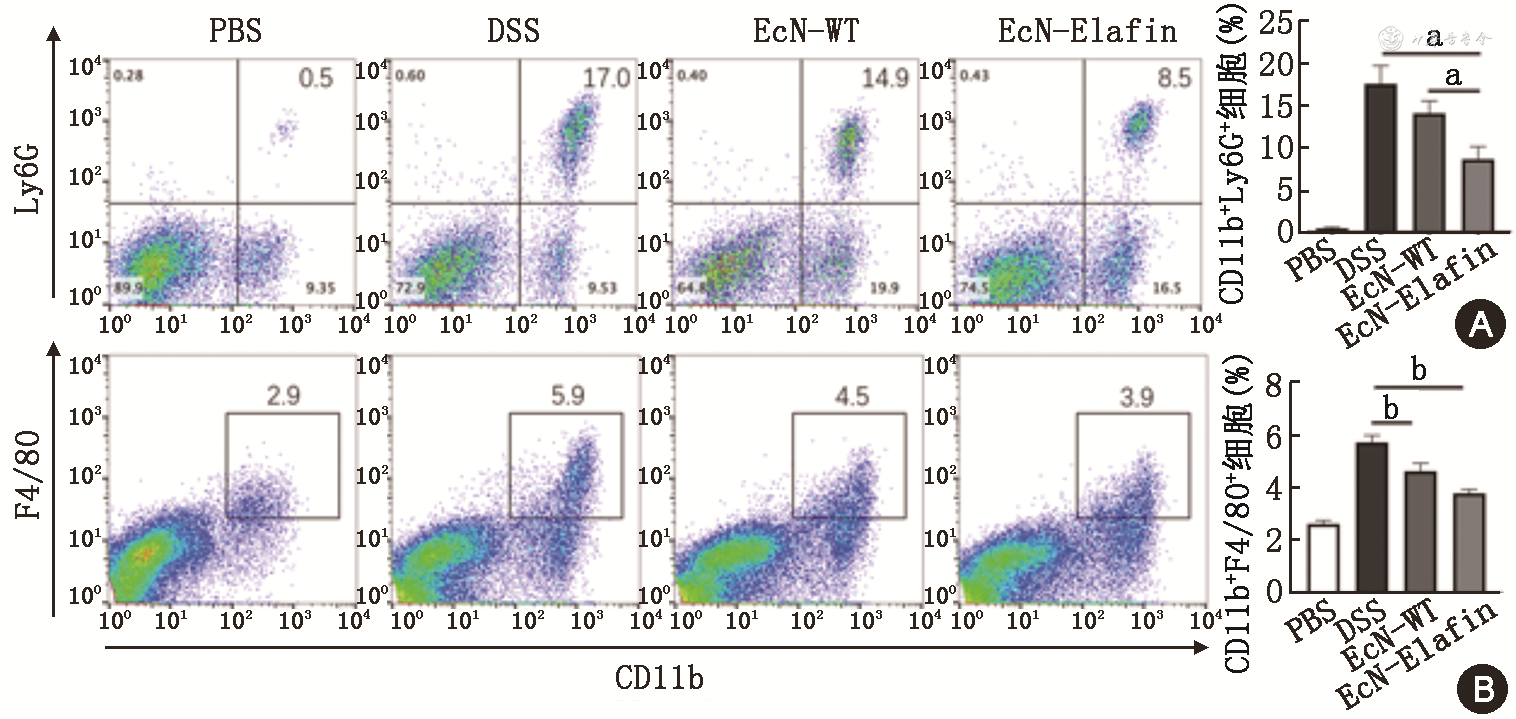

注:aP<0.01;bP<0.05;PBS为磷酸盐缓冲液;DSS为葡聚糖硫酸钠
5.EcN-Elafin对DSS诱导小鼠急性肠炎模型结肠组织中促炎细胞因子和趋化因子的影响:如图5所示,EcN-Elafin组和EcN-WT组小鼠结肠组织中炎症因子TNF-α和IL-6的表达水平均显著低于DSS组(P<0.05),而两组之间进行比较差异无统计学意义(P>0.05)。CXCL-1为小鼠特异性趋化中性粒细胞的趋化因子,与DSS组相比,其表达水平在EcN-Elafin组(P<0.001)和EcN-WT组(P<0.01)中均显著降低,且EcN-Elafin组和EcN-WT组进行比较差异也具有统计学意义(P<0.05)。
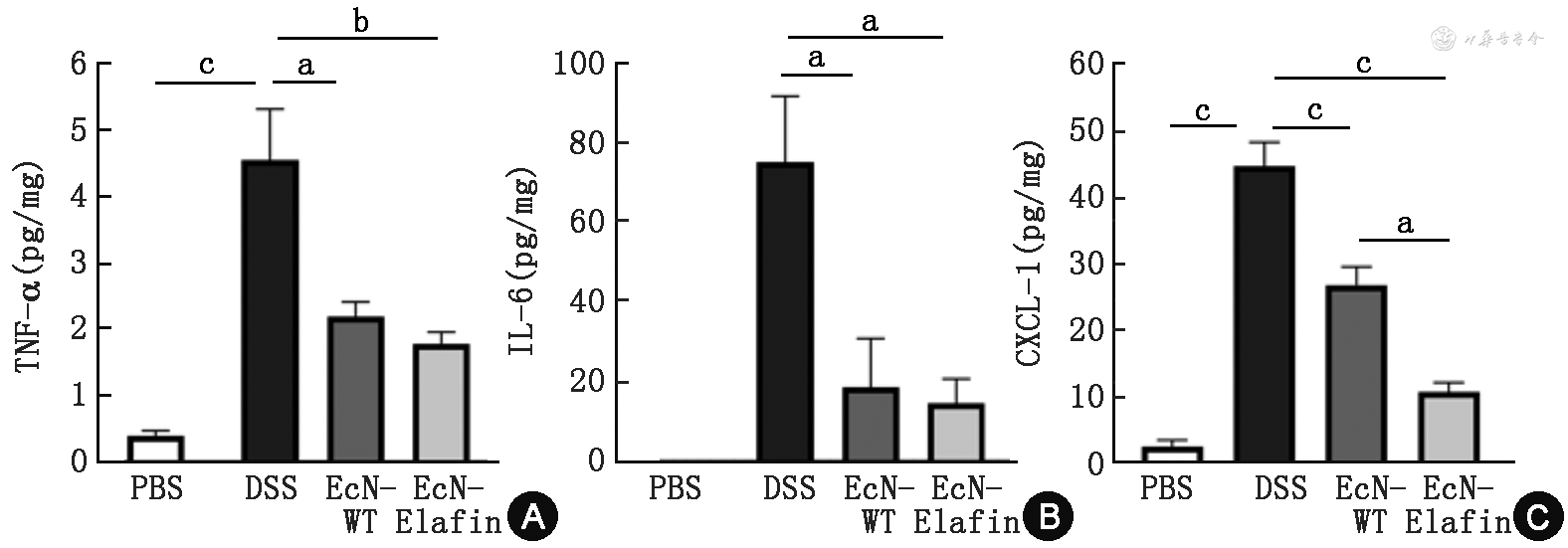

注:PBS为健康对照组,n=6;DSS为结肠炎组,n=8;EcN-WT为野生型EcN治疗结肠炎组,n=8;EcN-Elafin为EcN-Elafin治疗结肠炎组,n=8;TNF为肿瘤坏死因子;IL为白细胞介素;aP<0.05;bP<0.01;cP<0.001
Elafin是最初在肺组织和皮肤组织中发现的一种能特异性抑制中性粒细胞弹性蛋白酶(NE)和蛋白酶3(PR3)的蛋白酶抑制剂[13, 14]。既往研究表明,Elafin所具有的抗炎作用主要是通过它对NE活性的抑制作用所介导的[15, 16, 17, 18]。此外,Elafin能够通过下调炎症相关转录因子AP-1和NF-κB的活性,对炎症相关的多种细胞(单核细胞、巨噬细胞或内皮细胞)发挥调节作用[19, 20]。关于Elafin在IBD患者肠黏膜中的表达水平的早期研究结果提示,IBD患者尤其是UC患者的肠黏膜中Elafin的表达水平是增加的[21, 22]。本团队前期的研究结果[5]和Motta等[23]的一项研究结果均提示Elafin在IBD患者的肠黏膜表面的表达水平是显著降低的。考虑到IBD病因学的复杂性,异常的免疫调节状态、肠上皮屏障受损以及肠道微生态均起到至关重要的作用。外源性补充Elafin也许能够调节肠道的免疫状态、促进肠上皮损伤修复同时调节肠道菌群,发挥对结肠炎的保护作用。本研究构建了能够表达具有多种生物学活性的小分子蛋白Elafin的益生菌EcN-Elafin,通过益生菌EcN-Elafin对实验性结肠炎小鼠进行治疗,结果发现EcN-Elafin能够显著减轻DSS所引起的小鼠体重下降和结肠缩短,同时改善小鼠的疾病活动度指数。上述结果说明给予EcN-Elafin治疗后,小鼠结肠炎的严重程度显著减轻。采用EcN-WT治疗的小鼠与DSS组小鼠相比,炎症的部分指标也有一定程度减轻,这与近年来相关文献报道的EcN能够预防和治疗小鼠实验性结肠炎的结果一致[8,24, 25]。与EcN-WT组相比,EcN-Elafin对结肠炎具有更强的保护作用,这一结论基于下述结果:采用EcN-Elafin治疗组小鼠在停用DSS后更早出现体重回升,DAI评分更低,结肠病理组织学评分更低。EcN-Elafin也能减少结肠固有免疫细胞(中性粒细胞和巨噬细胞)的浸润,同时EcN-Elafin组小鼠结肠组织的中性粒细胞特异性趋化因子CXCL-1的表达水平显著低于DSS组,且与EcN-WT组相比也明显降低(P<0.05),说明Elafin能降低炎症状态下肠道趋化因子CXCL-1的表达水平,这与EcN-Elafin组小鼠结肠中性粒细胞比例减少相符。然而并不能排除EcN-Elafin对其他类型的细胞也能发挥作用,例如内皮细胞和淋巴细胞。肠道微生态平衡对肠道健康至关重要[26],由于EcN能够调节结肠炎小鼠的肠道菌群[8],而Elafin也具有抗微生物作用,推测EcN-Elafin可能对肠道菌群有明显的调节作用。
本研究仅使用了一种结肠炎模型—DSS诱导急性小鼠结肠炎模型,主要对UC的表现进行一定的模拟。因此,为验证EcN-Elafin对IBD的保护性作用,还需要在更多的动物结肠炎模型上进行验证,例如IL-10基因敲除的小鼠模型、T细胞过继转移模型、TNBS损伤模型等。综上所述,本研究证实了表达Elafin的益生菌Nissle 1917能够缓解DSS诱导的小鼠急性肠炎,对肠黏膜炎症具有保护作用,未来可能成为临床IBD治疗的一种新的经济有效的方法。
所有作者均声明不存在利益冲突



























